神经降压素在胆管细胞癌中的表达及对预后的影响
2020-03-02许雅萍苏子剑刘小瑜
许雅萍, 苏子剑, 刘小瑜
胆管细胞癌是一种来自胆管上皮细胞的恶性肿瘤,根据其发生部位分为肝内胆管细胞癌及肝门部胆管细胞癌,是继肝细胞癌后第二常见的原发性肝肿瘤[1]。大多数胆管细胞癌患者被诊断时已处于晚期,从而失去了手术治疗的机会。神经降压素(NTS)是一种由13个氨基酸组成的神经肽,其参与黄体生成素和催乳素释放的调节,并与多巴胺能系统相互作用[2-3]。NTS最早是从牛下丘脑提取物中分离出来的,其能够在麻醉大鼠暴露的皮肤区域引起可见的血管舒张[4]。NTS还具有促进组织生长的能力,其不仅能调节正常组织生长,还能促进肿瘤生长[5-6]。已有研究发现NTS在肝细胞癌[7]、乳腺癌[8]、胶质瘤[9]、结肠癌[10-11]和胰腺癌[12]中高表达,且这些癌症患者的NTS高表达水平与其预后差呈正相关。目前关于NTS与胆管细胞癌恶性发展进程的研究尚少。本研究通过检测NTS在胆管细胞癌组织及癌旁组织中的表达情况,探讨NTS表达与胆管细胞癌病理参数的关系及对胆管细胞癌预后判断的意义。
1 资料与方法
1.1 一般资料
选择2010年6月至2018年12月在福建医科大学附属泉州第一医院肿瘤外科行手术治疗的50例胆管细胞癌患者,排除术前行全身放化疗、伴有远处转移及合并其他器官病变的患者。本组50例患者中男28例,女22例;年龄24~71(54.1±11.1)岁;乙肝表面抗原(HBsAg)阳性20例,阴性30例;TNM分期:Ⅰ期3例(6%),Ⅱ期19例(38%),Ⅲ期28例(56%);肿瘤直径≤5 cm者31例(62%),>5 cm者19例(38%);Child-Pugh分级A级40例(80%);B级10例(20%);肿瘤为单个20例(40%),2个及以上30例(60%);合并血管浸润31例(62%);合并腹水6例(12%);合并淋巴结转移17例(34%);甲胎蛋白(AFP)≥20 μg/L 28例(56%)。所有患者均由同一组外科医生进行手术治疗,术中获取其胆管细胞癌组织及癌旁组织用于以下实验,术后病理学检查均证实为胆管细胞癌。所有患者随访至2018年12月30日。生存时间按月计算,以手术日期起至死亡日期或末次随访日期。本研究得到我院伦理委员会的批准。
1.2 实验方法
1.2.1 免疫组织化学法(IHC)检测NTS的表达水平 将组织取材后用4%的多聚甲醛固定,修整组织、洗涤、脱水、透明、浸蜡、包埋后切片机连续切片,厚度4 μm,裱于硅化载玻片上56 ℃烤片2 h后进行染色。切片经常规脱蜡、乙醇浸泡、蒸馏水浸泡、封闭内源性过氧化酶、抗原修复、封闭非特异性抗原、孵育一抗、二抗、DAB显色、苏木素复染细胞核,最后进行脱水及封片。按照说明书检测NTS的表达水平。光镜下观察免疫组化染色结果,细胞相应部位出现棕褐色颗粒物质为阳性表现。每张切片任意选取10个高倍镜(400倍)视野观察计数,取平均值,阳性细胞百分比<10%为低度,10%~50%为中等程度,>50%为强阳性。
1.2.2 Real-time PCR检测NTS mRNA水平 提取总RNA,按1∶100稀释后于260 nm波长处测量其光密度(OD260)值,连续测3次取其平均值;根据下列公式计算总RNA的含量(ng/μl)=OD260×40 ng/μl×稀释倍数。采用PrimscriptTMRT reagent Kit试剂盒及PCR仪进行逆转录合成cDNA;使用ABI PRISM 7300序列检测器通过实时PCR测量特定转录产物的原始量。引物序列正向:5’-CTTCTGACTTTTACGGACTT-3’,反向:5’-TTTGATGTATGCATATTGGT-3’。并对产物进行电泳验证。
1.2.3 Western blotting法检测NTS蛋白表达水平 将蛋白质进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,然后转移到硝酸纤维素膜上。用5%脱脂乳封闭膜,并与一抗孵育2 h。使用IRDye 800CW缀合的二抗和LI-COR成像系统检测特异性结合一抗的蛋白质条带。
1.3 统计学方法
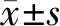
2 结果
2.1 NTS在胆管细胞癌组织和癌旁组织中的表达
2.1.1 免疫组化结果 NTS在胆管细胞癌组织中表达明显升高,表达位置位于细胞膜和细胞浆,细胞核未见表达(图1),8%(4/50)肿瘤组织呈低度表达,38%(19/50)呈中等程度表达,54%(27/50)呈强阳性表达。癌旁组织中NTS呈阴性表达。

图1 NTS在胆管细胞癌组织中的表达(Elivision染色,×400)
2.1.2 Real-time PCR检测结果 胆管细胞癌组织中的NTS mRNA表达水平为0.859±0.159,明显高于癌旁组织的0.506±0.131,差异有统计学意义(χ2=11.832,P<0.001)。
2.1.3 Western-blotting检测结果 胆管细胞癌组织中的NTS蛋白表达水平为0.289±0.092,明显高于癌旁组织中的0.133±0.038,差异有统计学意义(χ2=10.859,P<0.001),见图2。

T:肿瘤组织,P:癌旁组织图2 Western-blotting检测肿瘤组织和癌旁组织中的蛋白水平
2.2 胆管细胞癌患者NTS表达情况与临床病理特征的关系
不同TNM分期、肿瘤直径、肿瘤数目、淋巴结转移状况患者的NTS表达水平差异有统计学意义(P<0.05),不同性别、年龄、HBsAg状态、术前Child-Pugh分级、有无血管浸润、有无腹水和不同AFP水平患者的NTS表达水平差异无统计学意义,见表1。
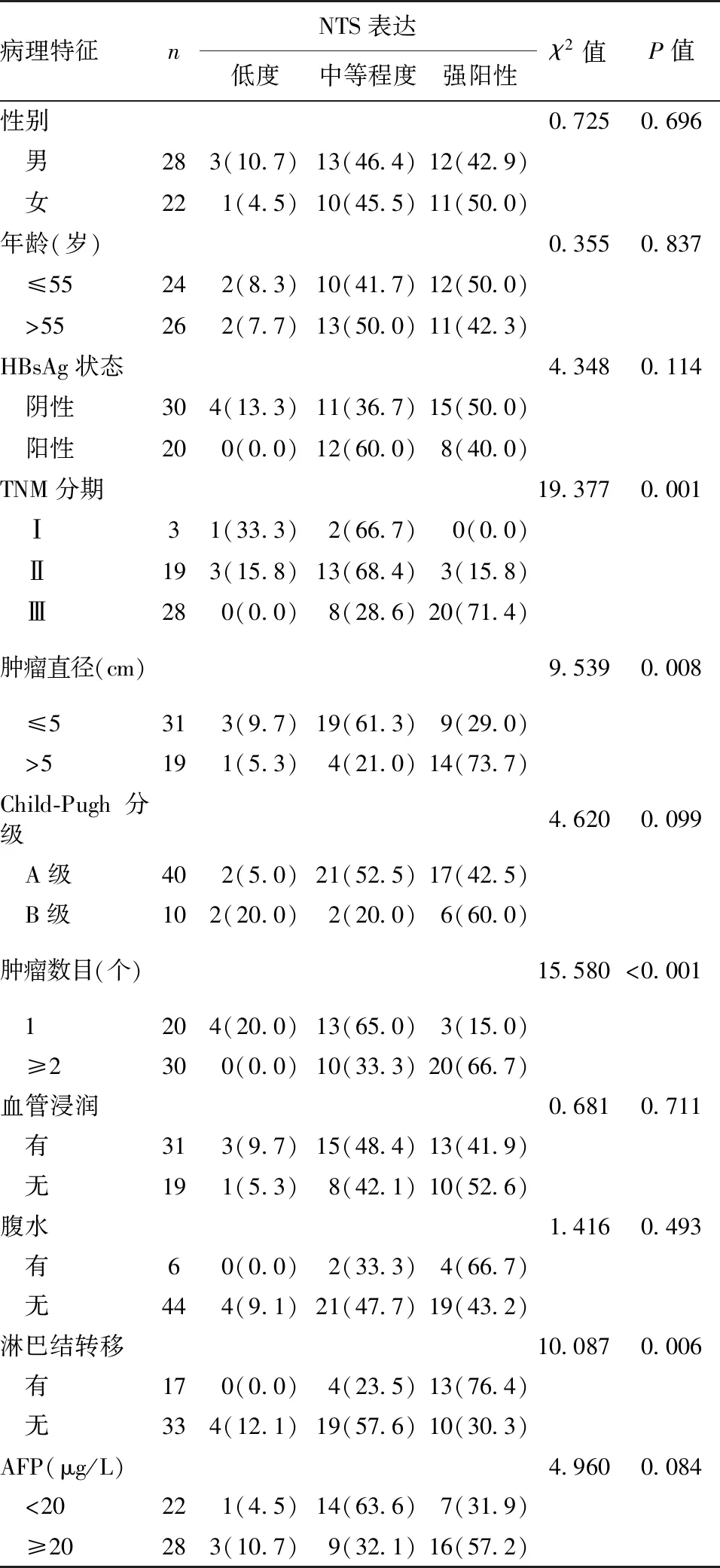
表1 胆管细胞癌患者NTS表达情况与临床病理特征的关系
2.3 胆管细胞癌患者预后的影响因素分析
以患者生存期、生存状态为因变量,以性别(女=0,男=1)、年龄(≤55岁=0,>55岁=1)、HBsAg状态(阴性=0,阳性=1)、TNM分期(Ⅰ期=1,Ⅱ期=2,Ⅲ期=3)、Child-Pugh分级(A级=0,B级=1)、肿瘤直径(≤5 cm=0,>5 cm=1)、肿瘤数目(1个=0,≥2个=1)、血管浸润(无=0,有=1)、腹水(无=0,有=1)、AFP(<20 μg/L=0,≥20 μg/L=1)、淋巴结转移(无=0,有=1)及NTS(<10%=1,10%~50%=2,>50%=3)为自变量,进行多因素Cox回归分析患者预后的影响因素,结果显示NTS高表达是影响患者预后的独立危险因素(P<0.01),见表2。
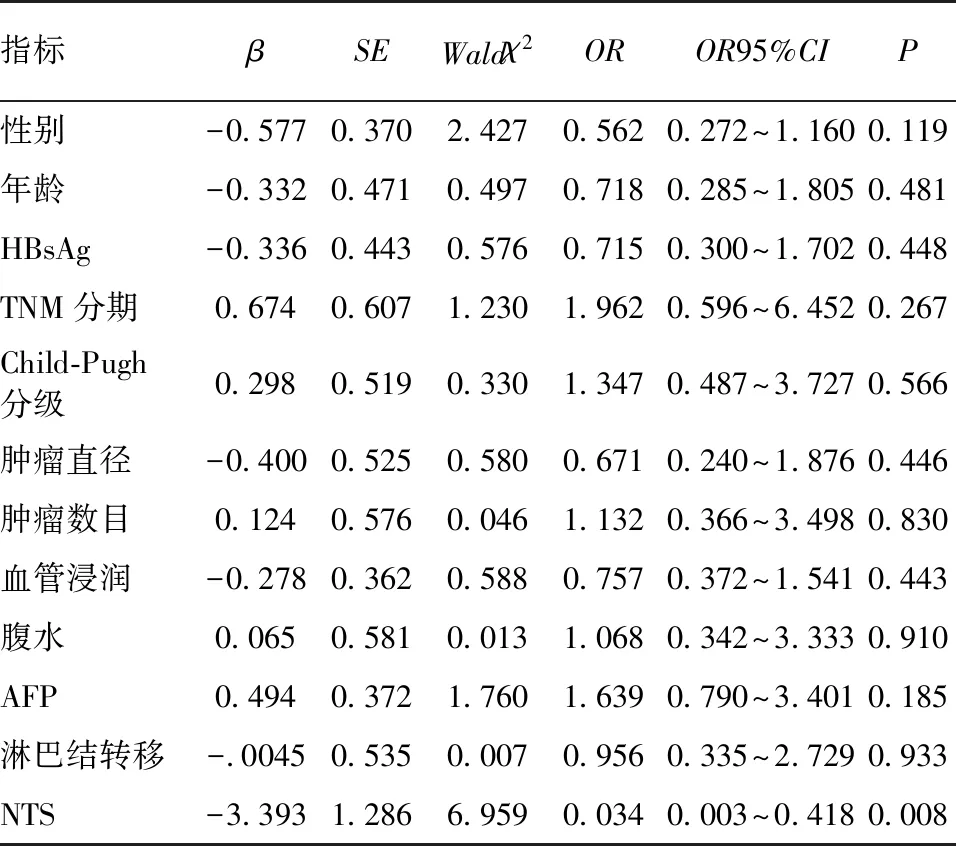
表2 影响胆管细胞癌患者预后的多因素Cox回归分析结果
2.4 NTS判断预后的最佳界值的计算
通过绘制受试者工作特征(ROC)曲线,计算NTS判断预后的最佳界值为41.8%,其灵敏度为0.69,特异度为0.88,ROC曲线下面积为0.847[95%CI=0.722~0.971)],超过41.8%代表预后差,见图3。

图3 胆管细胞癌患者NTS最佳界值分析
3 讨论
胆管细胞癌是一种发生于肝脏胆管的高度恶性肿瘤,预后不良[13]。目前可供选择的治疗方案限于手术治疗,但由于其高复发率和高转移率,治疗的结果不令人满意[14-15]。此外,目前临床上可用于预测胆管细胞癌预后的生物标志物很少。因此,迫切需要找到新的生物标志物以提高胆管细胞癌的早期诊断率并判断预后。本研究结果提示NTS可能参与了胆管细胞癌发展的进程,其高表达提示胆管细胞癌患者预后不良,表明NTS可能是胆管细胞癌患者的新型预后生物标志物。
NTS的作用由3种NTS受体(NTSR)亚型介导,其中两种为G蛋白偶联受体,包括对NTS表现出高度亲和力的NTSR1和低亲和力的NTSR2[16]。研究表明,NTS及其受体与多种人类癌症的发展有关,包括肝细胞癌[7]、胰腺癌[17]、肺癌[18]、胃癌[19]、前列腺癌[20]、结肠癌[21]和乳腺癌[22],以上均是由于NTS和NTSR在肿瘤发生早期阶段的失调导致的。在胶质瘤中,NTS通过激活NTSR1促进胶质瘤细胞的增殖和侵袭能力,高水平表达的NTS和NTSR1提示患者预后不良[9]。在浸润性乳腺癌[23]和前列腺癌[24]中,NTS和NTSR1的过度表达也提示患者预后不良。在非小细胞肺癌(NSCLC)中,NTS存在于大约60%的肺腺癌活检标本中[25]。在人肺癌细胞中,NTS除了刺激原发性肿瘤生长,还能通过自分泌和旁分泌的方式调节并促进大量淋巴结转移[26]。NTS还影响肠道、胃和肾上腺皮质的生长[27]。细胞学研究也发现NTS可刺激人类结肠癌细胞系(SW480、SW620、HT29、HCT116和Cl.19A)的生长[28]。总之,NTS/NTSR1早期阶段的失调导致癌症进展和恶性胶质瘤、乳腺癌、前列腺癌的预后不良。因此,NTS和NTSR1可能是许多癌症早期诊断和判断预后的生物标志物。本研究结果显示:胆管细胞癌组织中NTS的mRNA和蛋白表达水平均明显高于癌旁组织,差异有统计学意义。NTS是影响患者预后的独立危险因素,高表达的NTS提示患者预后更差、生存期更短。说明NTS可能对胆管细胞癌的侵袭及转移起一定的作用,NTS可能是预测胆管细胞癌患者预后的一种新型生物标志物。
