乳腺导管内癌及导管内癌伴微浸润的临床、病理及超声特征对比研究
2020-03-02聂晨蕾易春蓓巩海燕王慧苏彤栗翠英
聂晨蕾, 易春蓓, 巩海燕, 王慧, 苏彤, 栗翠英
导管内癌(ductal carcinoma in situ, DCIS)又名乳腺导管原位癌,是肿瘤细胞局限于导管内,尚未突破基底膜的一种病变,通常伴有上皮细胞的轻度至重度不典型增生,有发展为浸润性导管癌的趋势[1]。随着影像诊断技术的不断发展以及女性对自身健康状况的日益重视,导管内癌的检出率日益提高,约占乳腺癌整体的20%[2]。导管内癌属于非浸润性乳腺癌,很少有淋巴结的转移,通过及时有效的手术治疗,导管内癌患者的预后情况非常好,10年内患者累积死亡率仅为1.4%~2.8%[3]。导管内癌伴微浸润(ductal carcinoma in situ with microinvasion,DCIS-MI)是指肿瘤细胞突破基底膜但浸润灶最大径不超过0.1 cm[4]。有研究认为导管内癌伴微浸润是导管内癌发展为浸润性导管癌(invasive ductal carcinoma,IDC)的中间过程[5]。本研究旨在为临床医师预判DCIS以及DCIS-MI提供更多依据,回顾性分析了103个DCIS及73个DCIS-MI的临床、病理以及超声特征差异。
1 资料与方法
1.1 一般资料 选取2016年1月至2018年11月江苏省人民医院经手术病理证实为DCIS的病灶(DCIS组)及DCIS-MI的病灶(DCIS-MI组),且超声表现为肿块型。纳入标准:① 在我院进行手术,且术后病理为DCIS或DCIS-MI;② 术前均行常规彩色多普勒超声检查且超声表现为肿块型,有完整的影像学资料;③ 有完整的临床资料。排除标准:① 心肺系统有严重损害;② 有精神疾病;③ 合并浸润性导管癌及其他类型的乳腺肿瘤;④ 术前行新辅助化疗者;⑤ 临床及病理资料不全者。本研究经我院医学伦理委员会批准后实施。
1.2 方法 由拥有丰富工作经验的超声科医师对患者进行扫查。检查时患者平卧、手上举,充分暴露双乳及腋窝,以乳头为中心对乳房的4个象限沿逆时针或顺时针方向进行扫查,同时对双侧腋窝Ⅰ区、Ⅱ区、Ⅲ区及内乳区淋巴结进行扫查。根据超声乳腺影像报告和数据系统(breast imaging reponing and databasesystem,BI-RADS)对病灶的形态、大小、边缘、方位、内部回声、后方回声、有无钙化、导管是否扩张、血流以及周围组织进行观察。
1.3 病理学诊断 乳腺DCIS可根据肿瘤细胞的构型模式分为多种类型,包括粉刺型、实体型、筛状型、乳头型、微乳头型等。目前临床上主要依据细胞核的核级、管腔内坏死情况及核分裂象将DCIS分为低级别、中级别以及高级别3个级别。免疫组织标记物主要包括以下4种:雌激素受体(ER),孕激素受体(PR),人类表皮生长因子2(HER-2)以及Ki-67。根据这4种免疫组化标记物将乳腺癌分为4种分子亚型:Luminal A型、Luminal B型、HER-2阳性以及三阴性乳腺癌。
1.4 统计学方法 采用SPSS 21.0软件,计数资料以百分位数表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 本研究共纳入174例女性患者,共176个病灶(其中1例患者检出3个病灶且病理类型均为DCIS)。DCIS组103个(58.5%),年龄32~81岁,平均年龄(51.0±10.2)岁;DCIS-MI组73个(41.5%),年龄27~74岁,平均年龄(51.9±10.2)岁。两组的临床表现比较详见表1。两组在年龄及淋巴结转移上的差异不具有统计学意义(P>0.05),DCIS组的首发临床症状表现为钼靶钙化灶的共42个(40.8%),肿块最大径≥2.5 cm的共28个(27.2%)病灶,与DCIS-MI组相比,差异具有统计学意义(P<0.05)。
2.2 病理学特征 DCIS组与DCIS-MI组的病理组织学分型比较见表2。DCIS-MI组病理组织分级主要以高级别为主(72.60%),与DCIS组(42.7%)相比差异具有统计学意义(P<0.05)。在病理分子分型上DCIS组Luminal A型(38.8%)高于DCIS-MI组(17.8%),差异具有统计学意义(P<0.05)。
DCIS组与DCIS-MI组的免疫组织化学特征比较见表3。两组在PR表达上差异无统计学意义(P>0.05),在ER、HER-2及Ki-67表达上DCIS-MI组ER阴性率(37.0%),HER-2阳性率(64.4%)以及Ki-67增殖指数≥14%发生率(79.5%)均高于DCIS组,差异具有统计学意义(P<0.05)。
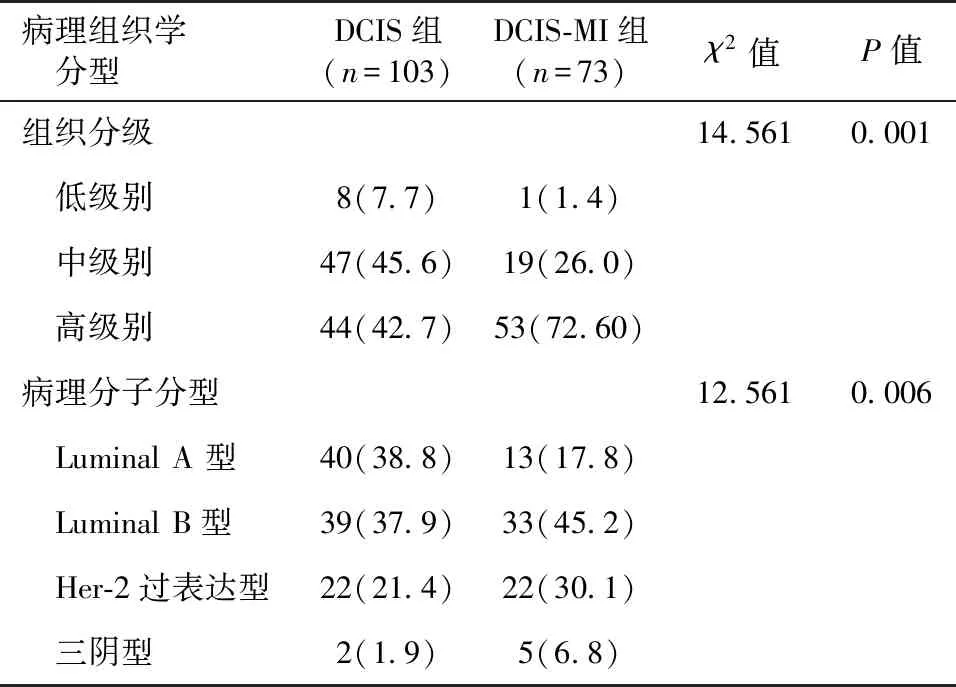
表2 DCIS组与DCIS-MI组的临床表现比较 [n(%)]
2.3 超声表现 DCIS与DCIS-MI在超声图像上的方向、后方回声、导管扩张以及血流阻力指数上差异无统计学意义(P>0.05)。两组在形态、边缘、内部回声、钙化以及血流分级上差异具有统计学意义(P<0.05)。DCIS-MI的声像图与DCIS相比,表现为形态不规则(86.3%)、边缘不光整(67.1%)、内部回声呈不均质低回声(67.1%)、内部伴钙化(69.9%)以及Alder血流分级以2、3级为主(84.9%)。详见表4,图1。
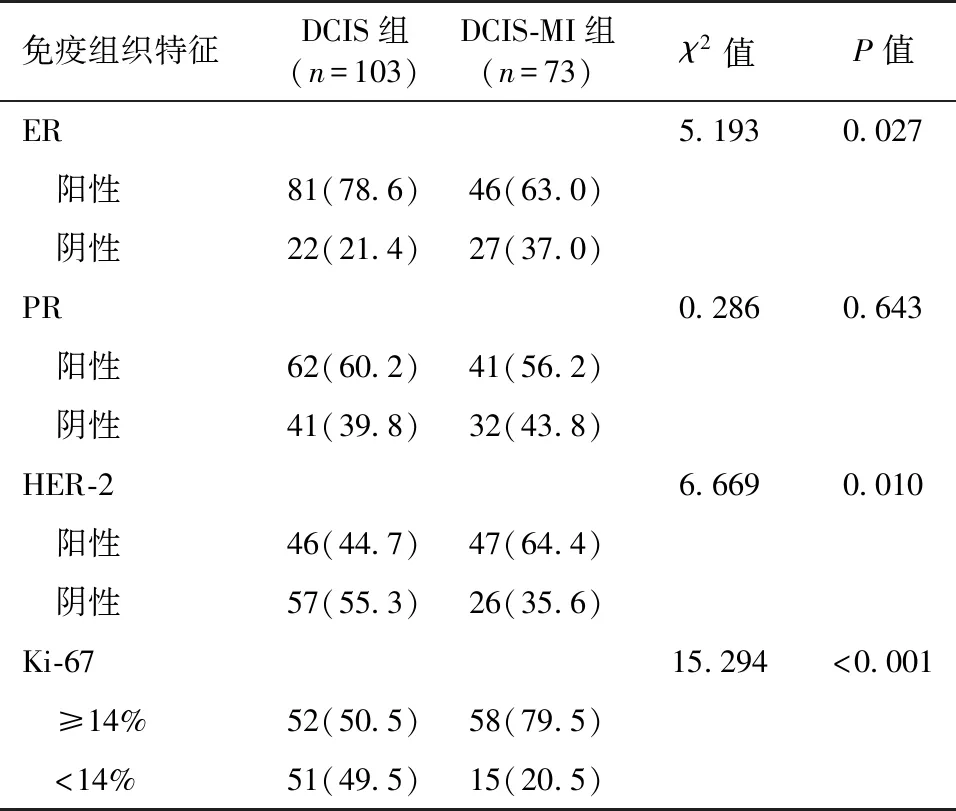
表3 DCIS组与DCIS-MI组的临床表现比较 [n(%)]
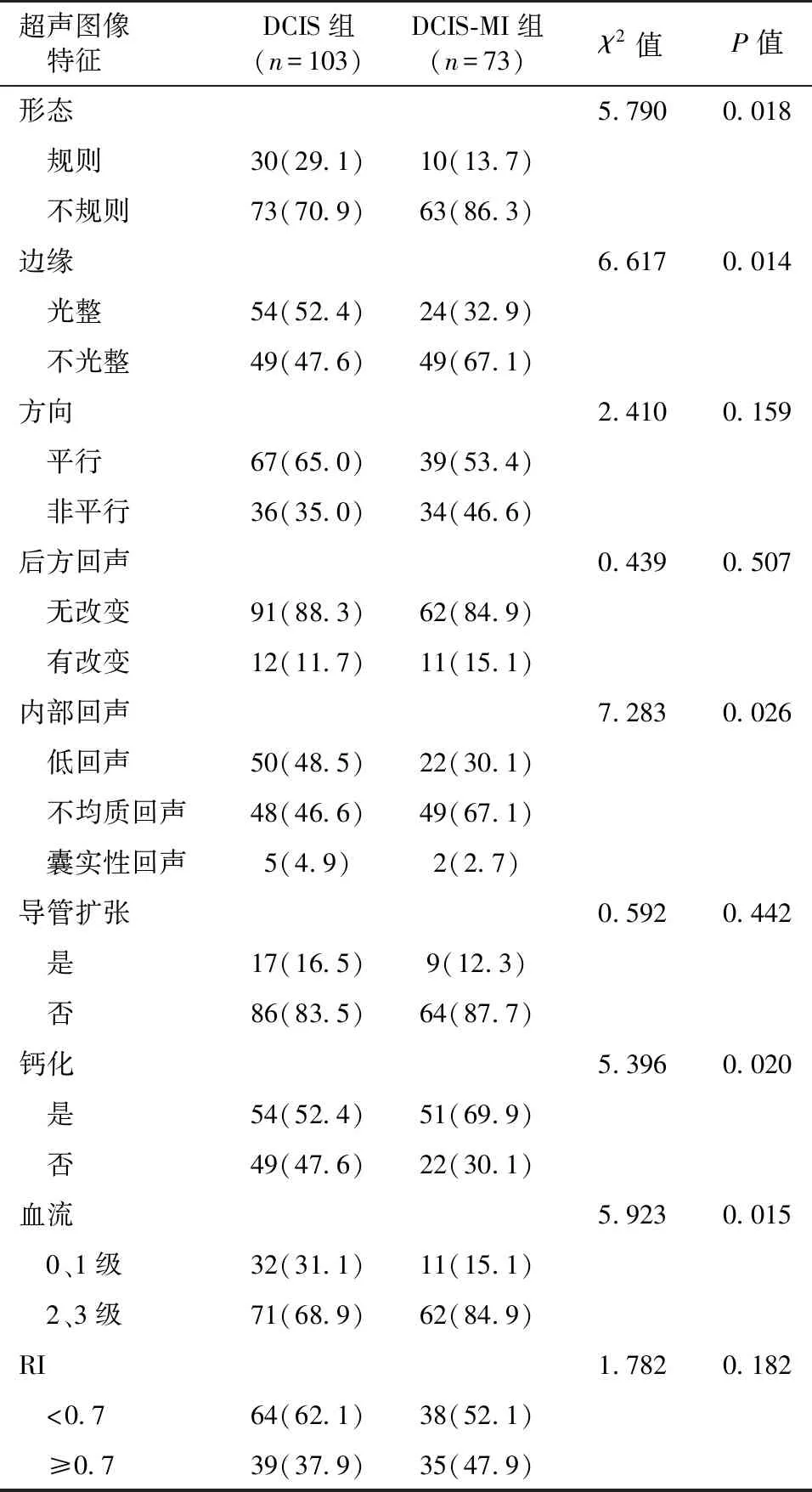
表4 DCIS组与DCIS-MI组的临床表现比较 [n(%)]

A:为DCIS的二维超声声像图,病灶形态不规则,边缘光整,内部回声呈低会声,病灶内未见明显钙化;B:彩色多普勒超声示病灶内血流丰富,Adler血流分级Ⅱ级;C:为DCIS-MI的二维超声声像图,病灶形态不规则,边缘不光整,内部回声不均匀,病灶内可见点条样强回声;D:彩色多普勒超声示病灶内血流丰富,Adler血流分级Ⅲ级图1 DCIS、DCIS-MI的二维超声声像图
3 讨论
乳腺癌的发病率目前在全世界呈上升趋势,是影响女性健康的主要恶性肿瘤之一。DCIS的病变局限于乳腺导管的上皮细胞内,尚未突破基底膜[1]。有研究指出DCIS具有发展为浸润性癌的趋势,DCIS-MI被认为是DCIS发展为浸润性癌的中间阶段[5]。目前临床上对DCIS发展为DCIS-MI的具体机制尚不清晰。
本研究176个病灶中,首发症状表现为肿块的DCIS占47个(47/103,45.63%),DCIS-MI占46个(46/73,63.0%);表现为乳头溢液的DCIS占14个(14/103,13.59%),DCIS-MI占10个(10/73,13.70%);表现为钼靶下钙化灶的DCIS占42个(42/103,40.78%),DCIS-MI占20个(17/73,23.3%),结果具有统计学意义(P<0.05)。本研究发现临床表现以肿块为主要症状的比例随浸润性的增加而增加,DCIS主要以乳头溢液以及钼靶下钙化灶为主,DCIS-MI则以肿块为主要表现,与Zhang等的研究结果一致。本研究中DCIS(0)与DCIS-MI(2.7%)的腋窝淋巴结转移率比较,差异无统计学意义(P>0.05)。有文献报道,DCIS的前哨淋巴结活检阳性率为0~10%[7],而DCIS-MI的前哨淋巴结转移率为0~25%[8],与DCIS相比,DCIS-MI淋巴结转移率更高,更倾向于浸润性癌,临床上应考虑行前哨淋巴结活检。Maffuz等[9]发现,肿块病灶越大,其发生浸润的风险就越高,当DCIS肿块最大径≥2.5 cm时,其伴有微浸润的概率增加,进而发展成为DCIS-MI。本研究中肿块最大径≥2.5 cm的DCIS占28个(28/103,27.2%),DCIS-MI占31个(31/73,42.5%),差异具有统计学意义(P<0.05),与上述研究相符。因此在临床上遇到肿块大小≥2.5 cm的病灶时,要考虑是否伴有浸润,以确定手术方式及治疗方案。
目前临床上主要将DCIS依据细胞核的核级、管腔内坏死情况及核分裂象分为低级别、中级别以及高级别3个级别,级别越高预后越差[10]。本研究中,DCIS-MI组病理组织分级主要以高级别为主(53/73,72.60%),与DCIS组(44/103,42.7%)相比差异具有统计学意义(P<0.05)。与徐明等[11]的研究结果一致,DCIS中高级别占37.0%,DCIS-MI中高级别占81.3%,差异具有统计学意义(P<0.05),提示DCIS-MI预后较DCIS差。雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子2(HER-2)以及Ki-67是临床上用来判断乳腺癌预后情况以及制定相应治疗方案。本研究中DCIS-MI组ER阴性率(27/73,37.0%),HER-2阳性率(47/73,64.4%)以及Ki-67增殖指数≥14%发生率(58/73,79.5%)均高于DCIS组,差异具有统计学意义(P<0.05),表明随着浸润程度的加深,ER阳性率下降,HER-2阳性率以及Ki-67≥14%率增加,与Mori等[12]研究类似。分子分型上,Fang等[13]发现DCIS中Luminal A型占31.5%~55.1%,DCIS-MI中Luminal A型占15.3%。本研究结果提示,预后较好的Luminal A型DCIS组占40个(40/103,38.8%)高于DCIS-MI组的13个(13/73,17.8%),差异具有统计学意义(P<0.05)。DCIS由于肿瘤细胞局限在导管内,尚未突破基底膜,病理分子分型以Luminal型为主,尤以预后最好的Luminal A型占多数,而DCIS-MI虽浸润灶最大径不超过0.1 cm,但仍具有浸润性癌的特征,分子分型上以Luminal B型为主,预后较DCIS差。
DCIS通常伴有上皮细胞的轻度至重度不典型增生,超声表现也多种多样。张丽丹等[14]研究者将导管内癌的超声图像分为以下:① 导管扩张型;② 团块型;③ 类腺病型;④ 单纯钙化型;⑤ 无异常表现型。本研究主要针对肿块型的DCIS及DCIS-MI的超声图像进行分析。DCIS-MI以粉刺型为主,病变沿导管走行,浸润导管基底膜,导致上皮细胞缺失,肿瘤突出基底膜,从而表现出形态不规则,边缘不光整。肿块型DCIS与肿块型DCIS-MI在超声声像图上均可表现为点状钙化,大多是位于低回声病灶内呈簇状分布,但DCIS-MI的钙化灶检出率(51/73,69.9%)大于DCIS组(54/103,52.4%),差异具有统计学意义(P<0.05),可能是由于DCIS-MI是在DCIS的基础上肿瘤细胞浸润基底膜,期间肿瘤细胞增殖坏死,使得更多的钙盐沉积,形成更多的钙化灶。本研究中DCIS-MI内部回声以不均质低回声为主,而DCIS则以低回声为主,这可能与DCIS-MI病灶内间质成分较多有关。此外,本研究中DCIS-MI组的血流信号2~3级的检出率(62/73,84.9%)高于DCIS组(71/103,68.9%),差异具有统计学意义(P<0.05)。Jeffer等[15]研究发现DCIS-MI周边有微血管环绕,包绕导管基底膜形成一个基底膜血管套,同时病灶内含有较多间质成分,其内聚集的炎症细胞可使间质弥漫性血管化,该观点支持本研究结果。
综上所述,DCIS-MI与DCIS相比,具有部分浸润性癌的特征。超声图像上更多表现为形态不规则,边缘不光整,内部回声不均匀,内伴钙化,病灶内血流丰富,DCIS-MI较DCIS具有更高的恶性特征;病理上,DCIS-MI以Luminal B型及HER-2过表达型为主,组织分级则以高级别为主,预后也较DCIS差。临床上,DCIS-MI肿块大小以≥2.5 cm为主,以触及肿块肿块为首发临床症状。由于DCIS具有发展为浸润性癌的特征,而DCIS-MI则被认为处于DCIS与IDC的中间阶段,应做到早发现、早诊断。两者之间有不同的临床表现、病理特征以及超声声像图特点,可为临床诊断提供更多信息与依据。
