新生小鼠耳蜗基底膜的取材培养技术*
2022-09-20卢顺兰何金玲莫伟坚唐安洲谭颂华刘磊方勤谢利红
卢顺兰 何金玲 莫伟坚 唐安洲 谭颂华 刘磊 方勤 谢利红
1 广西医科大学第一附属医院耳鼻咽喉头颈外科(南宁 530021)
哺乳动物的听觉功能依赖于内耳毛细胞将声音振动转化为电信号,因此毛细胞损伤会导致听力损失。与鸟类动物毛细胞拥有持续再生能力相比,成年哺乳动物毛细胞缺乏再生的能力,只有胚胎发育和新生儿早期存在有限的毛细胞再生能力[1],因此胚胎小鼠以及新生小鼠被广泛应用于包括药物、噪声等各种原因所致听力损失的体外研究及毛细胞的再生研究。尽管各种实验的内容和目的不同,体外研究中都不可避免地需要取出耳蜗基底膜进行组织块培养,以进一步观察毛细胞或支持细胞的形态及进行分子生物学研究等[2~6]。既往多数研究做基底膜培养时多使用E18的胚胎小鼠,但胚胎小鼠耳蜗组织更微小,技术要求更高[7,8],使用新生小鼠能降低基底膜取材培养技术难度,便于开展基底膜培养的内耳相关研究。由于内耳结构复杂,取材难度大,了解新生小鼠的内耳结构、掌握小鼠内耳基底膜取材技术是开展内耳研究的最基本的要求。因此,本文通过图解逐步介绍新生小鼠耳蜗基底膜取材培养技术,为初学者提供参考。
1 材料与方法
1.1实验动物 选取出生3天内的新生小鼠3只,雌雄不限,行基底膜的显微解剖与培养,本实验通过伦理委员会的批准,动物处死前均进行深度麻醉。
1.2新生小鼠耳蜗基底膜的解剖 为防止基底膜体外培养过程中受到污染,所有解剖器械预先高压灭菌,将新生小鼠头部用75%的乙醇消毒, 断头,放入预冷的PBS液中,显微镜下沿正中从枕骨大孔处剪开颅骨,去除脑组织,取下两侧颞骨后放入装有预冷的PBS 液的解剖培养皿中,显微镊去除耳蜗蜗壳、螺旋韧带,前庭膜,保留蜗轴及包含 Corti 器的基底膜,从底回到顶回完整地将整个基底膜从蜗轴上分离(图1、2)。具体步骤如下:①断头,正中从枕骨大孔处剪开颅骨顶骨(图1a、b),去除脑组织,显微镊去除已剪开的顶骨骨质,从颅骨面暴露双侧颞骨,此时可见双侧耳蜗蜗尖朝向颅底中线,半规管朝向外侧,且颞骨块与颅底骨质间有间隙,显微镊插入间隙中分离颞骨块并将其取出,此时颞骨块形似花生(图1c、d)。②取下包含耳蜗、前庭及半规管的内耳组织颞骨块,表面可见膜性组织,鼓室面耳蜗表面有一圆形软骨环样结构,去除膜性组织及软骨环样结构,取下镫骨,可清晰暴露耳蜗、圆窗和前庭窗,前庭窗深面可见球囊,椭圆囊表面有白色耳石(图1e)。③用显微镊从圆窗或前庭窗插入(图1f),沿着耳蜗走行去除耳蜗表面的未钙化的蜗壳,完全暴露耳蜗外侧结构螺旋韧带(图1g),显微镊从钩回或底回插入螺旋韧带与基底膜之间并分离出部分螺旋韧带,夹住分离端并撕下螺旋韧带,此时可见前庭膜及基底膜,撕下前庭膜,保留蜗轴及基底膜,从底回到顶回完整地将整个基底膜从蜗轴上分离(图1h)。整个分离过程都在预冷的无菌PBS液中进行,时间尽量控制在10分钟之内。
1.3基底膜铺片及培养 培养皿中放入细胞爬片,细胞贴壁粘附剂(普利莱,C1010,中国)用PBS稀释至1:200,滴加于细胞爬片表面,使其完全覆盖细胞爬片,室温静置30分钟后PBS洗去,加入培养液备用。将剥离完整的基底膜用小刮匙移入10%FBS 的 DMEM 培养液的培养皿中(图3a、b),分清基底膜中阶面及鼓阶面后,将中阶面朝上,吸出部分培养液(图3c),显微镜下调整基底膜位置使其充分展开贴壁,此时完全吸干净培养液(图3d),静置约1分钟后,重新缓慢逐滴加入培养液,保证基底膜贴壁不浮起,小心平稳的放置于37 ℃、5%CO2培养箱中培养。基底膜培养体系:13.5 ml DMEM,1.5 ml FBS, 15 μl青链霉素混合液(100×)。
1.4基底膜免疫荧光染色 基底膜用4%的多聚甲醛固定30分钟;PBS 清洗;0.4% Triton X-100 PBS 提高细胞通透性3次,每次5分钟,加入一抗Goat anti-Sox2 (1∶200, R&D Systems, AF2018,USA),Rabbit anti-Myosin VIIa (1∶300,Abcam,ab150386,UK)后4 ℃冰箱孵育过夜;0.4% Triton X-100 PBS 清洗 3次,每次5分钟,加入相应荧光二抗Donkey anti-Goat Alexa Fluor 488 (1∶2 000,Thermo Fisher Scientific, A-11055,USA), Donkey anti-Rabbit Alexa Fluor 555 (1∶2 000,Thermo Fisher Scientific, A-31572,USA)避光孵育1小时;PBS 清洗 3 次,取下培养皿细胞爬片,封片后共聚焦显微镜下观察。

图1 新生小鼠耳蜗基底膜取材解剖 a. 小鼠头部; b. 剪开颅骨顶骨; c. 去除脑组织,显示颞骨块; d. 颞骨块颅底面; e. 颞骨块鼓室面; f. 显微镊从前庭窗插入; g. 分离蜗壳; h. 基底膜及螺旋韧带
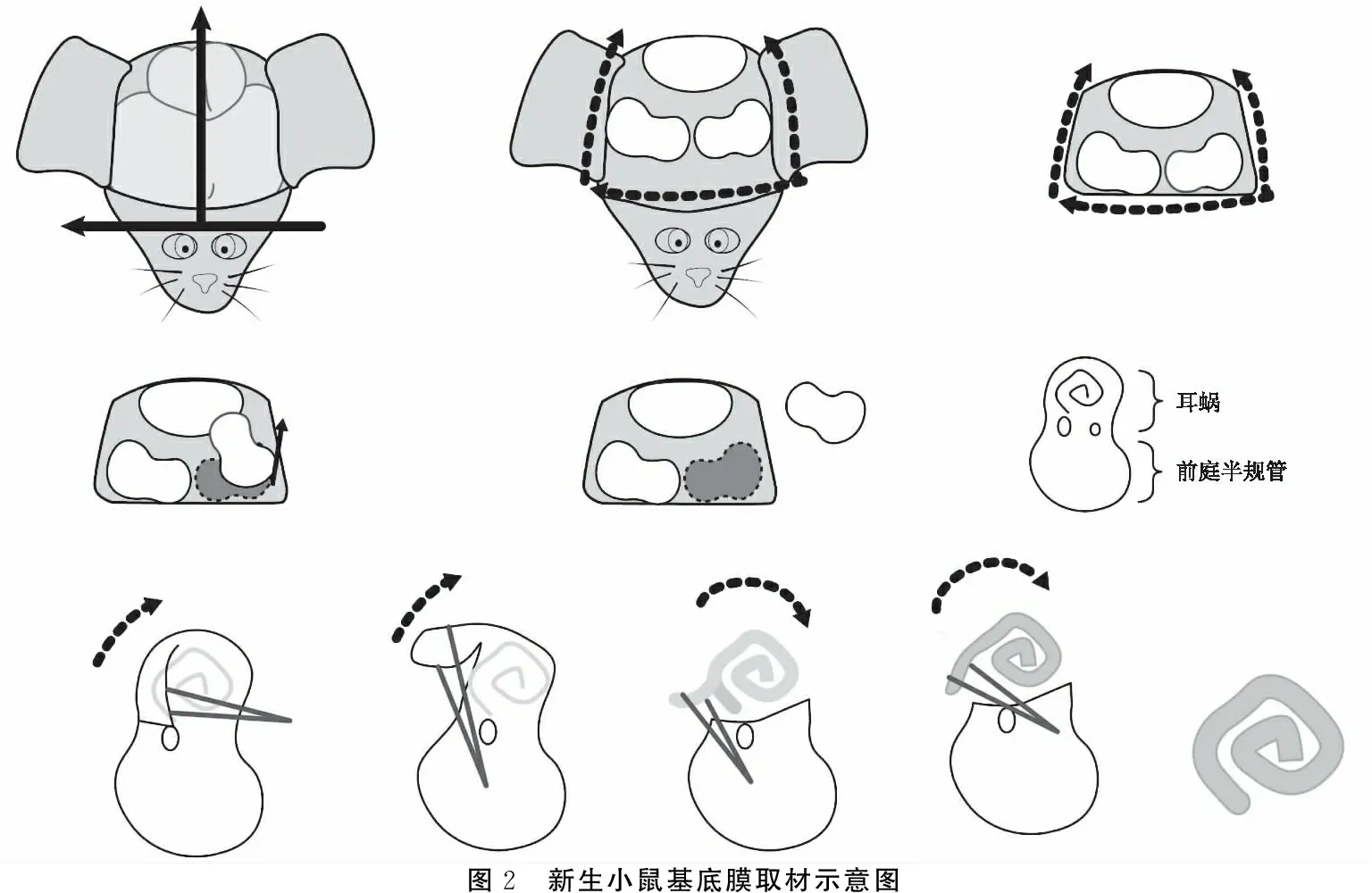
图2 新生小鼠基底膜取材示意图
2 结果
成功分离出完整基底膜,呈自然卷曲状态(图1h),倒置显微镜下观察基底膜的存活情况,若基底膜贴壁不浮起,其周边长出增殖细胞,表示基底膜存活,随着时间的延长,周边生长的细胞数量逐渐增多,提示基底膜生长良好(图4a、b)。若基底膜卷曲、浮起或者基底膜不卷曲,但其周围未见细胞增殖爬出,培养液比较浑浊,提示基底膜未存活(图4c、d)。免疫荧光染色显示出基底膜上的毛细胞与支持细胞的位置及数量(图5)。

图3 基底膜铺片培养 a. 基底膜移入培养皿; b. 调整基底膜中阶面朝上; c.吸出部分培养液,调整基底膜位置及展开; d. 吸干净培养液使基底膜贴壁
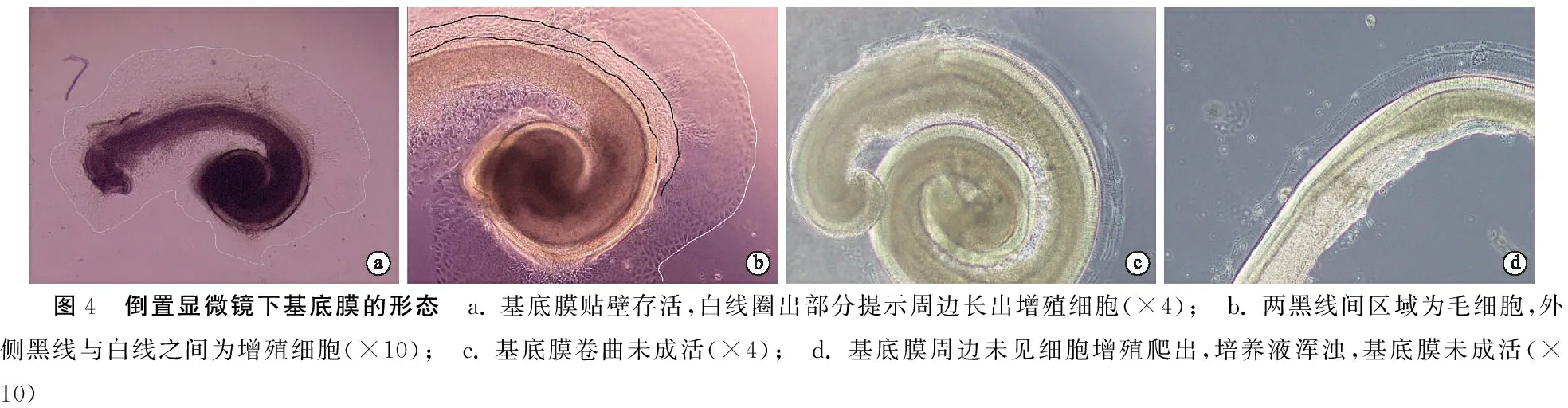
图4 倒置显微镜下基底膜的形态 a. 基底膜贴壁存活,白线圈出部分提示周边长出增殖细胞(×4); b. 两黑线间区域为毛细胞,外侧黑线与白线之间为增殖细胞(×10); c. 基底膜卷曲未成活(×4); d. 基底膜周边未见细胞增殖爬出,培养液浑浊,基底膜未成活(×10)
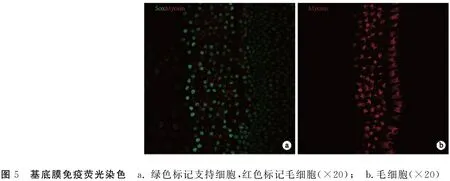
图5 基底膜免疫荧光染色 a. 绿色标记支持细胞,红色标记毛细胞(×20); b.毛细胞(×20)
3 讨论
在内耳病理学研究和组织化学研究以及分子生物学研究中,体外培养耳蜗基底膜是常用的研究方法之一[2]。体外培养基底膜是指通过显微解剖取出基底膜,加以不同的实验条件培养以达到各种实验目的的一种研究方法,通常作为开展体外内耳研究的第一步。在基底膜离体培养条件下,易于控制实验条件,减少体内其它混杂因素的干扰,有助于研究单一实验条件对基底膜及Corti器的作用,可结合免疫荧光染色分析基底膜上毛细胞与支持细胞的增殖、损伤等变化,为深入研究内耳毛细胞再生、药物损伤或保护内耳等机制打下基础。由于内耳解剖结构复杂精巧且膜迷路柔软轻薄,解剖过程中容易被器械损伤,取材难度较大,短时间内难以掌握,阻碍了初学者上述内耳研究实验的开展。本文介绍了新生小鼠的内耳基底膜取材方法,无论是新生小鼠还是成年小鼠的取材,都需要对小鼠内耳解剖结构了如指掌,更离不开在解剖显微镜下的实际操作练习。尽管有学者已经发表小鼠、大鼠等内耳解剖以及基底膜离体培养相关的文章[9-12]可供参考学习,但是多以文字为主,本文进一步补充了耳蜗基底膜解剖分离以及培养每一步骤的示意图及显微解剖图片,通过图解直观地展示了耳蜗基底膜解剖分离技术显微镜下操作的细节,相较于文字描述,更加简单易懂,有助于初学者一步一对照地练习基底膜取材技术。此外,以往研究常用的基底膜培养方法中多用胶原凝胶促进基底膜贴壁[7,10],胶原凝胶由三种溶液配制,分别是0.02N醋酸加上50X的I型鼠尾胶原蛋白(溶液A)和10X Basal Medium Eagle(溶液B)以及2%碳酸钠(溶液C),将A、B、C三种溶液按9∶1∶1的比例充分混合,滴于培养皿中,室温下放置30分钟凝结为固态的胶冻。本研究采用细胞贴壁粘附剂预先处理细胞爬片,不需要额外配制胶原凝胶,操作简单,基底膜附着细胞爬片贴壁效果良好,利用细胞贴壁粘附剂可以简化耳蜗基底膜离体培养步骤,提高基底膜贴壁成功率,有效缩短了实验操作时间,是一种可推广的改良基底膜培养方法。本文从取材培养到荧光染色,将整个过程具象化,希望能为需要学习取材培养技术的初学者提供更多相关细节,以尽快掌握基底膜取材培养技术,开展内耳研究。
