33例导管内癌组织形态观察及发病年龄分析
2017-06-27徐晶晶朱士俊李建宇
王 飞,徐晶晶,朱士俊,李建宇,朱 淼
(1.武警后勤学院附属医院,天津 300162;2.解放军301总医院,北京 100853;3.武警后勤学院药物化学与药物分析教研室,天津 300309;4.徐州医科大学研究生院,江苏 徐州 221004)
乳腺癌根据是否浸润到间质,可分为浸润性癌(invasive carcinoma)和非浸润性癌,其中的非浸润性导管癌,也称导管内癌、导管原位癌,指导管腺上皮癌变,癌细胞仅限于导管内,没有浸润到间质。导管内癌的组织形态多种多样,本文将就此进行研究,并探讨导管内癌在各年龄组中的发生率是否有差异。
1 资料与方法
1.1 一般资料
收集2013年资料完整的确诊导管内癌标本33例,年龄32~69岁,平均年龄50.9岁,按年龄分组,标本来源于手术及穿刺标本。
1.2 方法
常规HE染色:33例标本进行常规石蜡切片,HE染色,光镜下观察。免疫组化染色:(1)P63,产品编号:MAB-0365;(2)SMA,产品编号:MAB-0456。所选抗体均购自福建迈新生物技术有限公司,采用ABC法染色,P63以胞核棕色为阳性反应,SMA以胞浆棕色为阳性反应。
统计学方法采取卡方检验,应用SPSS进行统计学分析。

表1 各年龄导管内癌发生情况
2 结果
2.1 导管内癌的形态学观察
传统的组织学分型将导管内癌分为乳头型、低乳头型、筛状型、粉刺型及实性型。本研究33例导管内癌中,乳头型2例(6.1%),低乳头型4例(12.1%),筛状型4例(12.1%),粉刺型8例(24.2%),实性型15例(45.5%)。
乳头型导管内癌(papillary intraductal carcinoma):增生的癌细胞形成明显的乳头状结构,核大深染(图1)。低乳头型导管内癌(low papillary intraductal carcinoma):单纯的腺上皮增生癌变凸向导管腔内,似乳头样,但不伴有纤维结缔组织间质,且因上部生长较快形似蘑菇(图2)。筛状型导管内癌(cribriform intraductal carcinoma):癌细胞增生成形态规则的圆形筛孔(图3)。粉刺型导管内癌(comedo intraductal carcinoma):增生的癌细胞层数不等,细胞单一,中心部癌细胞坏死形成粉染无结构物质,可伴钙化(图4)。实性型导管内癌(solid intraductal carcinoma):腺上皮癌变增生,大小不一,细胞界限清楚,充满管腔(图5)。镜下观察:同一标本可有多种类型,各类型分界并不清楚,导管内癌与导管内乳头状瘤及浸润性癌有时很难区别,需借助免疫组化观察。
2.2 免疫组化观察
P63及SMA标记肌上皮,免疫组化显示导管内癌肌上皮围绕在管腔周围,管腔内不见肌上皮细胞,出现微浸润时(micro-invasion carcinoma)浸润部分的肌上皮细胞缺失(图6~图8)。
2.3 各年龄组导管内癌发生差异分析
0个单元(0.0%)具有小于5的期望频率。各年龄组导管内癌发生的理论数(Expected)为8.3,χ2=4.455,按自由度=3,P=0.216,可认为各年龄组导管内癌发生率相同。

图1 乳头型导管内癌(×400)
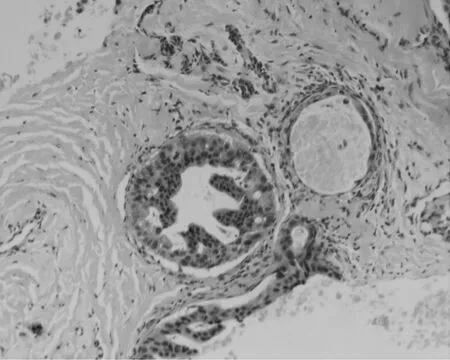
图2 低乳头型导管内癌(×400)

图3 筛状型导管内癌(×400)

图4 粉刺型导管内癌(×400)

图5 实性型导管内癌(×400)

图6 导管内癌()和微浸润()(×400)

图7 P63免疫组化结果导管内癌()和微浸润()(×400)

图8 SMA免疫组化结果 导管内癌()和微浸润()(×400)
3 讨论
导管内癌属于非浸润性癌,但被认为是浸润性乳腺癌的癌前病变[1]。导管内癌有多种形态,部分导管内癌可伴有微浸润,因此,在诊断导管内癌时,一定要多取材、多切片全面观察,必要时借助免疫组化标记肌上皮及基底膜[2]。如果镜下观察到如下现象时应警惕微小浸润癌的存在:(1)导管内癌体积大;(2)癌周边界不整齐,有出芽现象;(3)癌巢周有卫星灶;(4)粉刺型导管内癌;(5)主间质分界不清。导管内癌出现坏死及微浸润提示预后较差[3-4]。
文献报道乳腺癌好发于40~49岁女性[5],本研究结果各年龄组导管内癌的发生率并无差异,可能是与所选样本量差异。
总之,导管内癌取材及观察一定要全面细致,以防漏诊。
[1] NATIONAL INSTITUTES OF HEALTH.Diagnosis and management of Ductal Carcinoma In Situ(DCIS) [R].Bethesda:NIH State-of-the-Science Conference,2009.
[2] TROXELL M L,MASEK M,SIBLEY R K.Immunohistochemical staining of papillary breast lesions [J].Appl Immunohistochem Mol Morphol,2007,15(2):145-153.
[3] OKUMURA Y,YAMAMOTO Y,ZHANG Z,etal.Identification of biomarkers in ductal carcinoma in situ of the breast with microinvasion[J].BMC Cancer,2008,8(1):287-291.
[4] VERONESI P,INTRA M,VENTO A R,etal.Sentinel lymph node biopsy for localised ductal carcinoma in situ [J].The Breast,2005,14(6):520-522.
[5] 付丽,傅西林.乳腺肿瘤病理学[M].北京:人民卫生出版社,2008.
