HMGA2和Dvl2在涎腺导管癌中的表达及其与淋巴结转移、神经侵犯的相关性
2020-03-02杨香芳卫拴昱郑绘霞余飞燕
杨香芳,卫拴昱,宋 琛,郑绘霞,余飞燕,肖 虹*
(1山西医科大学基础医学院病理教研室,太原 030001;2大同市第三人民医院妇产科;3山西医科大学第一医院病理科;4山西医科大学口腔医院口腔内科;*通讯作者,E-mail:xiaohh9999@163.com)
涎腺导管癌(salivary duct carcinoma,SDC)来源于小叶间导管及排泄管细胞,是一种较罕见的唾液腺侵袭性肿瘤,约占涎腺恶性肿瘤的10%[1]。SDC于1968年由Kleinsasser等[2]首次报道,1990年被WHO单独分类列出[3]。人高迁移率族AT Hook蛋白2(high-mobility group AT-hook 2,HMGA2)是一种转录调节因子,在许多人类恶性肿瘤中都有高表达,它通过调节Wnt/β-catenin信号通路促进肿瘤增殖,可能是评估恶性肿瘤患者病情转归的分子标志物之一[4]。蓬乱蛋白Dsh2(Dishevelled-2,Dvl2)是Wnt/β-catenin信号通路的重要成员之一,有研究表明,HMGA2可通过结合Dvl2的转录启动子来激活Wnt/β-catenin信号通路,从而增加肿瘤的侵袭性[5]。但HMGA2和Dvl2在SDC的研究较少,本研究旨在通过测定HMGA2和Dvl2在SDC中的表达水平,分析探讨其在SDC发生发展中的作用。
1 资料与方法
1.1 一般资料
收集2010-2018年山西医科大学第一医院经病理确诊为SDC的病例25例,术前未行抗肿瘤治疗。其中男性19例,女性6例;年龄为40-79岁,中位年龄61岁。发生于腮腺的有22例,发生于其他部位的3例;肿瘤直径>3 cm的有8例,≤3 cm的有17例;淋巴结转移的有21例,有神经侵犯的11例,有脉管侵犯的5例,出现远处转移的3例。另选择20例癌旁涎腺组织作为对照,两组病例一般资料的比较见表1。本研究获山西医科大学第一医院伦理委员会批准,患者或近亲属对研究方案签署知情同意书。
1.2 主要试剂及试验方法
所有组织标本经10%中性甲醛固定,常规脱水、石蜡包埋切片,行HE染色和光镜观察。免疫组织化学法采用Envision两步法;一抗HMGA2兔抗人多克隆抗体和Dvl2鼠单克隆抗体均购自美国Santa Cruz公司;二抗工作液和DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 结果判读
HMGA2主要定位于细胞核,Dvl2定位于细胞质;阳性表现为淡黄或棕黄色颗粒;免疫组化评分均按照半定量评分法。HMGA2评分[6]:①阳性细胞数比例:阳性细胞数≤5%为0分,6%-25%为1分,26%-50%为2分,51%-100%为3分;②染色强度:无染色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。二者乘积为最终结果:0-3分为阴性,4-9分为阳性。Dvl2评分[7]:①阳性细胞比例:阳性细胞<10%为0分,阳性细胞10%-30%为1分,阳性细胞31%-50%为2分,阳性细胞51%-70%为3分,阳性细胞>70%为4分;②染色强度:细胞不着色为0分,细胞呈淡黄色为1分,细胞呈棕黄色为2分,细胞呈深棕黄色为3分。二者乘积为最终结果:0-4分为阴性,5-12分为阳性。
表1 SDC组与对照组病例的一般资料的比较
Table 1 Comparison of general data between SDC group and control group
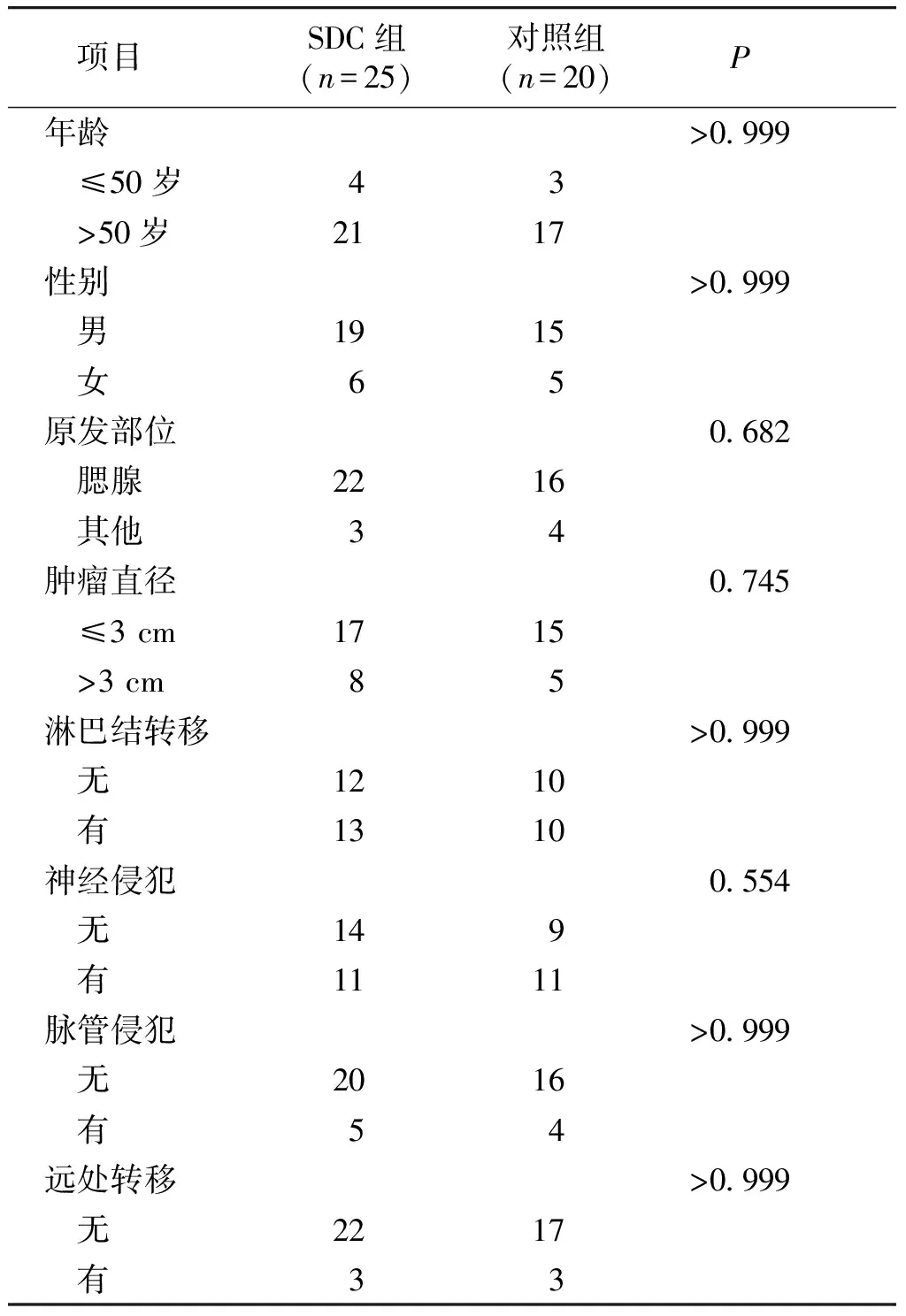
项目SDC组(n=25)对照组(n=20)P年龄>0.999 ≤50岁43 >50岁2117性别>0.999 男1915 女65原发部位0.682 腮腺2216 其他34肿瘤直径0.745 ≤3 cm1715 >3 cm85淋巴结转移>0.999 无1210 有1310神经侵犯0.554 无149 有1111脉管侵犯>0.999 无2016 有54远处转移>0.999 无2217 有33
1.4 随访
采用电话或门诊复查的方式进行随访,总生存期(overall survival,OS)的定义为手术日期至末次随访时间或因任何原因死亡的时间。本研究随访至2018年12月31日,随访3-72个月,中位随访时间为50.2个月,其中失访0例,随访率为100.0%。
1.5 统计学分析
采用SPSS 21.0版软件进行统计学分析。HMGA2和Dvl2的表达与SDC临床病理特征关系的分析采用Fisher’s确切概率法,HMGA2和Dvl2的相关性采用Spearman相关分析法;生存分析采用Kaplan-Meier法并行Log-rank检验;单因素和多因素分析采用COX回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 HMGA2和Dvl2在SDC和正常涎腺组织中的表达情况
HMGA2和Dvl2在SDC和正常涎腺组织中的表达情况见图1,2。SDC组织中HMGA2的阳性率为56.0%(14/25),Dvl2的阳性率为72.0%(18/25);癌旁涎腺组织中HMGA2和Dvl2的表达率分别为0%(0/20)和10.0%(2/20)。
2.2 HMGA2和Dvl2表达与SDC临床病理特征的关系
HMGA2表达与SDC患者淋巴结转移和神经侵犯有关(见表2),有淋巴结转移组的HMGA2阳性率高于无淋巴结转移(76.9%vs33.3%,χ2=3.205,P<0.05),有神经侵犯组的HMGA2阳性率高于无神经侵犯组(81.8%vs35.7%,χ2=3.608,P<0.05);HMGA2表达与其余临床病理特征无关(P>0.05)。Dvl2表达与SDC患者淋巴结转移有关,有淋巴结转移组的Dvl2阳性率高于无淋巴结转移组(50.0%vs8.3%,χ2=3.640,P<0.05);Dvl2表达与其余临床病理特征无关(P>0.05)。
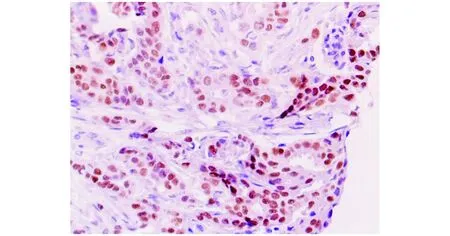
图1 HMGA2在SDC组织中呈阳性表达 (Envision法, ×200)Figure 1 HMGA2 positive expression in SDC (Envision,×200)
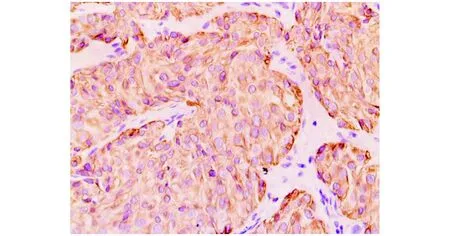
图2 Dvl2在SDC组织中呈阳性表达 (Envision法,×200)Figure 2 Dvl2 positive expression in SDC (Envision,×200)
表2 HMGA2和Dvl2表达与SDC临床病理特征的关系
Table 2 Relationship between the expression of HMGA2 and Dvl2 and the clinical pathological characteristics of SDC
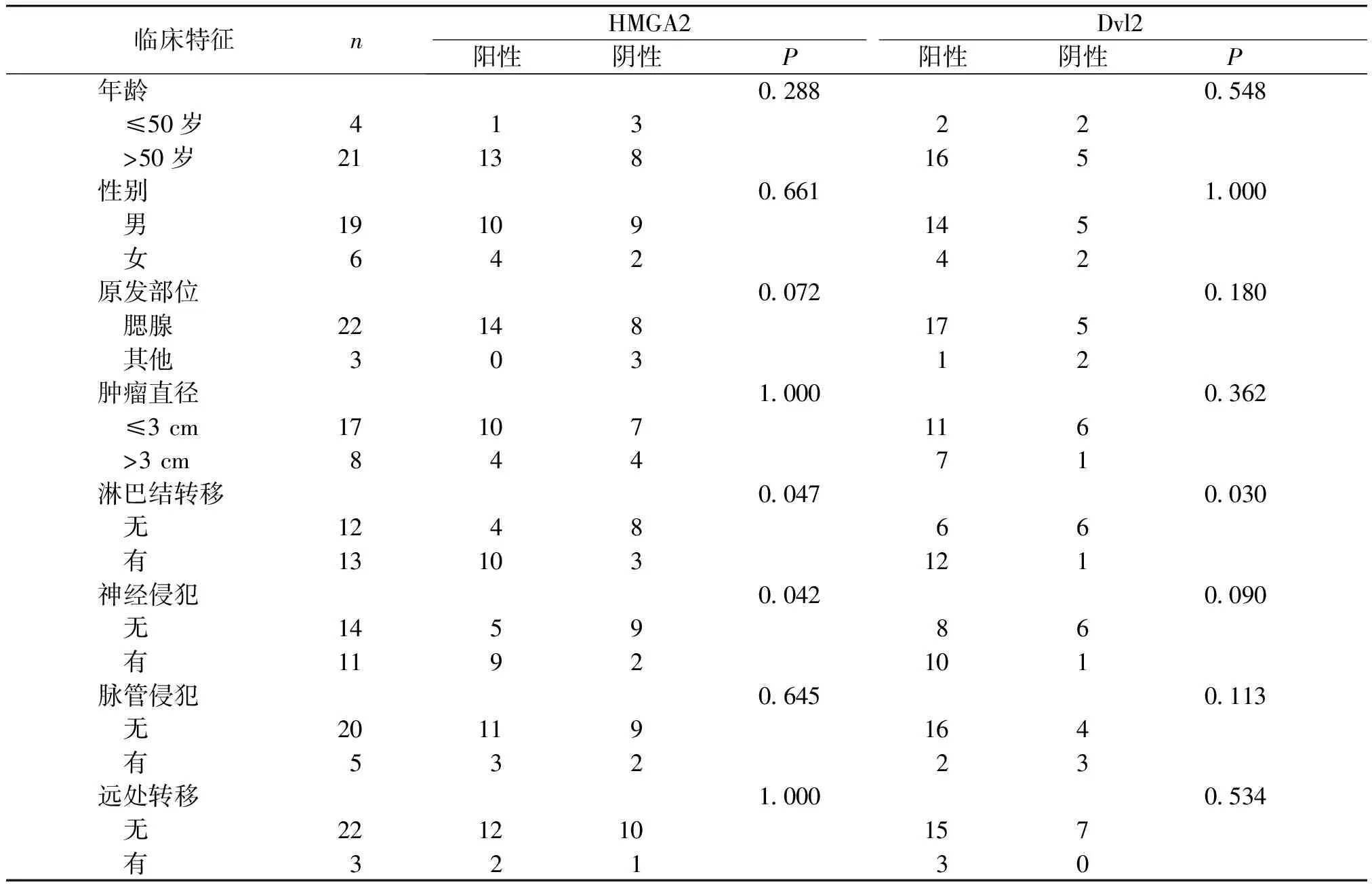
临床特征nHMGA2Dvl2阳性阴性P阳性阴性P 年龄0.2880.548 ≤50岁41322 >50岁21138165性别0.6611.000 男19109145 女64242原发部位0.0720.180 腮腺22148175 其他30312肿瘤直径1.0000.362 ≤3 cm17107116 >3 cm84471淋巴结转移0.0470.030 无124866 有13103121神经侵犯0.0420.090 无145986 有1192101脉管侵犯0.6450.113 无20119164 有53223远处转移1.0000.534 无221210157 有32130
2.3 HMGA2和Dvl2在SDC中表达的相关性分析
经Spearman相关分析显示,HMGA2和Dvl2在SDC中的表达呈正相关(r=0.524),差异有统计学意义(P<0.01,见表3)。
表3 HMGA2和Dvl2在SDC中表达的相关性分析
Table 3 Correlation between expression of HMGA2 and Dvl2 in SDC
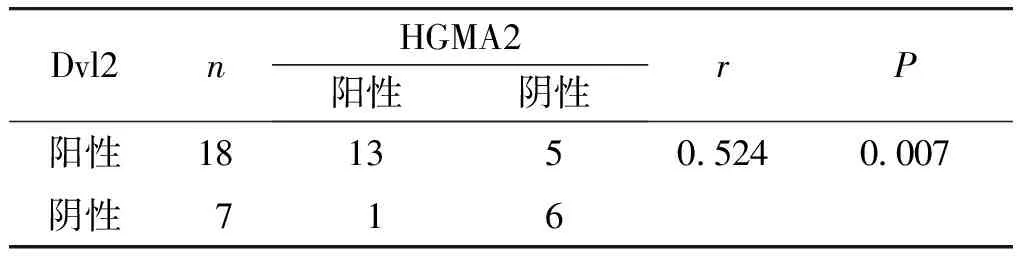
Dvl2nHGMA2阳性阴性rP阳性181350.5240.007阴性716
2.4 HMGA2和Dvl2表达对25例SDC生存期的影响
Kaplan-Meier生存曲线分析显示,25例SDC患者的总生存期为3-72个月,中位生存期为41.0个月,3年OS为51.3%,5年OS为26.6%(见图3)。HMGA2阴性组的SDC中位生存期高于与HMGA2阳性组(42.0个月vs33.0个月),但无统计学意义(P>0.05)。Dvl2阴性组SDC的中位生存期高于Dvl2阳性组(61.0个月vs31.0个月,P<0.05,见图4)。
2.5 影响SDC的预后因素分析
COX单因素回归分析显示,淋巴结转移、神经侵犯和Dvl2阳性与SDC患者的预后显著相关(见表4);多因素回归分析显示淋巴结转移和神经侵犯是SDC生存预后的独立预后因素(见表5)。
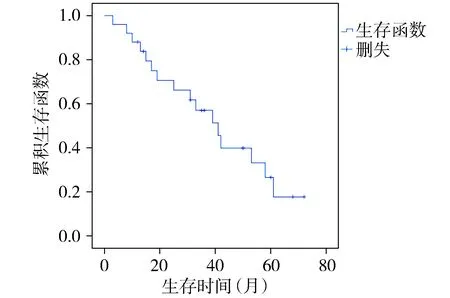
图3 SDC患者25例的生存曲线Figure 3 Total survival curve of 25 cases of SDC

图4 Dvl2阳性和Dvl2阴性组的生存期比较Figure 4 Comparison of survival curve between Dvl2 positive group and Dvl2 negative group
表4 SDC患者生存预后的Cox单因素回归分析
Table 4 Cox univariate regression analysis of survival prognosis in patients with SDC
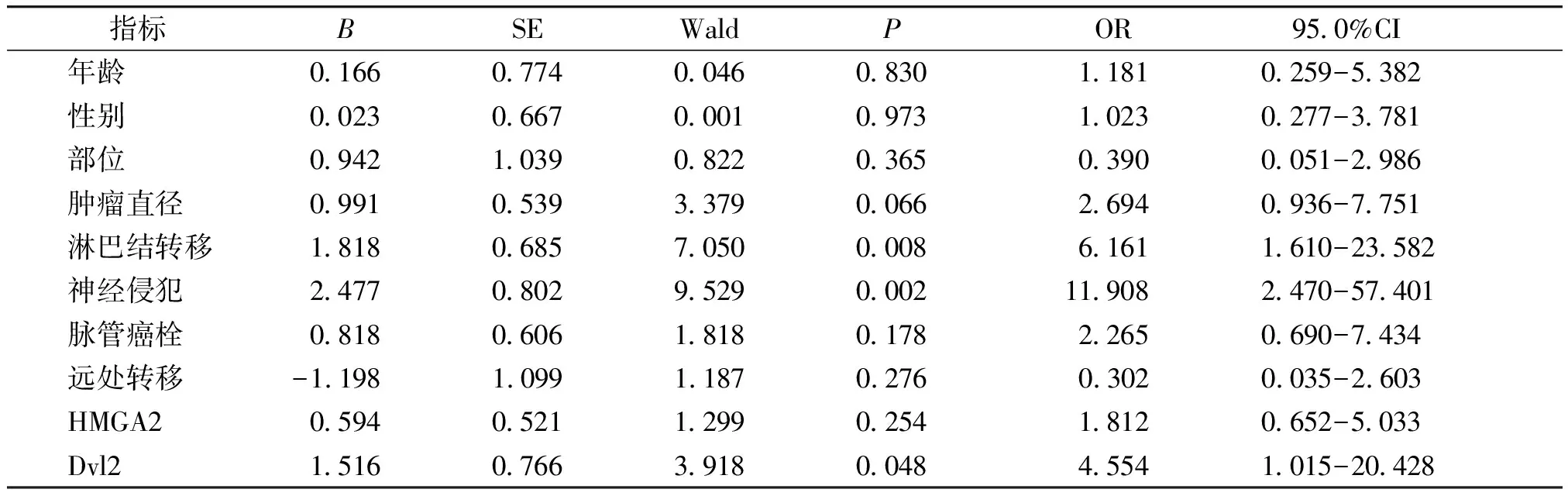
指标 BSEWaldP OR95.0%CI 年龄0.1660.7740.0460.830 1.181 0.259-5.382性别0.0230.6670.0010.9731.023 0.277-3.781部位0.9421.0390.8220.3650.390 0.051-2.986肿瘤直径0.9910.5393.3790.0662.694 0.936-7.751淋巴结转移1.8180.6857.0500.0086.161 1.610-23.582神经侵犯2.4770.8029.5290.00211.908 2.470-57.401脉管癌栓0.8180.6061.8180.1782.265 0.690-7.434远处转移-1.1981.0991.1870.2760.302 0.035-2.603HMGA20.5940.5211.2990.2541.812 0.652-5.033Dvl21.5160.7663.9180.0484.554 1.015-20.428
表5 SDC患者生存预后的Cox多因素回归分析
Table 5 Cox multivariate regression analysis of survival and prognosis in patients with SDC
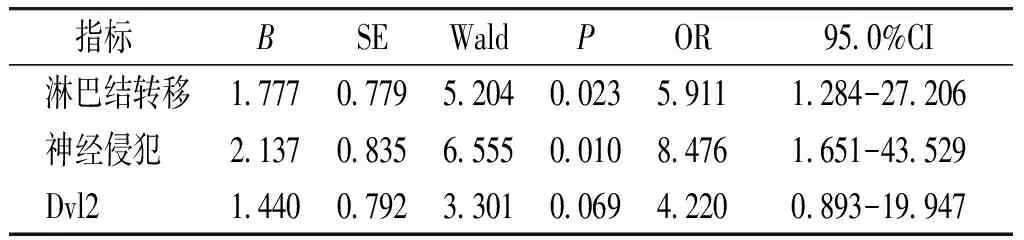
指标 BSEWaldPOR95.0%CI淋巴结转移1.7770.7795.2040.0235.9111.284-27.206神经侵犯2.1370.8356.5550.0108.4761.651-43.529Dvl21.4400.7923.3010.0694.2200.893-19.947
3 讨论
SDC是一种较罕见的涎腺恶性肿瘤,多发于老年男性,好发于腮腺,其次为颌下腺。目前治疗多为手术辅以放化疗。由于SDC恶性程度较高,易发生神经脉管侵犯和转移,探究其侵袭性的机制对于寻找改善其预后的治疗方案十分重要。
HMGA2属于非组蛋白染色体高迁移率组(high mobility group,HMG)家族,位于12q13-15,是一种能结合富含AT的DNA序列的结构转录调节因子,主要通过修饰、改变染色质结构,并与其他转录因子结合调控基因表达[8]。HMGA2通常在胚胎早期及不成熟组织中广泛表达,而在分化成熟的组织中几乎不表达[9];HMGA2在许多晚期肿瘤中的高表达已被证实,且多与预后不良有关[10-12];研究显示,HMGA2在SDC中的阳性率为28.5%-48%,与患者的总生存期无关[13,14]。本研究结果显示,在25例SDC中,有14例为HMGA2高表达(56.0%),略高于文献报道;并且HMGA2在SDC中的表达水平高于癌旁对照组,提示HMGA2蛋白参与了SDC的发生过程,这可能是由于HMGA2通过蛋白-蛋白或蛋白-DNA作用方式改变了染色体结构,使DNA发生剧烈变性,进而直接发挥抑制或促进下游基因表达;或通过结合于其他的转录因子而间接调节下游基因表达,促进SDC肿瘤细胞的分化、转化和增殖。本研究结果还显示,在13例有淋巴结转移的SDC中,有10例为HMGA2高表达(76.9%),高于无淋巴结转移组(4/12,33.3%);11例有神经侵犯的SDC中,有9例HMGA2高表达(81.8%),高于无神经侵犯组(5/14,35.7%),这提示HMGA2蛋白参与了SDC的迁徙与转移过程,可能是由于HMGA2一方面通过正性调节TWIST1的表达,使得E-Cadherin表达下调导致β-catenin与E-Cadherin在胞膜上形成的偶联复合物解体,促进β-catenin进入胞浆内;另一方面负性调控AXIN1的表达加速胞浆内β-catenin的堆积并进入胞核,引起肿瘤细胞的上皮间充质转换(EMT)的发生,促进肿瘤细胞的转移[10,15]。有研究表明,敲除HMGA2基因的表达能够抑制TGF-β1诱导的PI3K/AKT信号通路的激活,从而抑制肿瘤细胞的增殖和存活,降低肿瘤细胞的迁移、黏附能力,减少肿瘤的侵袭性[16-18]。所以,HMGA2是引起SDC侵袭性的重要因子,可作为SDC治疗的一个潜在靶点。
Dvl2是人类Dishevelled基因家族一员,定位于17p13.2,是一种胞质-胞核穿梭蛋白。Dvl家族最初由Klingensmith等[19]从果蝇体毛和翅毛中发现并报道,是Wnt/β-catenin信号通路胞内关键因子之一。已有研究报道Dvl2阳性与多种恶性肿瘤发展过程密切相关,且与肿瘤的侵袭性相关[20,21],但Dvl2与SDC的关系鲜有研究。本研究结果显示,25例SDC中Dvl2高表达的有18例(72.0%),远高于对照组(2/20,10%)。这表明Dvl2也是参与SDC发生发展的重要因素,可能是由于Dvl2为Wnt通路的重要环节基因,当有Wnt信号时,细胞跨膜受体(Frizzled)、LRP5/6与外界来源细胞分泌的Wnt蛋白结合,胞质内的转导通路信号被触发,Wnt通路开放,Dvl2被招募到细胞膜上与Frizzled结合,导致GSK3β和CK1磷酸化,无法形成降解β-catenin的复合物GSK3β-Axin-APC-CK1,使β-catenin在胞内积累并进入细胞核,与核内T细胞因子(TCF)/淋巴样增强子结合因子(LEF)结合,激活C-myc、CyclinD1、Survivin等靶基因,导致肿瘤的发生。另外,本研究还显示,在13例有淋巴结转移的SDC中,12例呈Dvl2高表达状态(92.3%),远高于无淋巴结转移组(6/12,50%),这说明Dvl2蛋白参与了SDC侵袭性的形成过程;本研究结果还显示,Dvl2阳性组的中位总生存期较Dvl2阴性组的短(31.0个月vs61.0个月),单因素回归分析显示Dvl2是SDC预后的影响因子,但不是独立预后指标。这表明Dvl2阳性的SDC具有更强的侵袭性,由于Dvl2是Wnt/β-catenin信号转导通路的中间因子,它可以通过结合P62激活该通路导致肿瘤细胞的侵袭与转移,因此,Dvl2也可能作为SDC预后判断的检测指标。
在本研究中,14例HMGA2高表达的SDC中有13例显示Dvl2高表达(92.9%),11例HMGA2高表达的SDC中仅有5例Dvl2呈高表达(45.5%);HMGA2和Dvl2高表达均与淋巴结转移相关,并且经相关性分析,二者的表达呈正相关。这提示HMGA2和Dvl2通过一些共同的途径促进肿瘤的发生和恶性转化,可能是由于HMGA2与TCFs家族中的TCF/LEF有一定的结构相似域,它能够增强β-catenin与TCF/LEF结合的转录活性,从而促进肿瘤的侵袭性;而Dvl2作为Wnt/β-catenin的关键介导因子,这表明HMGA2和Dvl2可能是通过同一通路,即Wnt信号通路来共同促进SDC的发生发展。Wnt信号通路是一条复杂、高度保守的信号途径,在调节细胞分化周期、增殖和凋亡的平衡、细胞黏附和运动、细胞定向迁移、侵袭,以及维持细胞微环境的稳态中起重要作用[22]。近年来有研究显示,Wnt/β-catenin通路直接受HMGA2调控,HMGA2基因的敲除会显著降低Wnt/β-catenin通路的转录活性[5,23-26];Xu X的体外试验结果显示,HMGA2通过结合Dvl2启动子区域-264/+217和-201/-185位点来,诱导Dvl2的转录,激活Wnt/β-catenin信号通路;Dvl2的干扰可以减弱由HMGA2过表达引起的Wnt通路下游基因如MMP7的升高[5]。这些研究结果均说明,Dvl2可能是HMGA2的潜在靶点之一,HMGA2和Dvl2通过共同的信号通路增加肿瘤组织的侵袭性,二者的共同过表达预示着SDC患者预后不良。因此,抑制HMGA2/Dv12在肿瘤治疗中可能具有重要意义,这为SDC的综合治疗提供一种新的可能性,但有待后期研究证实。
综上所述,HMGA2和Dvl2可能通过共同作用于Wnt/β-catenin信号通路,促进SDC的增殖和转移,二者共表达预示着SDC预后不良。所以在SDC中,联合检测HMGA2和Dvl2不仅可能预测SDC的侵袭性,而且可能是SDC综合治疗的潜在靶点,这为后期SDC的综合治疗提供了新思路。
