PHH3和TOPⅡα蛋白在子宫平滑肌肿瘤中的表达及其临床意义
2020-03-02张素瑛刘晓俊李素红梁建芳
张素瑛,刘晓俊,李素红,梁建芳*
(1山西医科大学基础医学院病理教研室,太原 030001;2山西省大同市第三人民医院妇产科;3山西医科大学第一医院病理科;4山西省儿童医院病理科;*通讯作者,E-mail:liangjianfang@126.com)
子宫平滑肌肿瘤是最常见的女性生殖道肿瘤,组织学分为平滑肌瘤(leiomyoma,LM)、核分裂像活跃的子宫平滑肌瘤(mitotically active leiomyoma,MAL)、富于细胞型平滑肌瘤(cellular leiomyoma,CLM)、恶性潜能未定的子宫平滑肌肿瘤(smooth muscle tumor of uncertain malignant potential,STUMP)和平滑肌肉瘤(leiomyosarcoma,LMS),LM的变异型(CLM、MAL)、STUMP与LM及LMS均存在一定的组织学重叠[1],核分裂像计数是衡量细胞增殖活性的重要指标[2],抗磷酸化组蛋白H3(phospho-histone H3,PHH3)特异性地标记细胞分裂期[3],提高核分裂像计数的准确性和可重复性,在多种肿瘤中计数核分裂像的意义有广泛研究。拓扑异构酶Ⅱα(topoisomeraseⅡα,TOPⅡα),即旋转酶,参与基因复制、转录、细胞增殖等[4],在多种肿瘤组织中高表达,且其表达越高,恶性程度风险越大[5,6],然而PHH3和TOPⅡα蛋白在子宫平滑肌肿瘤中的表达研究甚少。因此本研究旨在研究PHH3和TOPⅡα在LMS、STUMP、MAL、CLM和LM组织中的表达情况及作用机制。
1 资料与方法
1.1 一般资料
回顾性收集2005-01~2016-06在山西医科大学第一医院妇产科手术后存档且临床病理资料完整的石蜡包埋组织标本LMS 32例、STUMP 18例、MAL 14例、CLM 21例、LM 19例;由两位病理科医师采用双盲法复查切片。
1.2 方法
免疫组织化学EnVision法:将蜡块标本切成4 μm厚,经二甲苯脱蜡,梯度乙醇脱水,3%H2O2去除内源性过氧化物酶,抗原热修复,加一抗(PHH3和TOPⅡα兔抗人单克隆抗体,中杉金桥)4 ℃过夜,PBS冲洗后滴加二抗,室温条件下DAB显色,中性树胶封片,PBS液代替一抗做阴性对照。
1.3 结果判定标准
PHH3和TOPⅡα的阳性标志为细胞核内出现棕黄色颗粒。PHH3计数和HE切片的核分裂像计数,由2名病理医师双盲进行,取两者平均数。在核分裂最活跃的区域计数,每张切片连续计数10个高倍镜视野(×400)。TOPⅡα阳性细胞占细胞总数的百分比:≤5%为(-),6%-25%为(+),26%-50%为(++),≥51%为(+++)。
1.4 统计学方法
应用SPSS21.0统计软件进行数据分析。根据受试者工作特征曲线(ROC曲线)确定PHH3计数在LMS和LM中的诊断阈值(cut-off值),计算其敏感性、特异性。TOPⅡα在5组肿瘤中的表达及其与临床病理特征的关系采用χ2检验、生存分析采用Kaplan-Meier法、log-rank检验和多变量Cox回归分析等方法进行数据处理,PHH3计数与TOPⅡα蛋白表达的相关性采用Spearman相关性分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 PHH3在5组平滑肌肿瘤中的表达
2.1.1 PHH3在平滑肌肿瘤诊断中的cut-off值 通过ROC曲线分析,诊断LMS的PHH3计数的cut-off值为18(P<0.001),曲线下面积(AUC)为0.991(P<0.001),其灵敏性和特异性分别为96.9%和90.3%;诊断LM的PHH3计数的cut-off值为9(P<0.001),曲线下面积(AUC)为0.953(P<0.001),其灵敏性和特异性分别为94.0%和81.5%(见图1)。
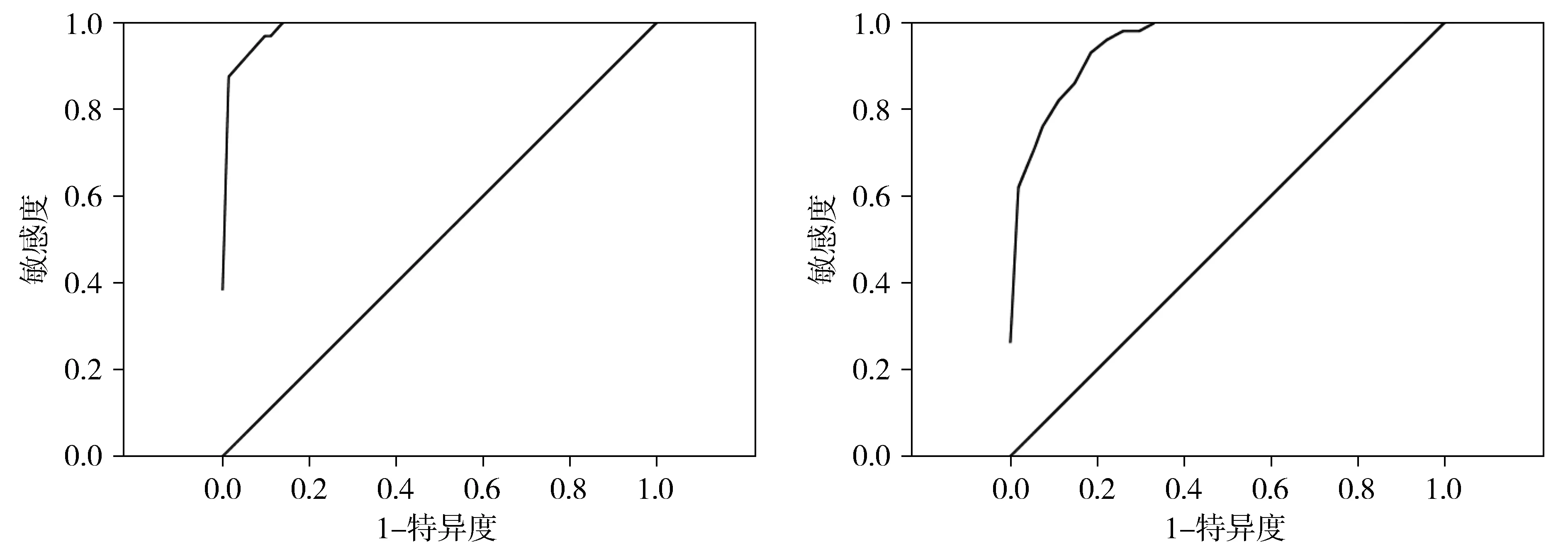
A.LMS患者 B.LM患者图1 PHH3计数诊断LMS和LM的ROC曲线Figure 1 ROC curve of PHH3 count in diagnoses of LMS and LM
2.1.2 PHH3在5组平滑肌肿瘤中计数的区间分析 PHH3在5组肿瘤中的表达见图2。PHH3计数>18/10HPFs的LMS占90.63%;PHH3计数在(9-18)/10HPFs之间的STUMP和MAL分别占77.78%和71.43%;PHH3计数<9/10HPFs占CLM、LM的95.24%和100%(见表1)。
2.2 TOPⅡα在5组平滑肌肿瘤中的表达
TOPⅡα蛋白在LMS中阳性率84.38%(27/32)显著高于STUMP[44.44%(8/18)]、MAL[21.43%(3/14)]、CLM[28.57%(6/21)]、LM[21.05%(4/19)]组织中的阳性率,且在MAL、CLM、LM中的表达均为低表达;虽然TOPⅡα蛋白在STUMP中的表达与MAL、CLM、LM无显著差异,但是在2例有复发的STUMP病例中TOPⅡα蛋白均呈高表达;其他各组两两之间比较,差异无统计学意义(P>0.05,见图2,表2)。
表1 PHH3不同计数在不同平滑肌肿瘤中不同的区间所占比例例(%)
Table 1 Proportion of patients with different PHH3 positive count in different regions of different smooth muscle tumorscases(%)
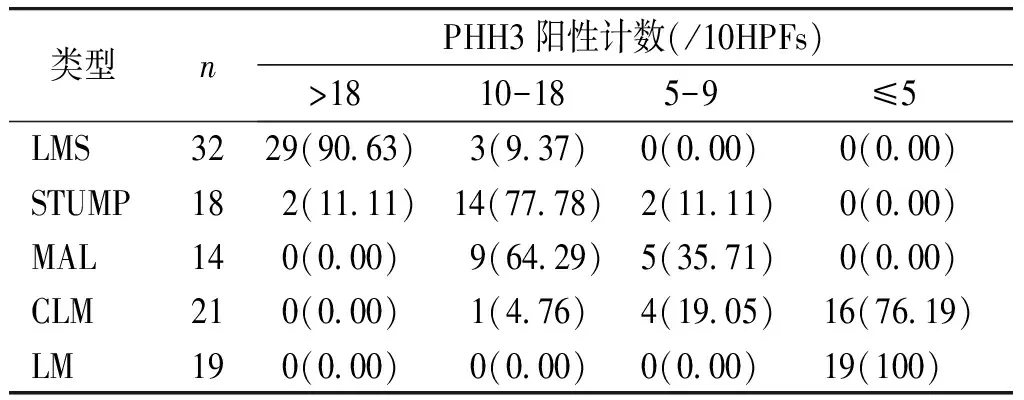
类型nPHH3阳性计数(/10HPFs)>18 10-18 5-9 ≤5 LMS3229(90.63) 3(9.37)0(0.00) 0(0.00)STUMP18 2(11.11)14(77.78)2(11.11) 0(0.00)MAL14 0(0.00) 9(64.29)5(35.71) 0(0.00)CLM21 0(0.00) 1(4.76)4(19.05)16(76.19)LM19 0(0.00) 0(0.00)0(0.00)19(100)

图2 PHH3和TOPⅡα在LMS、STUMP、MAL、CLM和LM中的表达Figure 2 Expression of PHH3 and TOPⅡα in LMS,STUMP,MAL,CLM and LM
表2 TOPⅡα在不同平滑肌肿瘤中的表达
Table 2 Expression of TOPⅡα in different smooth muscle tumors
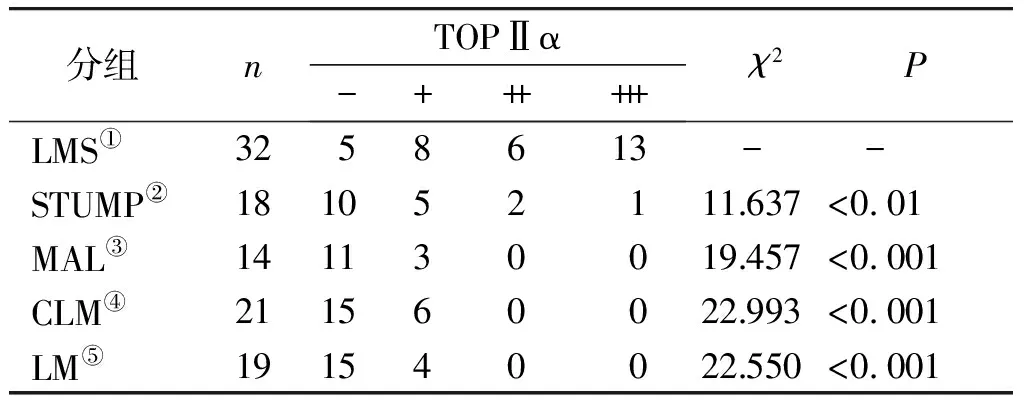
分组nTOPⅡα-++++++ χ2PLMS①3258613- -STUMP②181052111.637<0.01MAL③141130019.457<0.001CLM④211560022.993<0.001LM⑤191540022.550<0.001
χ2,P均为与LMS组比较结果;②③、②④、②⑤、③④、③⑤、④⑤两两相比,P>0.05
2.3 PHH3、TOPⅡα与LMS患者临床病理特征及预后的关系
对32例LMS患者随访4-60个月,在此期间有65.63%(21/32)患者死于LMS,8名患者失访,2名患者死于其他原因,仅有1名患者随访结束时仍无病生存,通过ROC曲线分析,预测LMS相关死亡的PHH3计数的cut-off值为28(P<0.001),曲线下面积(AUC)为0.983(P<0.001,见图3),其灵敏性和特异性分别为88.2%和96.6%。
2.3.1 PHH3、TOPⅡα与LMS患者临床病理特征的关系 在16例Ⅱ、Ⅲ、Ⅳ期的LMS患者中12例患者PHH3≥28/10 HPFs(75.00%),显著高于Ⅰ期患者37.50%(6/16)(P<0.05);TOPⅡα蛋白在Ⅱ、Ⅲ、Ⅳ期的LMS患者中的高表达率81.25%(13/16),显著高于Ⅰ期患者37.50%(6/16)(P<0.05);而PHH3计数及TOPⅡα蛋白表达与LMS患者的年龄及肿瘤最大径无明显相关性(P>0.05,见表3)。
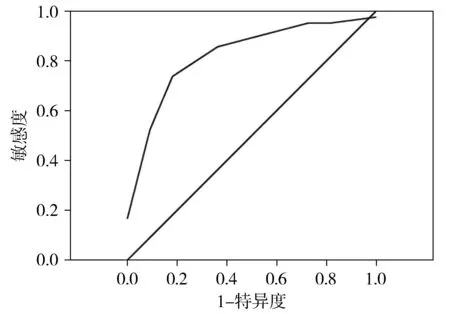
图3 PHH3计数预测LMS相关死亡的ROC曲线Figure 3 ROC curve of PHH3 count for predicting of LMS-related death
表3 PHH3和TOPⅡα的表达与LMS患者临床病理特征的关系
Table 3 Relationship between the expression of PHH3 and TOPⅡα and clinicopathological characteristics of LMS patients
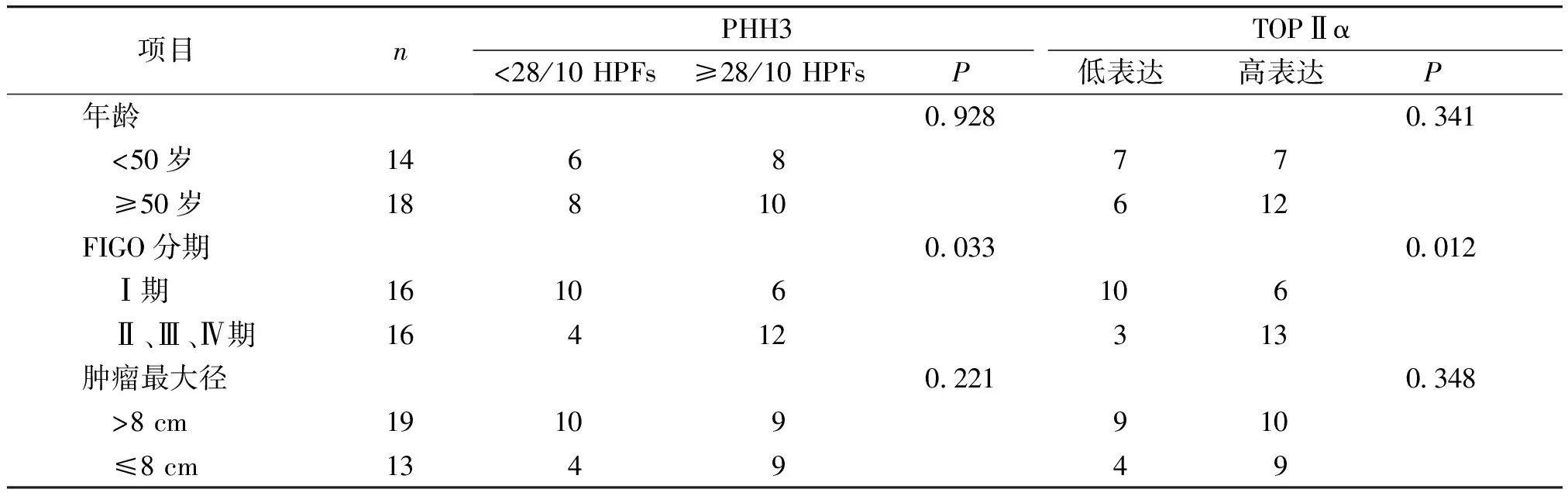
项目 nPHH3TOPⅡα<28/10 HPFs≥28/10 HPFsP低表达高表达P 年龄0.9280.341 <50岁146877 ≥50岁18810612FIGO分期0.0330.012 Ⅰ期16106106 Ⅱ、Ⅲ、Ⅳ期16412313肿瘤最大径0.2210.348 >8 cm19109910 ≤8 cm134949
2.3.2 PHH3计数与TOPⅡα蛋白表达的相关性 Spearman相关性分析显示,PHH3计数与TOPⅡα蛋白表达显著呈正相关(r=0.573,P<0.05,见表4)。
2.3.3 LMS患者的预后分析 采用Kaplan-Meier法和log-rank检验分析临床病理特征、PHH3计数及TOPⅡα蛋白表达与总生存期(OS)的相关性,结果提示PHH3计数及TOPⅡα蛋白表达OS显著相关(P<0.05),Ⅰ期患者的总生存期显著高于Ⅱ、Ⅲ、Ⅳ期患者(P<0.05),而Ⅱ、Ⅲ、Ⅳ期患者之间的OS无显著相关性,年龄(P=0.496)、肿瘤最大径(P=0.394)与OS无显著相关性(见图4)。
表4 在LMS中TOPⅡα蛋白表达与PHH3计数的相关性
Table 4 Correlation between TOPⅡα protein expression and PHH3 count in LMS
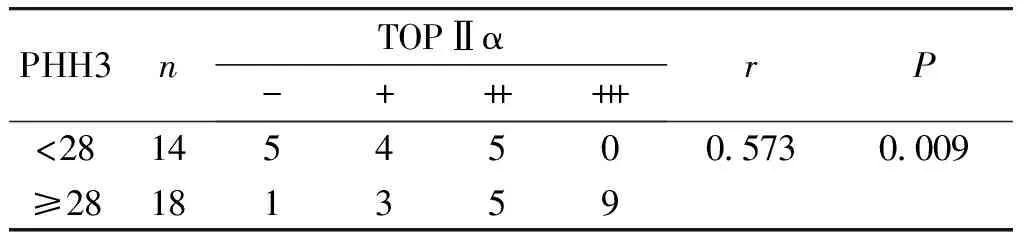
PHH3nTOPⅡα-++++++rP<281454500.5730.009≥28181359
采用多变量Cox回归分析,FIGOⅠ期的患者总生存期显著高于Ⅱ期患者(HR=0.02,95%CI 0.001-0.405,P=0.011),PHH3计数≥28/10 HPFs(HR=4.393,95%CI 1.030-17.083,P=0.033)是调整其他因素后多变量分析中预测LMS相关性死亡的独立预测因子(见表5)。
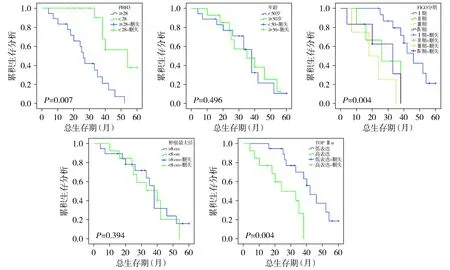
图4 LMS患者中不同PHH3计数、年龄、FIGO分期、肿瘤最大径、TOPⅡα表达的Kaplan-Meier生存曲线Figure 4 Kaplan-Meier survival curve of LMS patients with different PHH3 count, age, FIGO stage, tumor maximum diameter and expression of TOPⅡα
表5 LMS患者总生存期的多变量Cox回归分析
Table 5 Multivariate Cox regression analysis of total survival time of LMS patients

临床病理特征 多变量分析HRCIP年龄(<50岁vs ≥50岁)2.913 0.328-25.9140.338肿瘤最大径(≤8 cm vs>8 cm)0.254 0.080-0.8090.609FIFO分期 Ⅰ1(reference) Ⅱ0.02 0.001-0.4050.011 Ⅲ0.301 0.045-2.0030.214 Ⅳ0.473 0.062-3.6230.471PHH3(<28 vs≥28)4.393 1.030-17.0830.033TOPⅡα(低表达vs高表达)2.913 0.328-25.9140.338
2.3.4 STUMP患者的预后分析 由于STUMP患者数量较少,且随访6-146个月中仅有2例复发,未进行统计学分析,1例患者年龄48岁,肿瘤最大径6 cm,PHH3计数为18,细胞中等程度异型,未见肿瘤性坏死,于52个月时复发,复发后PHH3计数为14,细胞中等程度异型,未见肿瘤细胞性坏死,仍诊断为STUMP;另1例患者52岁,肿瘤最大径10 cm,PHH3计数12,细胞中等程度异型,可见肿瘤细胞性坏死,于106月复发并转移,于124月死于疾病,2例患者TOPⅡα均呈高表达,且在1例复发后病例中也呈高表达。
3 讨论
子宫平滑肌肿瘤是最常见的女性生殖道肿瘤,LM及一些平滑肌瘤的变异型(MAL、CLM等)均为良性,主要治疗方法为肿瘤切除,而LMS仅占子宫肿瘤的2.3%[7],其恶性程度高,局部转移/复发风险高,5年生存率12%-25%[8],主要治疗方法为全子宫切除。此外STUMP是一种中间型/交界型肿瘤,部分STUMP会复发,甚至多年后发展为LMS,目前STUMP复发及发展为LMS的风险仍不明确,因此识别出LMS及具有高风险性转化的STUMP患者,可能有助于决定治疗计划和/或手术治疗的范围[9,10]。
有研究指出PHH3可特异性地检测G2期和M期发生磷酸化的核心组蛋白H3。在哺乳动物体内H3上的Ser10能与细胞磷酸化酶上的相应活性位点在G2/M交界期结合发生磷酸化,促进染色体分离,使肿瘤细胞增殖活性增加[11,12],从而被PHH3识别,而且李程程等[13]的研究证实PHH3与Ki-67相比更能真实反映处于G2期和M期的细胞数目,从而反映肿瘤的增殖活性,可以以一定的比率(1.4-1.5)代替HE中的核分裂像计数。在此基础上,本研究进一步通过ROC曲线分析出诊断LMS及良性LM的PHH3计数的cut-off值分别为18和9,为子宫平滑肌肿瘤良恶性的鉴别提供了依据,临界值的界定也为临床诊断提供了理论基础,此外,我们还以9和18作为临界值统计了PHH3计数在平滑肌肿瘤中不同的区间分布,结果显示PHH3计数>18/10HPFs的LMS占90.63%,PHH3计数<9/10HPFs占CLM、LM的95.24%和100%,而PHH3计数在9-18/10HPFs之间的大部分为STUMP和MAL,分别占77.78%和71.43%,此组数据中PHH3>18/10HPFs仅见于LMS、STUMP及MAL,结合形态学MAL无细胞异型性容易鉴别,在本研究中PHH3>18/10HPFs的2例STUMP均无肿瘤细胞性坏死,而LMS中均存在肿瘤细胞性坏死,STUMP、MAL两者的PHH3阳性细胞计数均在9-18,但MAL无细胞异型性,形态学易于鉴别,无需免疫组化指标;1-9区间主要集中了ALM与LM组,两者均为良性,因此PHH3计数结合形态学及有无坏死有助于子宫平滑肌肿瘤良恶性及交界性的鉴别,但是由于我们的病例数较少,其诊断临界值的判定仍需大量的研究进一步明确。此外,本研究结果还显示TOPⅡα蛋白在LMS中阳性率显著高于STUMP、MAL、CLM、LM,且在MAL、CLM、LM中的表达均为低表达,这与Shan等[14]、Skubitz等[15]的研究结果一致,而TOPⅡα能够参与DNA的重组、复制、转录等过程[16],催化两个双螺旋DNA链的瞬时断裂和重接,从而改变DNA的拓扑结构,促进姐妹染色单体的分离,调控细胞周期进展[17],且受细胞周期调控,在G2/M期达到峰值,因此TOPⅡα蛋白上调存在于癌细胞分裂增殖期[18],提示TOPⅡα的高表达与肿瘤的增殖水平有关,而本研究结果显示在PHH3≥28/10HPFs的LMS患者中TOP2A蛋白的高表达率77.78%(14/18),显著高于PHH3<28/10HPFs的患者35.71%(5/14),提示两者的表达存在一定的相关性。
此外,也有研究证实PHH3计数可以作为子宫内膜样癌、卵巢癌的预后因子[19,20],是预测垂体腺瘤短期复发的一种有效指标[21],本研究发现Ⅱ、Ⅲ、Ⅳ期的LMS患者PHH3≥28/10HPFs的比例显著高于Ⅰ期患者,Ⅰ期患者总生存期显著高于Ⅱ、Ⅲ、Ⅳ期患者,PHH3计数≥28/10HPFs是调整其他因素后多变量分析中预测LMS相关性死亡的独立预测因子,而Abeler等[22]和D′Angelo等[23]的研究也提示FIGO分期、PHH3评分≥29/10HPFs是重要的预后指标。Cao等[24]研究证实TOPⅡα可作为非小细胞肺癌独立的预后因子,其阳性也是软组织肿瘤不良预后的独立预后因素[25],是可用于评估总体生存的预后指标,本研究结果显示TOPⅡα蛋白在Ⅱ、Ⅲ、Ⅳ期的LMS患者中的高表达率显著高于Ⅰ期患者,TOPⅡα蛋白表达与肿瘤相关性死亡显著相关。LMS的主要治疗方法为全子宫切除,辅助放化疗反应率仅约为30%;而蒽环类药物在TOPⅡα高表达的乳腺癌化疗反应率高[26],提示TOPⅡα是蒽环类药物的分子靶点,为LMS的治疗提供新的分子依据。
综上所述,PHH3和TOPⅡα均为细胞周期中的重要蛋白,能反应肿瘤细胞的增殖活性,结合两者的表达情况及形态学有助于子宫平滑肌肿瘤的良恶性及交界性判定,为预测患者的预后提供依据,但PHH3计数临界值的确定仍需大样本研究进一步明确。
