涎腺导管癌AR、HER-2和Ki-67蛋白的表达及分子分型
2020-03-02卫拴昱余飞燕
赵 芳,宋 琛,卫拴昱,余飞燕,肖 虹*
(1山西医科大学基础医学院病理教研室,太原 030001;2大同市第三人民医院风湿免疫科;3山西医科大学第一医院病理科;4山西医科大学口腔医院口内科;*通讯作者,E-mail:xiaohh9999@163.com)
涎腺导管癌(salivary duct carcinoma,SDC)来源于小叶间导管及排泄管细胞,是一种罕见的高度侵袭性肿瘤,占所有涎腺癌的10%[1]。目前对SDC的治疗方法包括手术切除和术后放化疗,但其5年的总生存率为12%-55%,预后较差[2]。雄激素受体(androgen receptor,AR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)、Ki-67在大多数SDC患者中高表达。目前,根据ER、PR、HER-2和Ki-67的表达情况将乳腺癌分为4种分子分型:包括Luminal A型、Luminal B型、HER-2型和三阴性乳腺癌,这种分类对预测其生物学行为、指导其内分泌治疗和抗HER-2靶向治疗具有重要意义[3]。然而在SDC中,ER和PR几乎不表达,AR通常高表达[4]。因此本研究拟参照乳腺癌分类方法,检测AR、HER-2和Ki-67的表达水平进行分子分型,探讨三者与SDC发生发展机制的关系,为SDC的靶向治疗及分子分型提供理论依据。
1 资料与方法
1.1 资料来源
选取山西医科大学第一医院病理科2009-01~2018-06期间手术切除或活检病理标本,诊断为SDC的病例29例。平均年龄51.9岁(33-83岁);男性21例,女性8例;肿瘤直径1.2-5.5 cm(平均3 cm),<3 cm者20例,≥3 cm者9例;发生于腮腺者19例,发生于颌下腺者7例,发生于其他部位者3例;按WHO第4版头颈部肿瘤分类标准[1]:低级别者16例,高级别者13例;术后复发9例,未复发20例;有淋巴结转移者17例,无淋巴结转移者12例。患者术前均未接受任何放化疗、内分泌治疗及靶向治疗,所有患者均签署知情同意书。
1.2 主要试剂
兔抗即用型AR单克隆抗体,购自北京中杉金桥生物技术有限公司;兔抗Her-2单克隆抗体、鼠抗Ki-67单克隆抗体,购自福州迈新生物开发有限公司;Her-2/CSPGLP17探针、DAPI复染剂,购自北京金菩嘉医疗科技有限公司。
1.3 免疫组化法检测AR、HER-2及Ki-67蛋白在SDC组织中的表达
经10%中性甲醛固定,常规石蜡包埋,4 μm连续切片,采用免疫组化Envison二步法,检测涎腺导管癌组织中AR、HER-2及Ki-67的表达水平,以涎腺多形性腺瘤作对照。
1.4 荧光原位杂交(FISH)检测HER-2在SDC组织中的表达
经10%中性甲醛液固定,石蜡包埋的组织切片4 μm,置于涂胶玻片上。于65 ℃烤片过夜,;常规脱蜡、脱水;将组织切片放入去离子水中90 ℃孵育30 min,处理完毕后将玻片置于37 ℃蛋白酶溶液中消化20 min,梯度乙醇脱水后,自然干燥。将探针工作液10 μl滴加于经上述处理的组织标本上,用橡皮胶封边。将玻片置于杂交仪中,84 ℃变性7 min,42 ℃杂交12-18 h。经杂交后洗涤、干燥,加入10 μl 4′,6-二脒基-2-苯基吲哚(DAPI),荧光显微镜下观察信号。具体实验操作按说明书进行。
1.5 结果判定
AR的阳性表达:定义为细胞核内出现棕黄色颗粒,≥1%的肿瘤细胞核染色为阳性。
HER-2的阳性:根据2019年ASCO/CAP指南[5]HER-2免疫组化评分标准判定。对HER-2行双探针FISH检测,阳性扩增判断标准同乳腺癌:HER-2为红色信号,第17号染色体着丝粒(CEP 17)为绿色信号。当HER-2/CEP17的比值≥2.0或HER-2平均拷贝数≥6.0,则为阳性扩增。
Ki-67的阳性表达:定位于细胞核,细胞核内出现棕黄色颗粒,通过计数至少1 000个肿瘤细胞,测定Ki-67阳性细胞的百分率,计算Ki-67的中位数作为临界值。
根据AR、HER-2和Ki-67的表达,将SDC分为4种主要亚型。A组:AR+/HER-2-/Ki-67低表达;B组:AR+/HER-2-/Ki-67高表达;C组:HER-2+(AR+/HER-2+或AR-/HER-2+);D组:AR-/HER-2-组。由2名资深病理科医师独立观察评估。
1.6 随访
定期随访每例患者的生存情况,随访方式为门诊复诊或电话随访。总生存时间(overall survival,OS)为手术日期到末次随访日期或死亡日期,按月计算,随访截止至2018年12月。
1.7 统计学分析
运用SPSS 21.0软件进行统计学分析。多组间率或构成比采用卡方检验或Fisher确切概率法。采用Kaplan-Meier法进行生存分析并行Log-Rank检验,Cox比例风险回归模型分析影响生存时间的因素(变量筛选采用Enter法)。以P<0.05为差异有统计学意义。
2 结果
2.1 AR和Ki-67在SDC组织中的表达水平
29例SDC组织中AR阳性率为82.76%(24/29);Ki-67增殖指数在SDC组织中为30.52%±5.41%,其中Ki-67低表达13例,Ki-67高表达16例(见图1)。
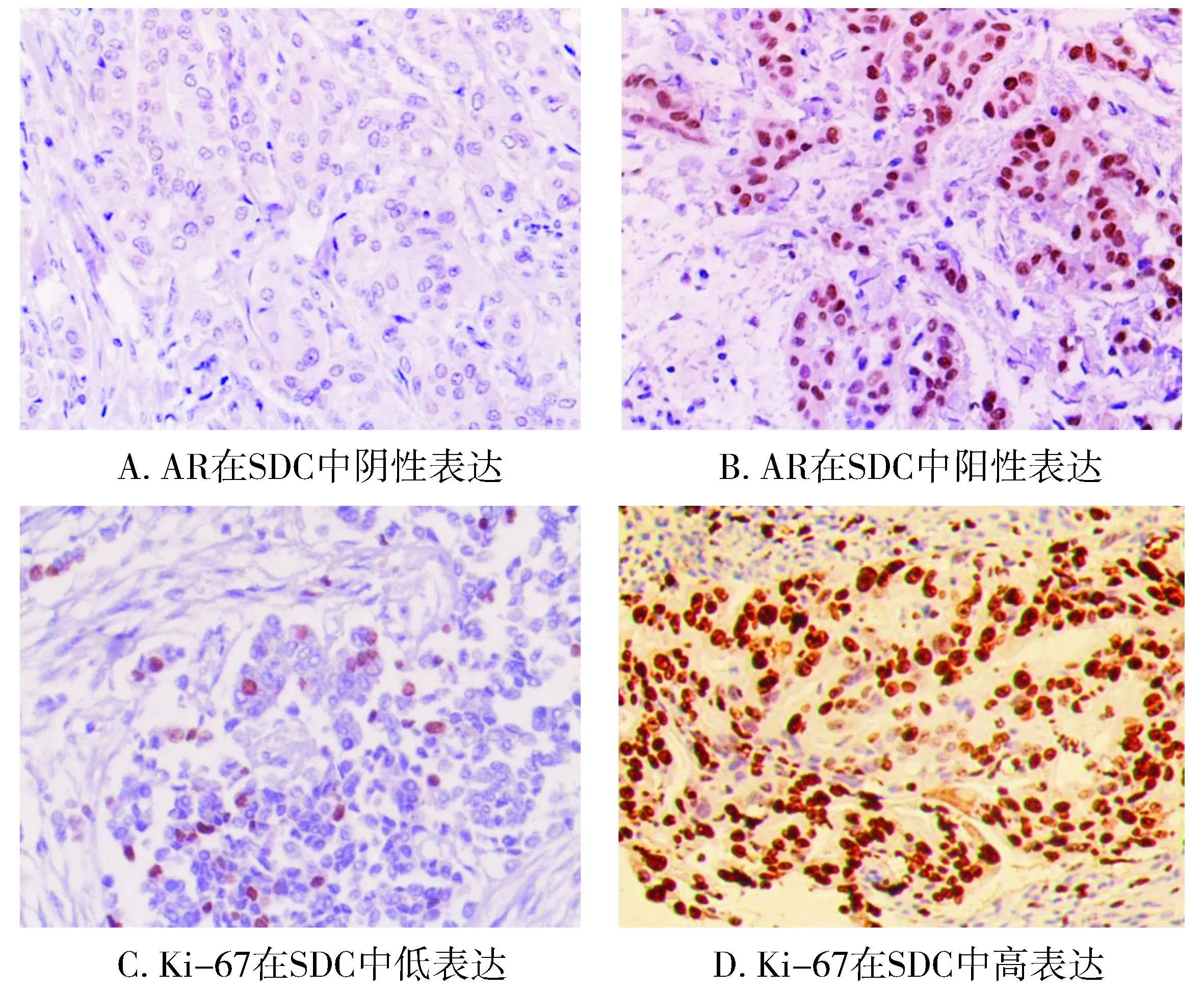
图1 AR和Ki-67在SDC中的表达 (Envision法×200)Figure 1 Expression of AR and Ki-67 in SDC (Envision,×200)
2.2 HER-2在SDC组织中的表达情况
29例SDC组织中HER-2免疫组化评分:1例0分,3例1+,14例2+,11例3+;其中HER-2的免疫组化评分0和1+的病例中,FISH阳性0例,阴性符合率100%:在免疫组化评分2+的病例中,FISH阳性6例,阳性符合率42.86%(6/14)在免疫组化评分3+的病例中,FISH阳性10例,阳性符合率90.91%(10/11)。HER-2的总阳性率为55.17%(16/29)(见图2,见表1)。
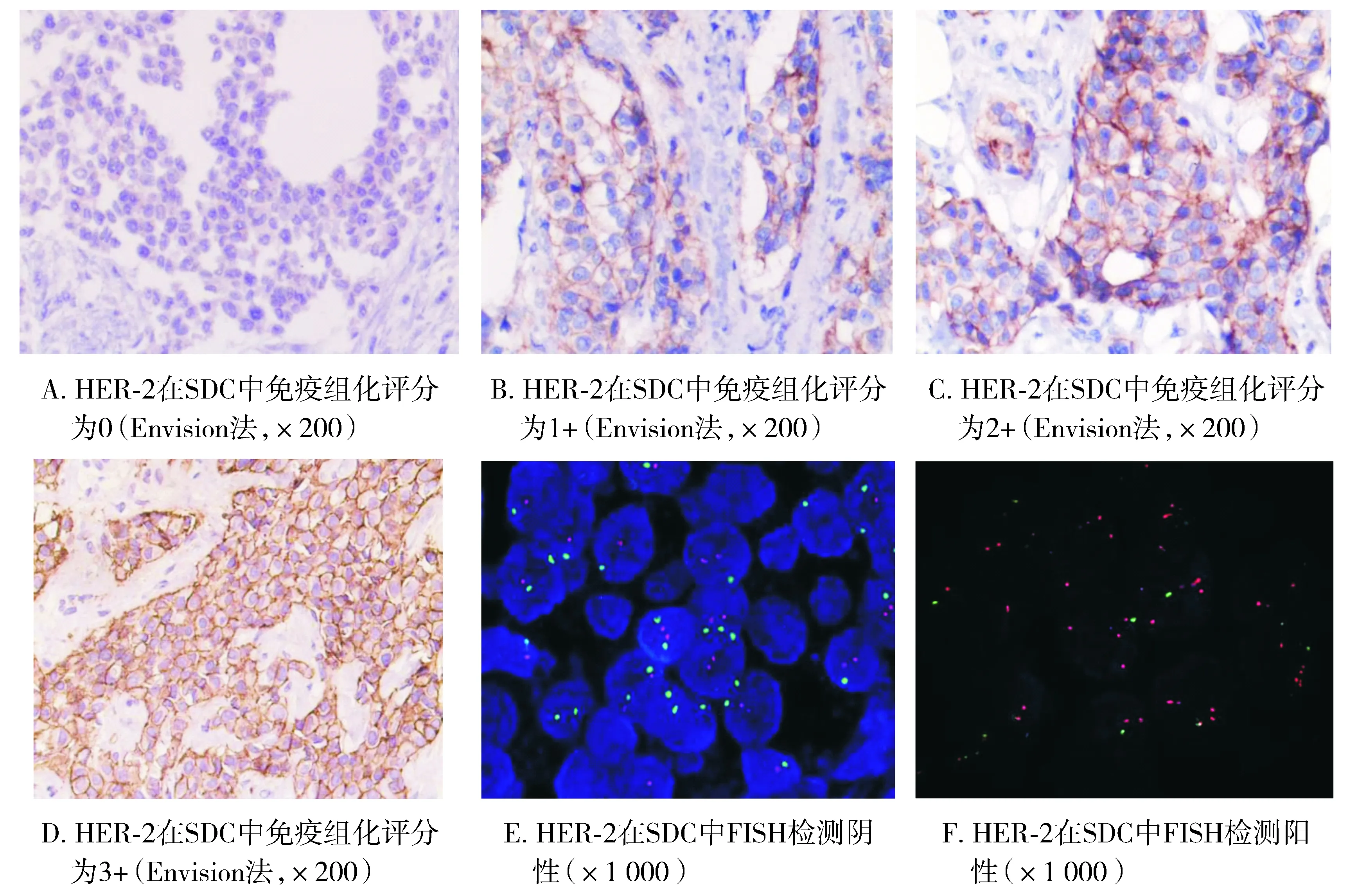
图2 免疫组化和FISH检测HER-2在SDC中的表达Figure 2 Immunohistochemistry and FISH detection of HER-2 expression in SDC
表1 免疫组化和FISH检测HER-2表达
Table 1 Immunohistochemistry and FISH detection of HER-2 expression
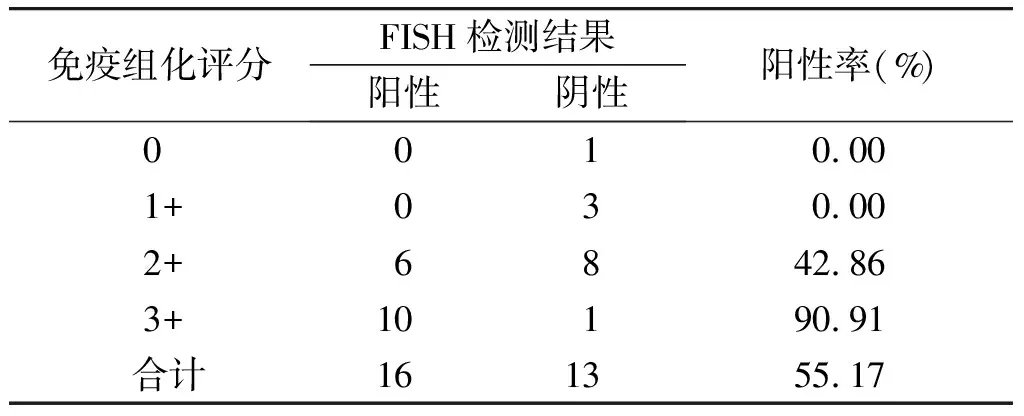
免疫组化评分FISH检测结果阳性阴性阳性率(%) 0010.00 1+030.00 2+6842.86 3+10190.91 合计161355.17
2.3 AR和HER-2表达的相关性分析
AR的表达与HER-2表达有相关性(P<0.05,见表2)。
2.4 不同分子分型与SDC各临床病理因素的关系
29例SDC组织中AR+/HER-2-/Ki-67低表达7例;AR+/HER-2-/Ki-67高表达11例;HER-2+(AR+/HER-2+或AR-/HER-2+)11例;AR-/HER-2-为0例。四组不同分子分型与年龄、性别、肿瘤直径、肿瘤发生部位、淋巴结受累、组织学分级均无相关性,差异无统计学意义(P>0.05,见表3)。
表2 AR和HER-2表达的相关性分析例(%)
Table 2 Correlation between AR and HER-2 expression in SDCcases(%)
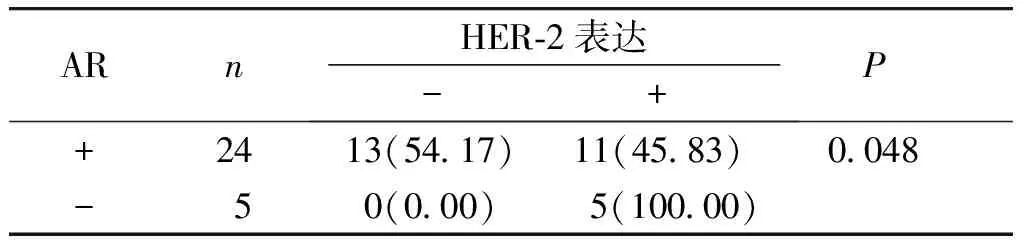
ARnHER-2表达-+ P+2413(54.17)11(45.83) 0.048-50(0.00)5(100.00)
表3 不同分子分型与SDC各临床病理因素的相关性分析例(%)
Table 3 Correlation between different molecular types and clinical pathological factors of SDCcases(%)
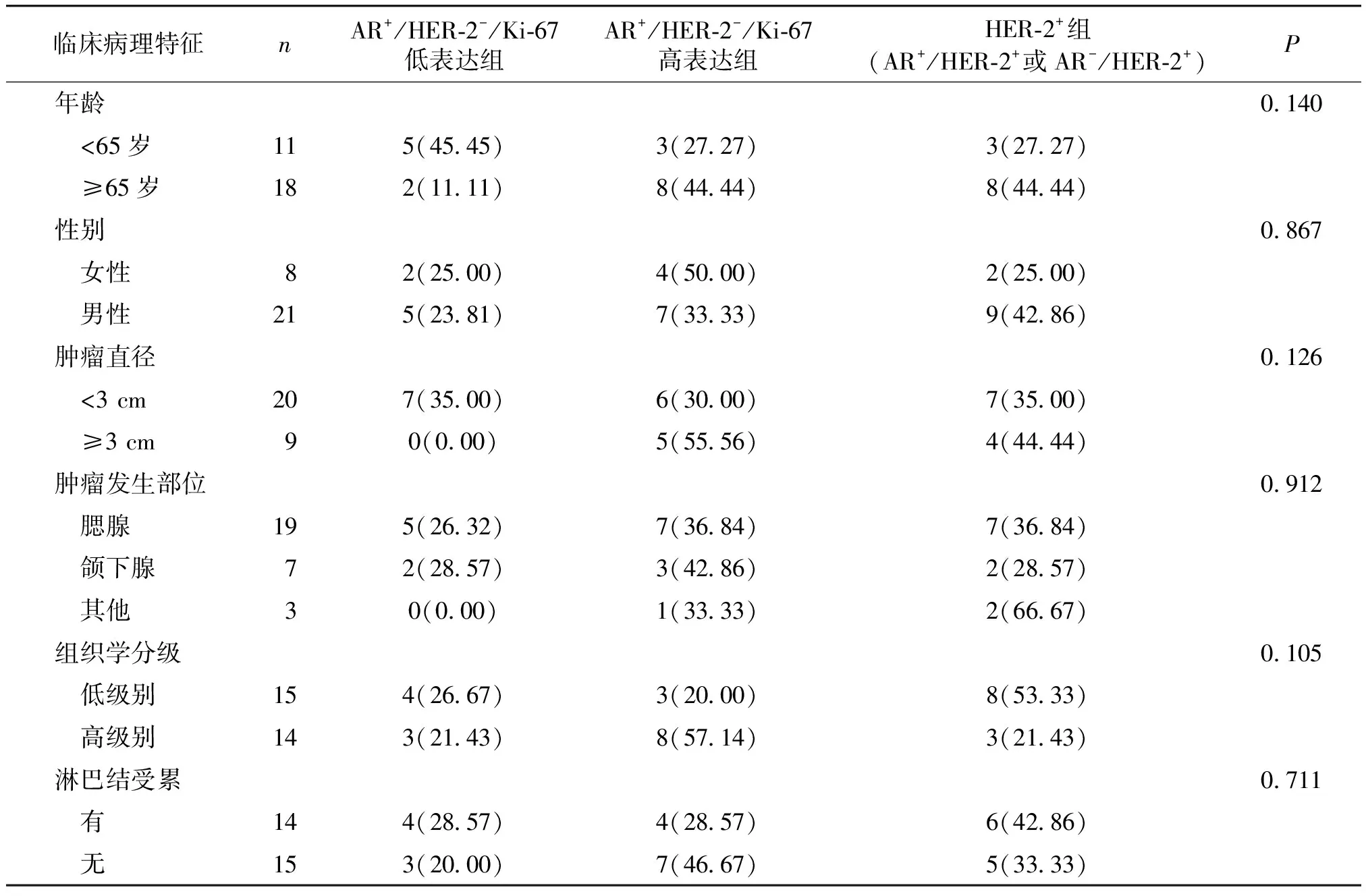
临床病理特征 nAR+/HER-2-/Ki-67低表达组AR+/HER-2-/Ki-67高表达组HER-2+组(AR+/HER-2+或AR-/HER-2+)P年龄0.140 <65岁115(45.45)3(27.27)3(27.27) ≥65岁182(11.11)8(44.44)8(44.44)性别0.867 女性82(25.00)4(50.00)2(25.00) 男性215(23.81)7(33.33)9(42.86)肿瘤直径0.126 <3 cm207(35.00)6(30.00)7(35.00) ≥3 cm90(0.00)5(55.56)4(44.44)肿瘤发生部位0.912 腮腺195(26.32)7(36.84)7(36.84) 颌下腺72(28.57)3(42.86)2(28.57) 其他30(0.00)1(33.33)2(66.67)组织学分级0.105 低级别154(26.67)3(20.00)8(53.33) 高级别143(21.43)8(57.14)3(21.43)淋巴结受累0.711 有144(28.57)4(28.57)6(42.86) 无153(20.00)7(46.67)5(33.33)
2.5 预后分析
本组29例SDC患者均接受随访,随访时间3-72个月,中位生存期为42个月。经Kaplan-Meier法结果显示:年龄<65岁的SDC患者预后优于年龄≥65岁的SDC患者(P<0.05);AR表达阳性的SDC患者比AR表达阴性的SDC患者预后好(P<0.05);HER-2阳性表达的SDC患者的预后低于HER-2阴性表达的SDC患者(P<0.05);AR+/HER-2-/Ki-67低表达的患者预后优于其他任何一种分型的患者。Cox比例多因素分析结果显示:AR的表达是影响SDC患者生存预后的独立因素(P<0.05,见图3,见表4)。
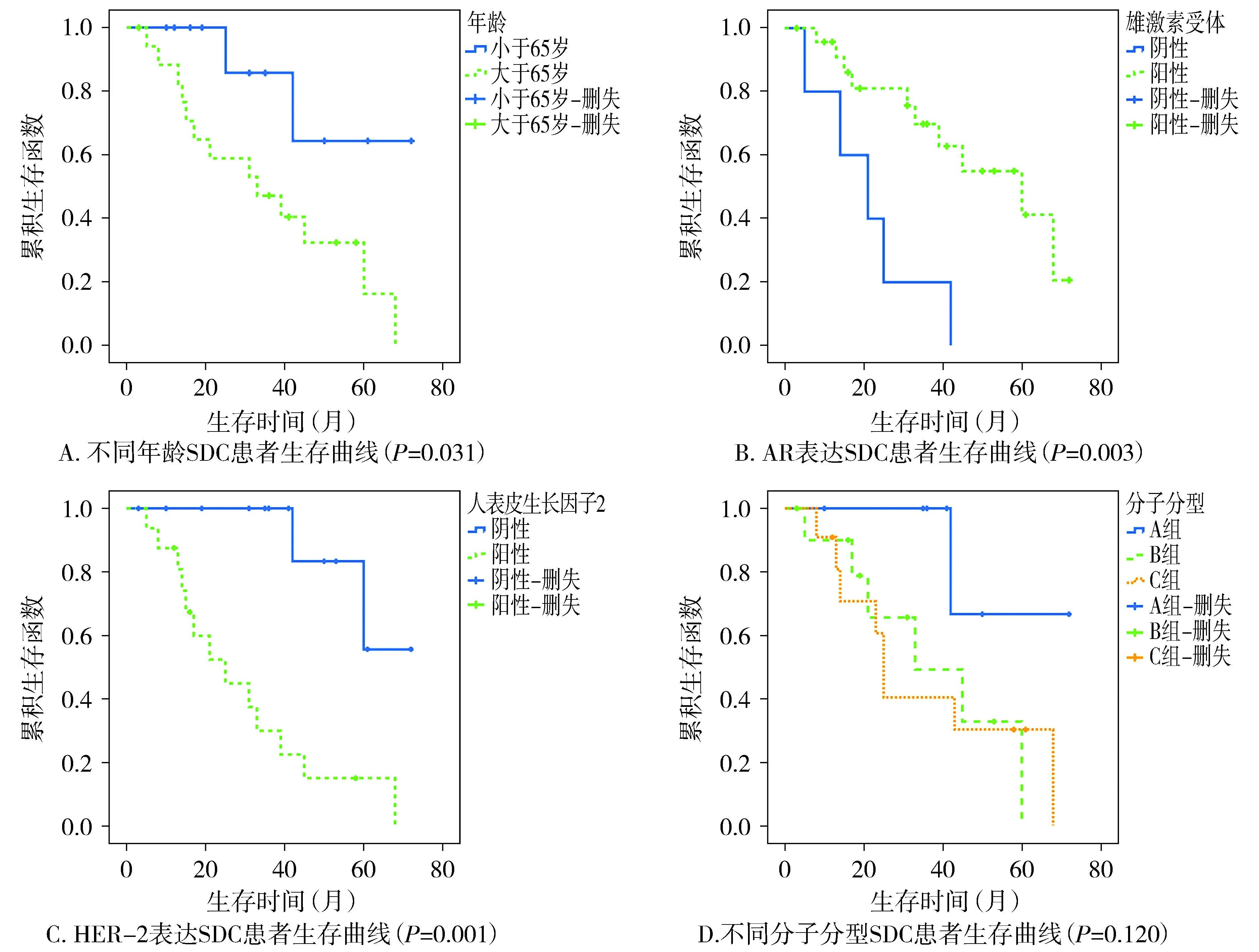
图3 涎腺导管癌患者的Kaplan-Meier生存曲线Figure 3 Kaplan-Meier survival curves of patients with salivary duct carcinoma
表4 影响SDC患者OS的Cox多因素分析
Table 4 Cox multivariate analysis of OS affecting SDC patients
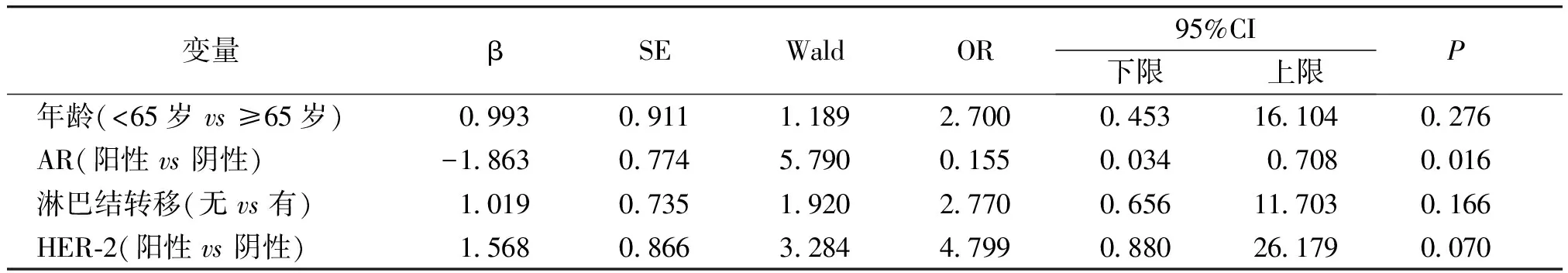
变量βSEWaldOR95%CI下限上限P 年龄(<65岁 vs ≥65岁)0.9930.9111.1892.7000.45316.1040.276 AR(阳性 vs 阴性)-1.8630.7745.7900.1550.0340.7080.016 淋巴结转移(无 vs 有)1.0190.7351.9202.7700.65611.7030.166 HER-2(阳性 vs 阴性)1.5680.8663.2844.7990.88026.1790.070
3 讨论
SDC是一种罕见的起源于涎腺导管上皮的恶性肿瘤,其恶性度高,易发生淋巴结转移及远处转移,疾病进展迅速,预后较差。因此了解SDC的分子发病机制,对于发现新的分子诊断标志物和最终制定新的个体化治疗策略具有重要意义。
HER-2是酪氨酸激酶C-erbB家族成员之一,位于17号染色体上,编码跨膜糖蛋白p185,属于表皮生长因子受体(epithelial growth factor receptor,EGFR)家族中的一员。EGFR家族由HER1、HER2、HER3和HER4组成[6]。免疫组化法(IHC)和荧光原位杂交法(FISH)是检测HER-2基因最常用的方法。虽然IHC操作简便、费用低廉,但是由于肿瘤的异质性、人为因素及实验条件等原因而出现假阳性和假阴性等问题。相比而言,FISH技术具有敏感性高、稳定性和重复性好,是美国食品药品监督管理局批准的检测HER-2基因扩增的金标准。本实验采用IHC和FISH技术对29例SDC患者进行HER-2状态检测,其中HER-2的免疫组化评分0分、1+、2+、3+与FISH检测阳性符合率分别0%,0%,42.86%(6/14)和90.91%(10/11)。HER-2在SDC组织中的阳性表达率为55.17%(16/29)比van Boxtel等[7]的报道略高(21%-44%)。同样最近的一项研究报告,HER-2的过度表达与基因扩增之间存在高度的一致性[8]。同时有研究者尝试使用曲妥珠单抗治疗HER-2表达阳性的SDC患者,结果表明:经过曲妥珠单抗治疗的患者生存率有所提高[9]。因此,与高级别乳腺导管癌形态类似的SDC患者,若HER-2阳性(3+及部分2+),是否也可用赫赛汀治疗以改善患者的预后有待进一步分析。此外,SDC患者中男性明显多于女性,免疫组化显示AR阳性率较高(82.76%),雄激素是否亦在SDC的发病中有一定的作用,男性患者的发病是否与前列腺癌有部分类似的发病机制值得进一步研究。
SDC起源于唾液腺的主导管和小叶间导管,大多数SDC为原发,部分SDC也可以从多形性腺瘤恶性转化而来[10,11]。Chiosea等[12]报道,当SDC在多形性腺瘤中发生时,往往有TP53突变或ERBB 2拷贝数增加,而原发的SDC患者常携带HRAS/PIK3CA联合突变,但没有ERBB 2扩增。同时,Shimura等[13]研究表明:PIK3CA/H-RAS/BRAF突变只发生在原发的SDC中,在继发于多形性腺瘤的SDC中没有检测到突变,而这些突变和HER-2过表达/扩增相互排斥。这些研究可能提示二者在发生学上存在不同的基因组改变。
鉴于SDC形态学上与高级别乳腺导管癌相似,本研究拟参照乳腺癌分类方法,将所有SDC分为四种主要亚型:AR+/HER-2-/Ki-67低表达、AR+/HER-2-/Ki-67高表达、HER-2+(AR+/HER-2+或AR-/HER-2+)、AR-/HER-2-,分别分析4种分子亚型对SDC的临床预后的关系。经生存分析结果显示:①AR+/HER-2-/Ki-67低表达的患者预后最好,同时AR在SDC患者中的表达是影响其生存预后的独立因素(P<0.05)。这可能是由于HER-2的下游基因PI3K被激活,促进了PI3K/MAPK通路下游的AR与雄激素的结合,形成AR同源二聚体转移至细胞核,与启动子上游DNA的顺式作用元件结合,并与其他几种共激活因子相互作用而调节基因的转录功能,从而抑制SDC肿瘤细胞的增殖能力[14,15]。有研究报道,20%的SDC患者异常表达PI3K/Akt信号通路蛋白,并且p-Akt阳性提示较好的预后,PI3K阴性和PTEN缺失与低AR表达相关[16]。②HER-2高表达(AR+/HER-2+或AR-/HER-2+)的患者预后较差,此外本研究结果显示HER-2单独高表达的患者较HER-2低表达的患者预后较差。研究报道,HER-2可通过PI3K/AKT/MTOR信号通路激活AR,激活的AR可与FOXA1及β-catenin结合或者通过WNT7B通路活化下游的β-catenin,从而激活HER-2信号通路,由此形成一个正向激活的环状通路,促进肿瘤细胞的异常增殖[17]。HER-2通过异源二聚体和酪氨酸激酶的自磷酸化介导信号转导,导致PI3K/AKT/MTOR信号通路、MAPK途径的激活,促进细胞增殖、分化和肿瘤发生[18]。因此,对于AR表达阳性的HER-2过表达型SDC患者,在使用靶向药物治疗的同时可加用AR拮抗剂,很可能极大地削减AR信号通路和HER-2信号通路协同作用的效应,从而改善其预后。③AR+/HER-2-/Ki-67高表达的SDC患者预后相对较差。Ki-67是与细胞增殖相关的核抗原,位于细胞核内,在有丝分裂中起到维持DNA结构的功能,其表达随细胞周期的变化而变化,可用于判断细胞的增殖活性。据有关报道,Ki-67表达与多种恶性肿瘤的发生发展和预后密切相关,其在乳腺癌的诊治与预后判断等方面具有重要的临床参考价值[19]。目前,Ki-67在SDC中还没有统一的判定标准,本次研究以Ki-67增殖指数30%作为临界点,而Takase等[8]以Ki-67增殖指数40%为判断SDC预后相关性临界点。同时Di Palma等[20]根据AR、HER-2、EGFR和CK5/6的表达,将SDC分为4种亚型:“AR阳性型”“HER-2阳性型”“基底乳腺癌层样型”以及“中间型”,但他们没有考虑到Ki-67的增殖指数。因此,对于SDC的免疫组化分子分型还有待评估,以确定其是否有用,为临床制定合适的治疗策略提供指导。
综上所述,AR和HER-2可能为SDC的潜在生物标志物,为SDC的个体化分层提供分子基础,为SDC的新的靶向多药化疗研究提供分子基础。同时,在乳腺癌研究的启发下,基于免疫组化标记物的形态和表达,我们进行了分子分型以建立最佳治疗参考SDC的生物标志物表达谱,为临床选择合适的治疗方法提供依据。
