萝卜硫素调控自噬相关蛋白抑制非小细胞肺癌线粒体自噬
2020-03-02闫雨廷
闫雨廷,周 妍,吴 巍
(首都医科大学基础医学院生物化学与分子生物学系,北京 100069;*通讯作者,E-mail:weiwu207@ccmu.edu.cn)
萝卜硫素(sulforaphane,SFN)是一种从十字花科植物中提取的植物活性物质,近年来许多研究表明,SFN对非小细胞肺癌、前列腺癌、肝癌等多种肿瘤具有良好的抗癌效果,但其具体的抗癌机制尚未阐明[1-3]。最新研究表明,SFN代谢物和紫杉醇联合用药产生协同抗癌作用,降低紫杉醇的耐药性和双方给药剂量[4]。
本课题组先前研究显示,SFN代谢产物可破坏微管,抑制自噬体与溶酶体的融合,导致自噬标志蛋白(microtubule associated protein 1 light chain 3 Ⅱ,LC3Ⅱ)堆积和非小细胞肺癌细胞凋亡[5]。研究证明,在非小细胞肺癌(non-small cell lung cancer,NSCLC)中,萝卜硫素抑制自噬导致细胞凋亡[5]。自噬分为巨自噬和线粒体自噬,SFN是否调节线粒体自噬尚不明确。我们曾经发现,SFN能诱导人NSCLC细胞出现线粒体损伤[6]。线粒体是为细胞活动提供能量的细胞器,当线粒体受损时,细胞将发生线粒体自噬以清除受损的线粒体并维持细胞蛋白稳态[7]。因此,研究SFN对线粒体自噬相关蛋白的调节可在亚细胞水平为弄清SFN诱导凋亡的机制提供必要支持。
1 材料与方法
1.1 细胞株与试剂
人非小细胞肺癌细胞株A549及SK-1购自中国医学科学院基础医学研究所基础医学细胞中心;SFN购自美国Santa Cruz公司,VDAC1、β-actin和LC3抗体购自美国Cell Signaling Technology公司;线粒体分离试剂盒购自中国碧云天公司。
1.2 高效液相色谱与质谱联用分析
用高效液相色谱与质谱联用分析SFN处理后肺鳞癌细胞SK-1细胞中蛋白差异表达。将肺鳞癌SK1细胞分为SFN处理组与未处理组(对照组)。使用20 μmol/L SFN处理肺鳞癌细胞SK1 24 h,收集细胞裂解液并定量。对照组与SFN处理组使用等量的蛋白上样,每组样品有3个重复样本。通过Orbitrap Fusion Lumos质谱仪和EASY-nLC 1000液相色谱系统进行色谱分离和分析,该系统配备了电喷雾电离源。使用C18(1.9 μm,100 Å)毛细管柱,流动相为0.1%FA/H2O和0.1%FA/ACN进行分离,并以正电离模式进行检测。收集数据后,通过Uniprot网站分析蛋白质的细胞定位和功能。
1.3 透射电镜观察细胞自噬体
使用20 μmol/L SFN处理肺腺癌细胞A549及肺鳞癌SK1细胞24 h,收集细胞并用PBS洗涤两次后,将样品用3%戊二醛于4 ℃冰箱中固定2 h。用PBS洗涤3次后,将样品在1%四氧化锇中固定1 h。样品通过梯度乙醇脱水,渗透并包埋在1 ∶1混合的丙酮和EPON-812树脂的混合物中放置30 min后,在EPON-812树脂中渗透2 h,用钻石刀切成超薄切片并且定位在200目铜网上。将切片用乙酸铀染色30 min后,再用硝酸铅染色20 min。使用透射型电子显微镜观察切片并拍照。
1.4 线粒体分离与提取
使用20 μmol/L SFN处理A549和SK-1细胞24 h后,收集处理2×107个细胞,并使用预冷的PBS缓冲液中洗涤一次。通过细胞线粒体分离试剂盒分离线粒体。线粒体蛋白浓度通过BCA蛋白分析试剂盒进行测定,细胞质蛋白浓度通过Bradford分析法进行测定。
1.5 Western blot检测LC3、VDAC1蛋白的表达
用含有蛋白酶抑制剂RIPA缓冲液(Thermo Fisher Scientific,美国)裂解分离出的线粒体,使用12% SDS-PAGE电泳分离每个样品中等量的蛋白质分子(30 μg)。该过程根据先前的实验方法[8]进行,检测SFN处理前后LC3(1 ∶1 000),VDAC1(1 ∶1 000),β-actin(1 ∶5 000)蛋白的表达。
1.6 生物信息学分析
使用UNLCAN数据库分析肺癌与癌旁蛋白差异表达;用Kaplan-Meier Plotterat数据库分析肺癌中PHB2蛋白生存曲线;用STRING数据库(10.5版)来分析PHB2、PHB、LC3蛋白之间的相互作用;用Linked Omics数据库分析PHB2、PHB、α-tubulin蛋白间的相关性;用Gene MANIA数据库进行PPI网络分析。
2 结果
2.1 SFN对自噬、微管和凋亡相关蛋白的影响
液相色谱与质谱联用分析显示SFN处理组上调了2 091个基因,下调了1 032个基因,差异有统计学意义(P<0.05)。使用uniprot网站分析这些差异基因的功能与定位,并从中选取与线粒体自噬、微管以及凋亡相关的基因进行自噬相关研究。本实验表明SFN能抑制线粒体自噬相关蛋白PHB以及微管蛋白的表达,并影响了凋亡相关蛋白,促进细胞凋亡(见图1)。
2.2 SFN抑制线粒体自噬
SFN处理细胞后,电镜结果显示自噬体堆积(见图2A)。为验证SFN抑制线粒体自噬,我们分别提取线粒体与细胞质蛋白质进行检测。Western blot结果显示,SFN导致的自噬标志蛋白LC3Ⅱ的堆积主要集中在线粒体,细胞质中的LC3Ⅱ未见显著变化(见图2B)。
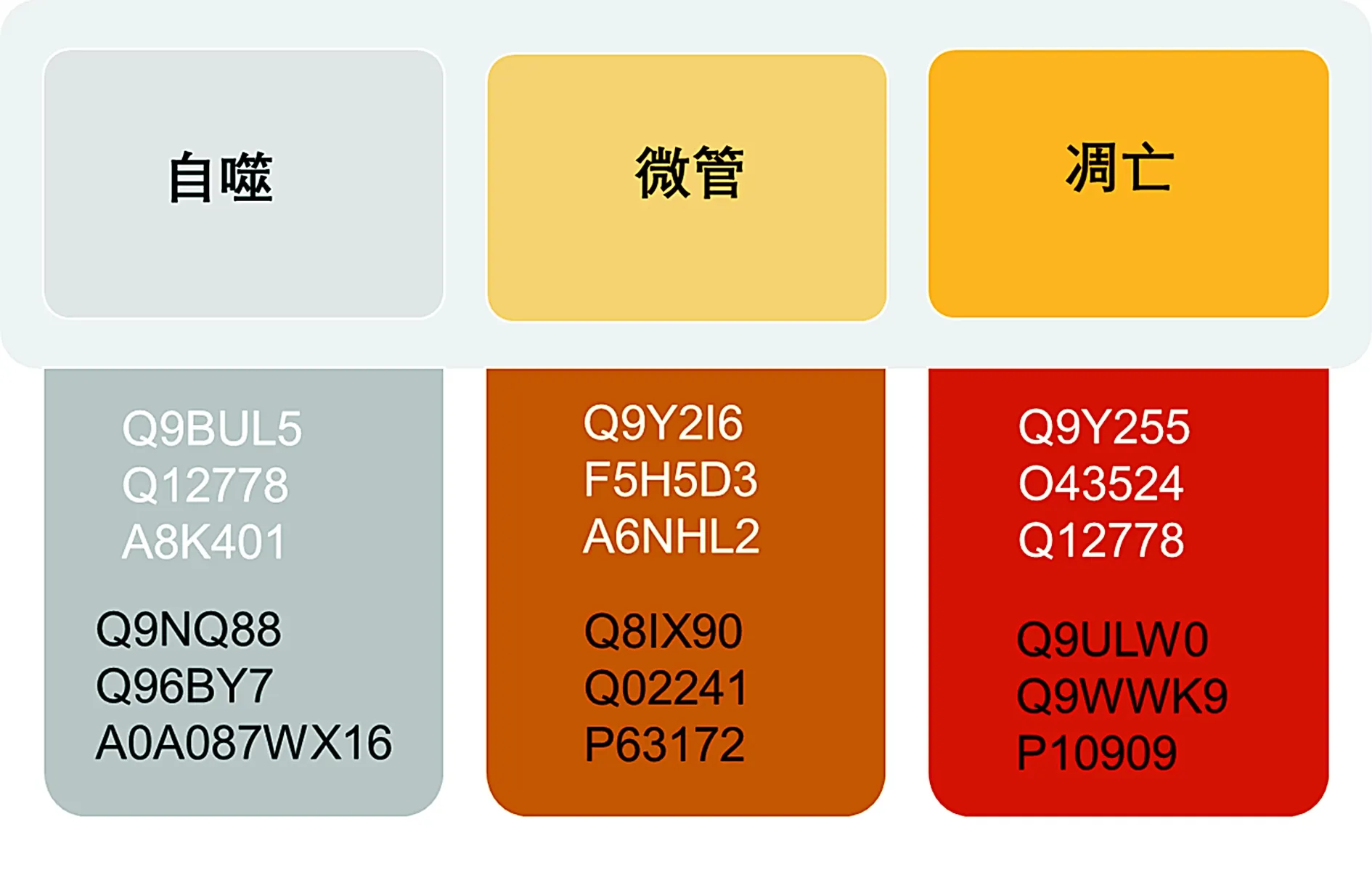
白色字体为下调基因,黑色字体为上调基因(使用Uniprot ID表示基因名)图1 蛋白质组学分析SFN处理后蛋白表达差异Figure 1 HPLC-MS-MS analysis of protein expression after SFN treatment

红色箭头代表线粒体自噬体,黑色箭头代表自噬体;mito代表线粒体蛋白,cyto代表细胞质蛋白图2 SFN处理后自噬体堆积和LC3Ⅱ的积累Figure 2 Accumulation of autophagosome and LC3Ⅱ after SFN treatment
2.3 靶向PHB/PHB2有治疗非小细胞肺癌的潜力
TCGA数据分析显示PHB、PHB2在肺鳞癌及肺腺癌中表达均比正常组织显著升高(见图3),且肺癌芯片分析显示PHB2表达高的患者生存率显著降低(见图3)。
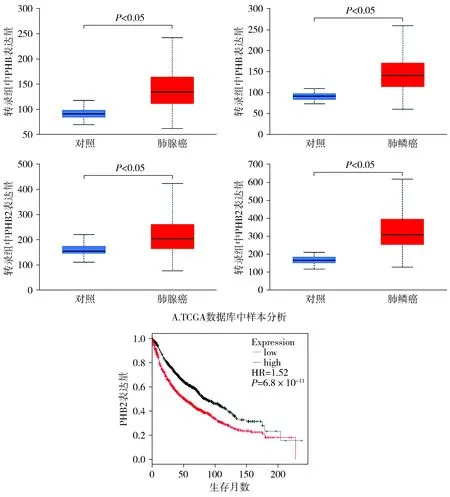
B.生存曲线图(数据来源于肺癌与癌旁组织芯片分析)图3 PHB、PHB2蛋白在肺癌中的表达及PHB2蛋白高表达患者生存曲线Figure 3 Expression of PHB and PHB2 proteins in lung cancer and survival curve of patients with high PHB2 protein expression
2.4 PHB/PHB2受微管调控
PPI网络分析显示,PHB及PHB2与微管相关蛋白存在相关性(见图4A)。使用Linked Omics数据库进一步分析显示在肺鳞癌与肺腺癌中,PHB与α-tubulin均呈正相关(见图4B)。
2.5 PHB/PHB2为线粒体自噬靶点
String数据库显示PHB2与LC3有相互作用,且与多种线粒体自噬蛋白有相互作用(见图5)。PHB/PHB2存在于线粒体膜上,由此推测PHB/PHB2为线粒体自噬靶点。
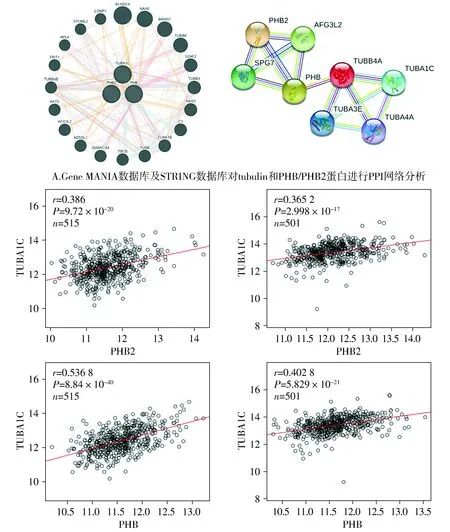
B.PHB/PHB2与tubulin在肺腺癌与肺鳞癌中的相关性分析(数据来源于TCGA数据库,由Linked Omics网站制作)图4 PHB/PHB2蛋白与α-tubulin蛋白的表达呈正相关Figure 4 PHB and PHB2 levels are positively correlated with α-tubulin expression

MAP1LC3B为LC3Ⅱ蛋白的基因名图5 使用STRING网站分析PHB2蛋白与LC3Ⅱ蛋白表达关联Figure 5 Correlation between PHB2 and LC3Ⅱ expression by STRING analysis
3 讨论
SFN作为一种有潜力的抗癌活性物质,能够诱导多种肿瘤细胞凋亡[9]。蛋白质组学分析显示SFN在NSCLC上有多个靶蛋白,其中几个关键蛋白调节线粒体自噬。作为细胞保护机制,自噬在细胞受到损伤时,可以维持细胞稳态[10]。同时,作为细胞内能量代谢的细胞器,线粒体对于细胞的增殖是极其重要的,线粒体的损伤会导致细胞无法正常生成ATP,从而导致无法支持肿瘤细胞迅速增殖。线粒体是动态细胞器,可不断调整其形态,功能和数量以适应细胞的代谢需求。在无药物干预时,线粒体能够自动“纠错”,通过线粒体自噬来降解受损的线粒体,以维持细胞正常生命活动[7]。据报道,线粒体可能通过PINK/Parkin,BNIP3/NIX和FOUNDC1途径有效清除受损的线粒体[11]。而线粒体功能障碍与许多人类疾病(包括癌症)有关[12]。LC3是一种微管相关蛋白,主要存在于自噬体膜上,在线粒体自噬过程中起关键作用,当线粒体自噬发生时,LC3Ⅰ将转化为LC3Ⅱ,被线粒体上的自噬受体招募[10]。本实验使用线粒体分离试剂盒将细胞线粒体与细胞质分离。Western blot结果显示,与对照组相比,SFN处理组中自噬标志蛋白LC3Ⅱ仅在线粒体内上升,细胞质中的LC3Ⅱ并未升高。这意味着SFN调节的自噬主要为线粒体自噬,在本实验中,VDAC1是线粒体外膜的主要成分,将其作为线粒体内参蛋白,β-actin是细胞骨架,将其作为细胞质内参蛋白。SFN抑制线粒体自噬导致受损的线粒体无法通过线粒体自噬降解,细胞内稳态被破坏,从而导致细胞凋亡。
微管作为细胞骨架,对多种细胞生命活动起支持作用。多项研究证明,微管是SFN的靶点,SFN能诱导微管紊乱[4,6]。同时,SFN导致的微管动态失衡会阻止自噬体和溶酶体融合,从而抑制自噬[5]。因此,SFN破坏微管可能影响线粒体自噬,进而引起凋亡。
PHB/PHB2是一组定位于线粒体的蛋白,并能在线粒体膜上形成二聚体,直接与LC3相互作用,诱导线粒体自噬体形成。在HeLa细胞中,PHB2作为线粒体自噬的关键受体在肿瘤中起重要作用[13]。我们认为非小细胞肺癌中有相似的现象。生物信息学分析显示,PHB和PHB2均与α-tubulin有相关性,PHB2与LC3Ⅱ有相互作用,这证明在非小细胞肺癌中,PHB/PHB2二聚体也能够介导线粒体自噬,并且微管蛋白α-tubulin能够调控PHB/PHB2介导的线粒体自噬。PHB2表达高的肺癌患者生存率显著降低,这意味着PHB2是一个癌基因,靶向PHB2可能成为治疗肺癌的新方向。
先前的研究表明,SFN通过抑制自噬体与溶酶体融合抑制自噬[1],在本研究中,质谱结果表明SFN抑制PHB的表达,PHB与LC3Ⅱ有相互作用,介导线粒体自噬体的形成。电镜结果显示SFN处理后导致细胞自噬体堆积,这提示我们SFN不仅抑制自噬体与溶酶体的融合,还能够抑制自噬体的形成,两种途径共同抑制线粒体自噬。
综上所述,我们提出了SFN抑制线粒体自噬的新机制。这些结果有助于我们通过靶向线粒体相关分子来建立新的抗癌治疗方法。
