补骨脂酚对多柔比星心脏毒性的拮抗作用及其机制
2020-03-02王长鹰
任 何,王长鹰
(1空军军医大学第二附属医院心血管内科,西安 710038;2中国西安国际医学中心心脏内科;*通讯作者,E-mail:changyingwangafmu@126.com)
自20世纪60年代以来,因其高效且广谱的抗肿瘤作用,多柔比星(doxorubicin, DOX)已广泛应用于血液肿瘤和多种实体肿瘤的临床化疗[1]。然而,多柔比星在治疗过程中造成的心脏毒性等不良反应也严重限制了其进一步的应用[2]。尽管多柔比星诱导心脏毒性的发病机制尚未完全阐明,但大量研究表明,心肌细胞凋亡[3]、氧化应激和线粒体损伤[4,5]、血管活性胺释放[6]和细胞自噬[7]均参与了其致伤过程,并最终导致累积剂量后心肌病的进展。
补骨脂酚(bakuchiol,BAK)是豆科植物补骨脂果实中提取的一种有效单体成分,具有广泛的药理学活性,包括抗氧化、抗凋亡、抗菌、抗炎、抗抑郁、降血糖以及抑制肝微粒体氧化作用等[8]。此外,补骨脂酚还与心肌缺血/再灌注损伤、肝纤维化、癌症、骨质疏松症、糖尿病和神经退行性疾病等多种疾病密切相关[9,10]。近年来,补骨脂酚在重要器官如心脏和肝脏的疾病模型中均显示出显著的保护作用[11,12]。以往有研究表明,在离体细胞水平上,补骨脂酚可以减轻阿霉素(又名多柔比星)对心肌细胞的损伤作用[13],但是在在体动物水平上尚未得到证实,并且补骨脂酚减轻多柔比星引起的心脏毒性的分子保护机制也未完全阐明。为此,本研究采用小鼠多柔比星急性心肌损伤模型,以进一步探究补骨脂酚减轻多柔比星心脏毒性的分子机制。
1 材料和方法
1.1 实验动物和试剂
清洁级雄性C57小鼠60只,8周龄,体质量22-25 g(空军军医大学实验动物中心提供)。动物生产许可证号:SCXK(军)2007-007号。补骨脂酚和3-TYP(Sigma公司,美国);DOX(Cayman公司,美国);乳酸脱氢酶(LDH)、丙二醛(MDA)含量检测试剂盒和超氧化物歧化酶(SOD)活性检测试剂盒(南京建成生物工程研究所);超氧化物阴离子荧光探针(Dihydroethidium,DHE)(Invitrogen公司,美国);TUNEL检测试剂盒(Roche Biochemicals公司,美国);anti-SIRT3、anti-Ac-SOD2抗体、anti-SOD2抗体(Abcam公司,美国),anti-β-actin抗体、羊抗兔、羊抗鼠二抗(北京中杉金桥公司)。
1.2 动物模型的建立
小鼠急性心脏毒性模型以单次腹腔注射多柔比星(15 mg/kg,溶于生理盐水)进行构建[14]。正常组(control组)小鼠腹腔注射等容量的生理盐水(0.2 ml)。
1.2.1 实验分组及给药处理 将60只C57BL/6小鼠随机分为4组,每组15只,即正常组(control组)、多柔比星组(DOX组)、补骨脂酚处理组(DOX+BAK组)、抑制剂加补骨脂酚处理组(3-TYP+DOX+BAK组)。DOX+BAK组小鼠经DOX处理后再通过腹腔注射补骨脂酚[剂量为20 mg/(kg·d)]5 d,以完成药物处理。3-TYP+DOX+BAK组小鼠在多柔比星给药前3 d,每日腹腔注射1次SIRT3选择性抑制剂3-TYP[剂量为50 mg/(kg·d),溶解于生理盐水],共3 d,并后续处理同DOX+BAK组小鼠。
1.2.2 心肌力学指标检测 各组小鼠处理完成后,通过右侧颈总动脉导管插入小鼠左心室并与压力换能器相连接,待小鼠呼吸心率稳定后记录左心室内压最大上升速率(+dP/dtmax)和左心室内压最大下降速率(-dP/dtmax)。
1.2.3 血清LDH水平测定 各组小鼠颈动脉取血后静置并离心获得血清标本,按照乳酸脱氢酶(LDH)活性检测试剂盒(南京建成生物工程研究所)说明书依次加入基质缓冲液、NAD+溶液、2,4-二硝基苯肼溶液和0.4 mol/L NaOH溶液后,室温放置5 min,用分光光度计在440 nm吸收波长测定各组小鼠血清LDH的水平。
1.2.4 心肌组织HE染色 DOX诱导的心脏毒性中心肌细胞损伤的重要标志之一表现为心肌细胞的空泡变性。各组小鼠心脏标本经漂洗后置于10%福尔马林中固定后制备成石蜡块,并切成5 μm的心脏切片。用二甲苯脱去切片中的石蜡,再经由梯度浓度酒精,最后入蒸馏水。将已入蒸馏水后的切片放入苏木精水溶液中染色5 min,酸水及氨水中分色各30 s,流水冲洗1 h后入蒸馏水片刻,70%和90%酒精中脱水各10 min,最后入酒精伊红染色液染色3 min,染色后的切片经纯酒精脱水,再经二甲苯使切片透明,将已透明的切片滴上树胶,盖上盖玻片封固。用光学显微镜拍照以观察心脏病理改变。
1.2.5 心肌组织氧化应激水平测定 各组小鼠心脏标本经生理盐水漂洗后,将心肌组织制成组织匀浆。严格按照MDA和SOD检测试剂盒说明书检测心肌组织内MDA的含量和SOD的活性。各组小鼠心脏标本经液氮速冻后切成10 μm的冰冻切片,按照超氧化物阴离子荧光探针(DHE)试剂盒说明书进行染色以检测心肌组织冰冻切片中ROS的生成量,避光用荧光显微镜拍照并用Image J软件分析结果。
1.2.6 心肌细胞凋亡检测 前述制备完成的心脏石蜡切片经二甲苯浸洗,梯度乙醇处理后用PBS液漂洗2次,再用Proteinase K工作液在37 ℃处理组织切片20 min,按照TUNEL检测试剂盒(Roche Biochemicals公司,美国)说明书对石蜡切片上心肌凋亡细胞核进行染色,DAPI染液对石蜡切片上所有心肌细胞核进行染色,用荧光显微镜观察并计数拍照。以凋亡细胞核数(绿色标记)/计数的细胞核总数(蓝色标记)×100%表示细胞凋亡指数。
1.2.7 心肌组织蛋白表达测定 常规方法提取各组小鼠心脏总蛋白后,蛋白定量试剂盒检测各组样品蛋白浓度。按照每孔40 μg的上样量将各组蛋白经聚丙烯酰胺变性凝胶电泳分离,并用湿转法将蛋白转移到PVDF膜上。各条带用5%脱脂牛奶室温下封闭1 h后,在anti-SIRT3(1 ∶1 000)、Ac-SOD2(1 ∶1 000)、SOD2(1 ∶500)和β-actin(1 ∶1 000)抗体管中4 ℃孵育过夜;TBST摇洗条带3次,再使用辣根过氧化物酶标记的二抗(1 ∶4 000)室温孵育2 h,TBST洗涤条带3次。使用Bio-Rad成像系统检测条带并进行分析。
1.3 统计学分析
2 结果
2.1 各组小鼠心肌损伤及心肌力学指标比较
小鼠血清LDH检测结果显示,与control组小鼠相比,DOX组小鼠血清内LDH活性显著上升,给予BAK处理后,DOX+BAK组小鼠血清内LDH活性明显降低;而使用SIRT3特异性阻断剂3-TYP处理可以明显逆转BAK对小鼠血清内LDH活性的抑制效果(P<0.05,见图1)。各组小鼠心脏收缩和舒张功能检测结果显示,与control组小鼠相比,DOX组小鼠心脏收缩和舒张功能明显受损,表现为+dP/dt与-dP/dt明显降低,给与BAK处理后能明显提高DOX+BAK组小鼠心脏+dP/dt与-dP/dt值;而使用3-TYP处理可以明显逆转BAK对小鼠心脏功能的保护作用(P<0.05,见图1)。
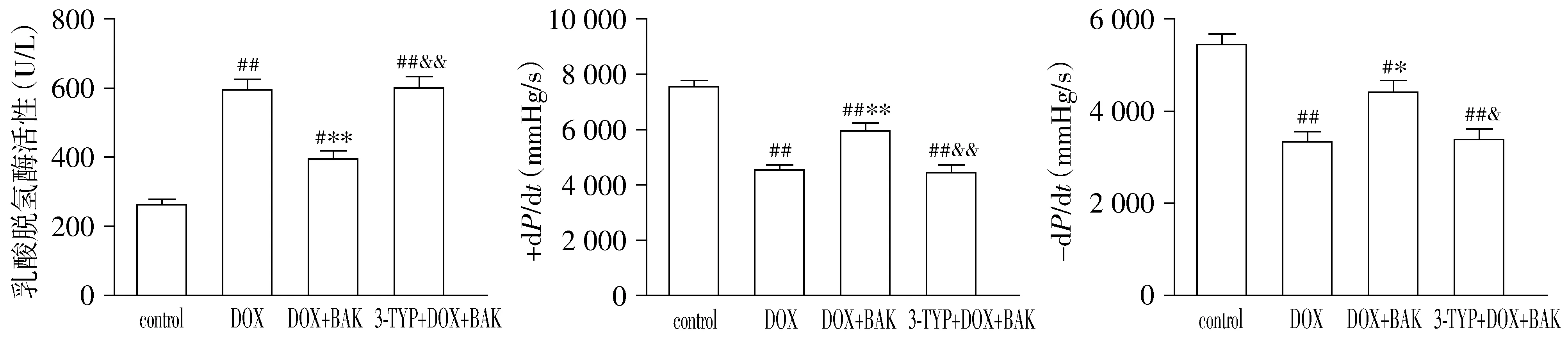
与control组相比,#P<0.05,##P<0.01;与DOX组相比,*P<0.05,**P<0.01;与DOX+BAK组相比,&P<0.05,&&P<0.01图1 各组小鼠血清LDH水平和心肌力学指标检测比较Figure 1 Comparison of serum LDH level and myocardial mechanical indexes among four groups
2.2 各组小鼠心肌组织HE染色比较
小鼠心肌组织HE染色结果显示,control组小鼠心肌细胞几乎没有检测到空泡变性,而DOX处理组小鼠空泡变性明显增加,给予BAK处理可以明显减轻DOX+BAK组小鼠心肌细胞的空泡化程度;而使用3-TYP处理可以明显逆转BAK对小鼠心肌损伤的保护作用(见图2)。
2.3 各组小鼠心肌组织氧化应激水平比较
小鼠心肌组织氧化应激水平检测结果显示,DOX可明显增加心肌组织内脂质过氧化产物MDA含量并降低超氧化物歧化酶SOD的含量,给予BAK可以明显降低DOX+BAK组小鼠心肌细胞的MDA含量并增加SOD含量;而使用3-TYP处理可以明显逆转BAK对小鼠上述指标的影响(P<0.05,见图3)。此外,各组小鼠心肌组织内ROS生成量检测结果显示,与control组小鼠相比,DOX组小鼠心肌组织内ROS生成量明显增加,给予BAK处理可以明显降低DOX+BAK组小鼠心肌组织ROS产量;而使用3-TYP处理可以明显逆转BAK对小鼠心肌组织ROS生成的抑制作用(P<0.05,见图3)。

图2 各组小鼠心肌组织HE染色比较Figure 2 HE staining of myocardial tissues in each group
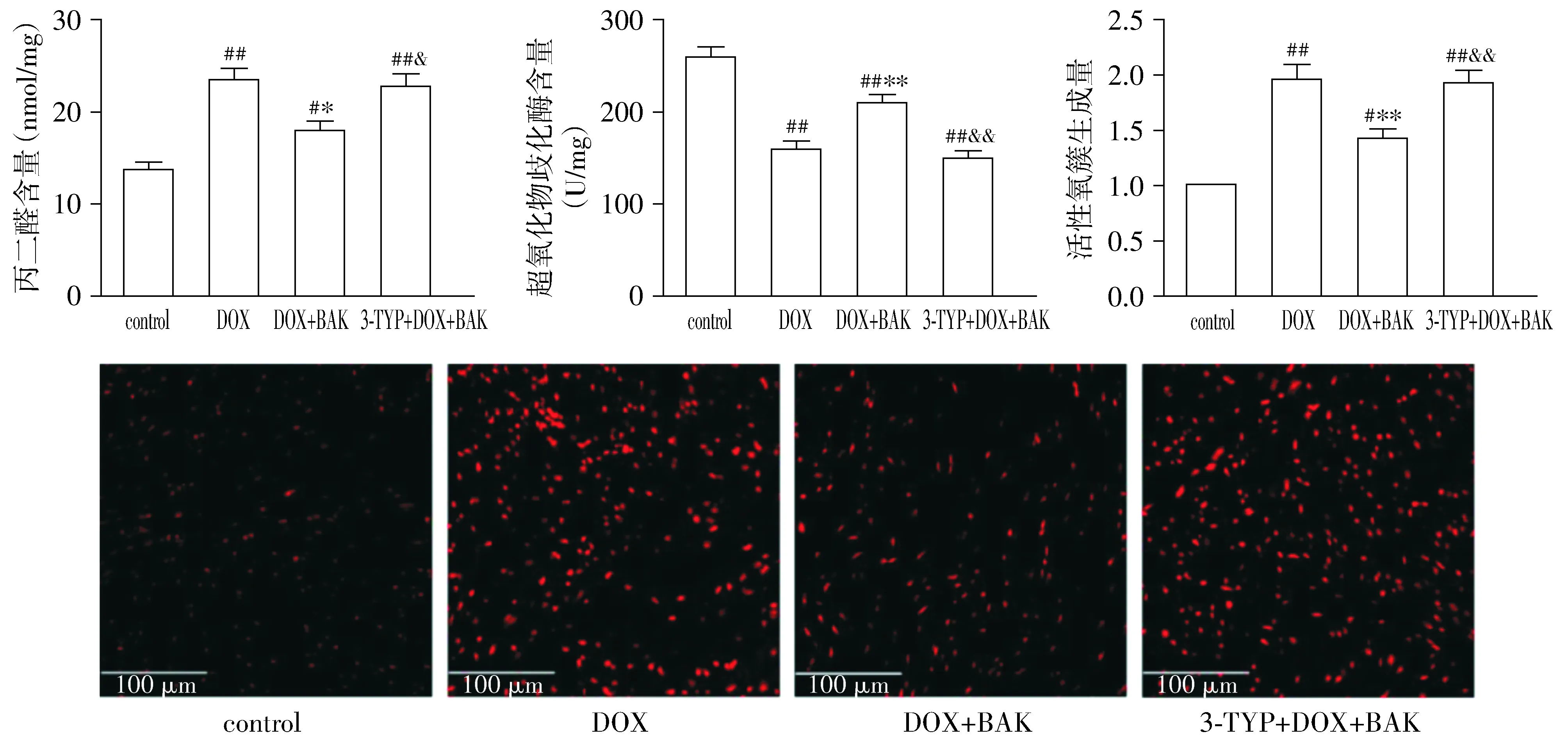
与control组相比,#P<0.05,##P<0.01;与DOX组相比,*P<0.05,**P<0.01;与DOX+BAK组相比,&P<0.05,&&P<0.01图3 各组小鼠心肌氧化应激水平比较Figure 3 Comparison of oxidative stress level among four groups
2.4 各组小鼠心肌凋亡染色比较
小鼠心肌细胞凋亡检测结果显示,与control组小鼠相比,DOX组小鼠心肌细胞凋亡率明显增加(P<0.05),给予BAK处理可以明显降低DOX+BAK组小鼠心肌细胞凋亡程度(P<0.05);而使用3-TYP处理可以明显逆转BAK对小鼠心肌细胞凋亡的的抑制作用(P<0.05,见图4)。
2.5 各组小鼠心肌组织SIRT3/SOD2信号比较
小鼠心肌组织SIRT3/SOD2信号通路相关蛋白表达检测结果显示,与control组相比,DOX组小鼠心肌组织中SIRT3的表达量明显下降,SOD2的乙酰化水平明显增高(P<0.05),给予BAK处理可以明显提高DOX+BAK组小鼠心肌组织内SIRT3的表达,降低SOD2的乙酰化程度(P<0.05);而使用3-TYP处理可以明显逆转BAK对小鼠心肌组织SIRT3/SOD2信号通路的激动作用(P<0.05,见图5)。

图4 各组小鼠心肌细胞凋亡比较Figure 4 Comparison of cardiomyocytes apoptosis among four groups

与control组相比,##P<0.01;与DOX组相比,**P<0.01;与DOX+BAK组相比,&&P<0.01图5 各组小鼠心肌SIRT3/SOD2分子蛋白表达比较Figure 5 Comparison of the expression of SIRT3 and SOD2 in myocardium among four groups
3 讨论
多柔比星是一种蒽环类抗肿瘤药物,临床上用于治疗多种恶性肿瘤,如淋巴瘤、实体肿瘤和白血病等[1,15]。然而,心脏毒性是多柔比星和其他蒽环类药物如道诺霉素、表柔比星和伊达比星的主要不良反应。癌症患者发生心脏功能障碍、扩张型心肌病、低血压、心动过速、心律失常和心力衰竭等心血管疾病的风险严重限制了多柔比星对癌症的治疗应用[16-18]。以往研究证实,不论是单剂量用药还是在累积剂量治疗后的近期或长时间内,多柔比星均可能对患者造成心脏损伤[19]。本研究结果同样观察到,与control组小鼠相比,DOX组小鼠血清内LDH活性显著上升,并且DOX组小鼠心脏收缩和舒张功能明显受损。此外,DOX组相较于control组小鼠心肌组织空泡变性明显增加。本研究进一步在动物模型上证实了DOX诱导的心脏毒性中心肌细胞的损伤,因此,探寻能缓解多柔比星心脏毒性的保护性药物对促进肿瘤患者预后有显著的临床意义。
多柔比星诱导心脏毒性的发病机制尚未完全阐明,但许多研究表明,心肌细胞氧化应激损伤、炎症反应和凋亡在其中扮演重要角色[20,21]。多柔比星可诱导心肌组织产生大量活性氧物质,加之心脏缺乏清除氧自由基的抗氧化酶,因此,在氧化物产生和抗氧化防御系统之间不平衡的条件下,心肌细胞膜、线粒体膜、内质网、核酸和细胞内大分子被严重破坏,继而导致心肌细胞凋亡,并进一步进展为心脏功能损伤[20,22]。在本研究中,我们同样观察到,在动物模型上,DOX可明显增加心肌组织内脂质过氧化产物MDA含量并降低超氧化物歧化酶SOD的含量,并且与control组小鼠相比,DOX组小鼠心肌组织内ROS产量明显增加,继而导致DOX组小鼠心肌细胞凋亡率明显增加。因此,寻找有效的抗氧化应激药物可能是预防DOX在临床治疗中诱发心脏毒性的有效策略。
研究报道,一些药用植物可以减轻DOX诱导的心脏毒性[18,23],因此研究植物衍生的天然化合物以降低DOX的心脏毒性副作用并增强其化学治疗效果是合乎逻辑的。补骨脂酚是从传统中草药补骨脂中提取的一种单帖类化合物[8],大量研究证实,补骨脂酚能发挥显著的心肌保护作用。Feng等[24]发现,补骨脂酚可通过维持线粒体功能来减轻心肌缺血再灌注损伤。Wang等[25]研究表明,补骨脂酚可通过阻断NF-κB信号通路来预防病理性心肌肥大。秦志刚等[26]证实,沉默信息调控因子1通路介导补骨脂酚抑制脂多糖诱导的乳鼠心肌细胞炎症反应及凋亡。此外,补骨脂酚在多种疾病中都发挥了抗氧化应激和抗凋亡的作用。魏毅君等[27]发现,补骨脂酚可通过抑制凋亡、氧化应激和炎症反应缓解小鼠脓毒症脑病。王垒等[28]证实,补骨脂酚可通过激活PKCε信号通路,进而增强细胞抗氧化应激和抗凋亡能力,最终缓解内皮细胞缺血再灌注损伤。更重要的是,在细胞水平上,陆晨曦等[13]发现补骨脂酚可显著减轻蒽环类抗癌药阿霉素引起的H9c2心肌细胞损伤。因此,我们猜想在动物模型上,补骨脂酚同样可通过抑制氧化应激损伤和凋亡减轻多柔比星引起的心脏毒性。本研究结果发现,与DOX组小鼠相比,给予补骨脂酚处理可以明显降低DOX+BAK组小鼠心肌细胞的MDA含量并增加SOD含量,并抑制其心肌细胞凋亡。此外,补骨脂酚处理可以显著抑制DOX+BAK组小鼠心肌细胞的空泡变性和血清LDH活性,同时保护了小鼠的心脏收缩和舒张功能。综上,我们进一步证实了,在动物模型上,补骨脂酚发挥抗多柔比星心脏毒性心肌保护作用与其抗氧化和抗凋亡活性密切相关。
为了进一步探究并完善补骨脂酚保护作用的分子机制,我们发现,作为线粒体内主要的去乙酰化酶,SIRT3广泛分布于肾脏、脑、心脏及肝脏等富含线粒体的组织器官中,其可对组蛋白和非组蛋白去乙酰化,在调控细胞代谢、细胞周期、细胞凋亡及细胞寿命方面起着重要的作用[29]。大量研究报道SIRT3在心肌肥厚、心力衰竭、心肌缺血/再灌注损伤、高血压及动脉粥样硬化等多种心血管疾病中,都起到了保护性作用[30]。尤其值得关注的是,激活SIRT3信号在减轻多柔比星心脏毒性中发挥重要作用[31]。本研究同样观察到,与control组相比,DOX组小鼠心肌组织中SIRT3的表达显著被抑制,SOD2的乙酰化程度显著上升,给予补骨脂酚处理可以明显提高DOX+BAK组小鼠心肌组织内SIRT3的表达,降低SOD2的乙酰化程度;而使用SIRT3特异性阻断剂3-TYP则明显逆转了BAK对DOX心脏毒性的上述保护效果。
综上所述,本研究首次在在体动物模型上证实,补骨脂酚可以通过激活SIRT3/SOD2信号通路抑制心肌氧化应激损伤和细胞凋亡,进而减轻多柔比星心脏毒性,保护了心脏功能。
