远隔缺血预适应对脑缺血再灌注损伤大鼠缺血半暗带区PERK/p-eIF2α通路及自噬的影响
2021-04-28师文娟黄语悠赵咏梅
杨 楠 丁 锚 闫 峰 师文娟 黄语悠 赵咏梅
(首都医科大学宣武医院中心实验室 北京市老年病医疗研究中心 神经变性病教育部重点实验室 脑血管病转化医学北京市重点实验室,北京 100053)
缺血性卒中占全部脑卒中的79%,具有高发病率、高致残率、高病死率的特点,是严重威胁人类健康的神经系统疾病之一,除在有限的时间窗内应用重组组织型纤溶酶原激活剂进行溶栓外,缺少有效的治疗和预防方法[1]。远隔缺血预适应(remote ischemic preconditioning, RIPC)是指通过对非重要器官的重复缺血/缺氧,显著增强其他远隔的靶器官或组织对缺血/缺氧的耐受能力。RIPC不直接作用于靶器官,而是在其他非重要器官进行,避免了对重要器官(如脑和心脏)直接进行预适应可能引起的缺血风险。本课题组以往的研究[2-3]表明,RIPC对脑缺血再灌注损伤有神经保护作用,但相关作用机制尚不完全清楚。
自噬是真核生物中重要的胞内降解机制,在缺乏营养的生长环境或应激刺激下,细胞启动自噬。研究[4]显示,在脑缺血中自噬是一把双刃剑,既可加重脑缺血损伤,也可防治脑缺血[4]。轻度或中度的自噬激活能促进细胞生存,而过度的自噬激活则促进细胞死亡。Beclin1和LC3B均为自噬相关基因,参与了自噬体的形成[5]。本课题组前期研究[6]结果均表明,脑缺血再灌注损伤后,脑内Beclin1和LC3B的表达增高,说明脑缺血可导致自噬水平升高。应用自噬抑制剂3-MA可显著下调大鼠缺血区的自噬相关蛋白LC3水平,缩小脑梗死体积,减轻脑损伤,说明抑制自噬过度激活可保护脑缺血再灌注损伤[7]。
有研究[8]表明,内质网应激(endoplasmic reticulum stress, ERS)对自噬有调控作用。内质网(endoplasmic reticulum, ER)是蛋白质合成的重要场所,在细胞代谢和各种病理过程中起着关键作用。ER内环境平衡的破坏会导致ERS。ERS发生时,激活eIF2α的激酶蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)与ER分子伴侣GRP78发生解离,GRP78与ER内大量的未折叠蛋白结合,以协助其正确折叠,这一过程会触发未折叠蛋白反应(unfolded protein response, UPR)[9]。UPR的激活导致ER伴侣蛋白水平升高,激活包括PERK/eIF2α 等信号通路[10]。ERS可以通过PERK/eIF2α信号通路激活自噬[8]。在小鼠胚胎成纤维细胞中,敲除PERK/eIF2α基因可抑制ERS诱导的自噬,说明PERK/eIF2α信号通路对于ERS诱导的自噬是必需的[11]。
研究[12]显示,心肌缺血再灌注损伤的保护作用是通过抑制自噬完成的,提示在脑以外的重要器官中抑制自噬过度激活可能是缺血再灌注损伤的潜在保护机制。但是,自噬是否参与RIPC的脑保护作用尚不清楚。因此,本研究采用后肢RIPC方法对大鼠大脑中动脉梗塞(middle cerebral artery occlusion, MCAO)再灌注大鼠进行保护,观察脑缺血大鼠再灌注24 h后自噬相关蛋白Beclin1、LC3B以及ER分子伴侣GRP78和ERS相关蛋白p-eIF2α的表达,从而研究RIPC保护大鼠局灶性脑缺血损伤过程中PERK/p-eIF2α通路及自噬水平的变化,探讨RIPC保护脑缺血损伤的相关机制。
1 材料与方法
1.1 仪器及试剂
小动物呼吸机和麻醉机(Harvard Apparatus公司,美国)、手术显微镜(Carl Zeiss公司,德国)、反馈式温度调节仪(CMA 150, Carnegie Medicin公司,瑞典)、双极电凝器(ACC100,北京德威医疗器械有限公司)、冰冻切片机(Thermo Fisher Scientific公司,美国)、荧光显微镜(Nikon公司,日本)。恩氟烷和水合氯醛购自河北一品制药公司,Beclin1、LC3B、GRP78、p-eIF2α、NeuN抗体均购自美国CST公司。
1.2 实验动物分组及处理
健康雄性SD大鼠,体质量280~320 g,北京维通利华实验动物公司,实验动物许可证号:SCXK(京)2012-0001。24只SD大鼠采用抽签法随机分为3组:假手术(Sham)组、MCAO组、RIPC+MCAO组,每组8只大鼠。饲养于SPF级动物室,自由进食进水。
1.3 动物模型制作
1)RIPC[2]:RIPC+MCAO组进行RIPC。首先分离大鼠双侧股动脉,动脉夹夹闭双侧股动脉10 min,之后松开动脉夹,再灌注10 min,构成一个循环,每天连续进行3个循环,连续进行3d。其余两组大鼠只切开皮肤后缝合。
2)MCAO模型制作:MCAO大鼠模型的制备依照改良Zea Longa法[13]。先在70%(体积分数)N2O和30%(体积分数)O2中混合5%(体积分数)恩氟烷诱导麻醉,后改用2%(体积分数)恩氟烷维持麻醉。大鼠经颈部作正中切口,切开皮肤和皮下组织,分离右侧颈总动脉并夹闭,颈外动脉凝断后,将尼龙线栓自颈外动脉残端插进颈内动脉,至线栓顶端到达距颈总动脉分叉约1.8~2.0 cm有阻力感处停止。缺血90 min 后,拔出线栓进行再灌注。逐层缝合肌肉、皮肤,再次消毒。术中监测大鼠各项生理参数在正常范围。手术成功后的大鼠提尾悬空时身体向正常侧弯曲[14],模型制作失败后随即补充。
1.4 免疫荧光双标染色
各组大鼠于再灌注后24 h用水合氯醛腹腔注射麻醉,快速断头取脑,行脑组织连续冰冻切片(厚度约为20 μm),-80 ℃保存。取Sham组、MCAO组以及RIPC+MCAO组大鼠脑组织冰冻切片,于预冷的4%(质量分数)多聚甲醛中固定10 min后,用0.2%(体积分数)TritonX-100破膜10 min,之后滴加5%(体积分数)的山羊血清室温封闭30 min,弃血清,之后分别滴加Beclin1与NeuN抗体(Beclin1抗体1∶200稀释,NeuN抗体1∶300稀释)、GRP78与Beclin1抗体(均1∶200稀释)、GRP78与LC3B抗体(均1∶200稀释),或Beclin1与p-eIF2α抗体(均1∶200稀释),4 ℃孵育过夜。阴性对照不加一抗,用PBS替代。次日将切片用PBS洗后,滴加荧光二抗(1∶300稀释),室温避光孵育1 h。PBS漂洗后,用含DAPI的封片剂封片。将封片后的切片置于荧光显微镜下观察大鼠脑皮质的缺血半暗带区[15]。在相同的放大倍数及参数下,每张脑组织冰冻切片随机选取4个视野照相,使用NIS Element软件统计阳性细胞数目。
1.5 统计学方法

2 结果
2.1 RIPC抑制MCAO大鼠缺血半暗带区Beclin1的表达
免疫荧光双标染色结果显示,在 MCAO大鼠脑缺血半暗带区内可见Beclin1阳性细胞及NeuN阳性细胞,其中 Beclin1阳性细胞为绿色荧光,NeuN阳性细胞为红色荧光,所有细胞的胞核为蓝色荧光。图像合并后,绿色与红色荧光重合,表明Beclin1与神经元共定位(图1A),即脑缺血再灌注后Beclin1在大鼠缺血半暗带区神经元内表达。
Sham组没有缺血半暗带区,其与缺血半暗带相对应的脑区内偶见Beclin1绿色荧光阳性细胞,MCAO组大鼠再灌注24 h,缺血半暗带区可见大量Beclin1绿色荧光阳性细胞,RIPC+MCAO组大鼠缺血半暗带区Beclin1阳性细胞数量较MCAO组明显减少(图1A),三组间Beclin1阳性细胞数量差异有统计学意义(P<0.05)。两两比较结果显示,MCAO组Beclin1阳性细胞较Sham组明显增高(P<0.05),RIPC+MCAO组Beclin1阳性细胞较MCAO组明显减少,差异有统计学意义(P<0.05)(图1B)。
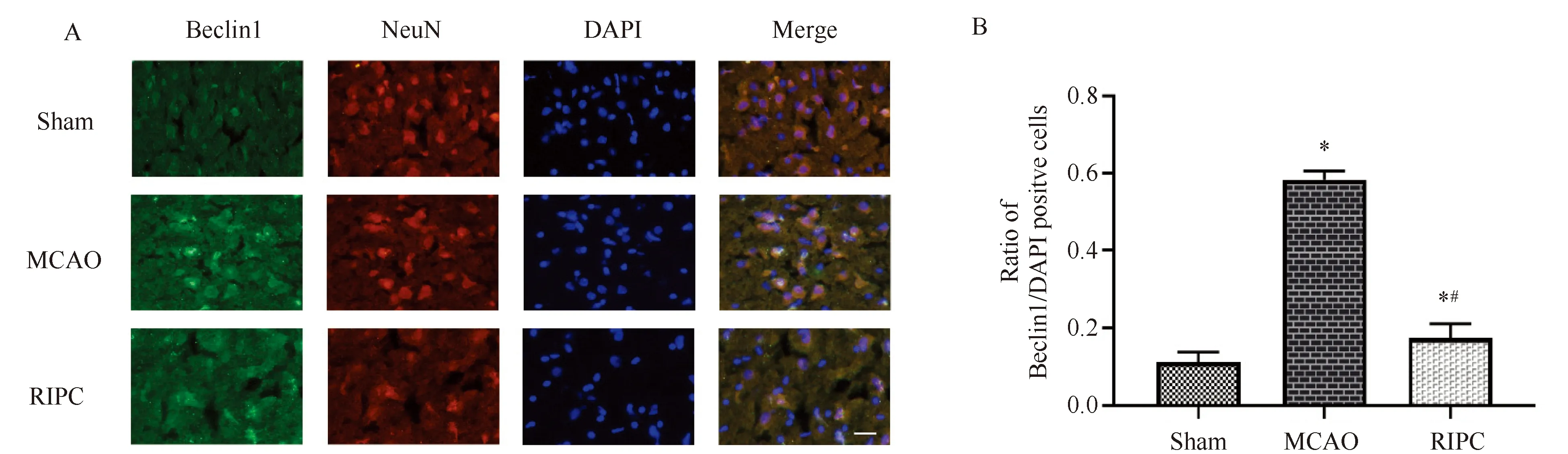
图1 免疫荧光双标染色法检测脑缺血再灌注后24 h Sham、MCAO与RIPC+MCAO组大鼠脑缺血半暗带区Beclin1与NeuN的表达 Fig.1 Expression of Beclin1 and NeuN in cerebral ischemic penumbra of Sham, MCAO and RIPC+MCAO groups after 24 h reperfusion which was examined with immunofluorescence double stainingA: A representative double immunofluorescence staining showed the colocalization of Beclin1 (green) and NeuN (red) in the ischemic penumbra of MCAO rats. Scale bar=20 μm. B: quantification of Beclin1 positive cell. Data are means±SD (n=5). *P<0.05 vs Sham group, #P<0.05 vs MCAO group; MCAO: middle cerebral artery occlusion; RIPC: remote ischemic preconditioning; DAPI: 4′,6-diamidino-2-phenylindole
2.2 MCAO大鼠缺血半暗带区GRP78分别与Beclin1和LC3B共定位
免疫荧光双标染色结果显示,MCAO组大鼠再灌注24 h脑缺血侧半暗带区内,GRP78阳性细胞呈绿色,Beclin1和LC3B阳性细胞均呈红色,胞核呈蓝色。合并图像发现,绿色荧光与红色荧光重合,表明GRP78分别与Beclin1和LC3B共定位,提示在缺血再灌注后,自噬相关蛋白Beclin1和LC3B表达的上调与ER分子伴侣GRP78相关(图2)。

图2 脑缺血大鼠再灌注24 h后半暗带区GRP78分别与Beclin1和LC3B 共定位Fig.2 GRP78 was colocalized with Beclin1 and LC3B respectively, which was examined with immunofluorescence staining in the ischemic penumbra of MCAO group rats after 24 h reperfusionA representative double immunofluorescence staining showed the colocalization of GRP78(green)with Beclin1(red) and LC3B(red) respectively in the ischemic penumbra of MCAO rats. Scale bar=20 μm. MCAO: middle cerebral artery occlusion; DAPI: 4′,6-diamidino-2-phenylindole.
2.3 MCAO大鼠缺血半暗带区Beclin1与p-eIF2α共定位,且RIPC抑制MCAO大鼠缺血半暗带区Beclin1和p-eIF2α双标阳性细胞的表达
通过免疫荧光双标染色可见,MCAO组大鼠再灌注24 h缺血侧半暗带区内,呈红色荧光的阳性细胞是Beclin1,呈绿色荧光的阳性细胞是p-eIF2α,蓝色标记的是细胞核。合并图像发现,绿色荧光与红色荧光重合,表明Beclin1与p-eIF2α共定位(图3A),提示在脑缺血再灌注后,自噬相关蛋白Beclin1的表达上调与ERS相关蛋白p-eIF2α相关。
Sham组大鼠没有缺血半暗带区,其与缺血半暗带相对应的脑区内未见Beclin1和p-eIF2α双标阳性细胞。而MCAO组、RIPC+MCAO组大鼠缺血半暗带区可见Beclin1和p-eIF2α双标阳性细胞(图3A),三组间Beclin1和p-eIF2α双标阳性细胞数量差异有统计学意义(P<0.05)。两两比较结果显示,MCAO组Beclin1和p-eIF2α双标阳性细胞较Sham组明显增高(P<0.05),RIPC+MCAO组Beclin1和p-eIF2α双标阳性细胞较MCAO组明显减少,差异有统计学意义(P<0.05)(图3B)。

图3 免疫荧光双标染色法检测脑缺血再灌注后24 h Sham、MCAO与RIPC+MCAO组大鼠脑缺血半暗带区Beclin1与p-eIF2α的表达Fig.3 Expression of Beclin1 and p-eIF2α in cerebral ischemic penumbra of Sham, MCAO and RIPC+MCAO groups rats after 24 h reperfusion which was examined with immunofluorescence double stainingA: A representative double immunofluorescence staining showed the colocalization of Beclin1 (red) and p-eIF2α (green) in the ischemic penumbra of MCAO rats. Scale bar=20 μm. B: quantification of Beclin1 and p-eIF2α double positive cells. Data are means±SD (n=5). *P<0.05 vs Sham group, #P<0.05 vs MCAO group; MCAO: middle cerebral artery occlusion; RIPC: remote ischemic preconditioning; DAPI: 4′,6-diamidino-2-phenylindole.
3 讨论
缺血适应作为脑缺血损伤的有效保护策略,近年来引起人们的广泛关注,在机体重要器官进行缺血预适应难度较大,且易形成致死性缺血,故不宜被临床采用。本课题组前期研究[16]显示,采用远端肢体进行缺血预适应,对脑或其他重要器官也同样具有保护作用,且更适合向临床转化。因此,深入研究 RIPC对脑缺血的保护作用并探讨其相关机制,对临床应用RIPC治疗缺血性脑血管病具有重要意义。本文旨在探究RIPC对局灶性脑缺血损伤大鼠再灌注后24 h缺血半暗带区自噬水平的影响,以及RIPC是否通过抑制PERK/p-eIF2α通路,从而避免自噬过度激活,产生脑保护作用,进一步明确RIPC发挥神经保护作用的具体机制。
自噬是机体的一种防御性反应,适度自噬具有维持细胞稳态和促进细胞生存的作用,但自噬的过度激活则可导致细胞死亡。Beclin1在自噬的起始阶段具有重要作用,并且能够促进LC3的形成以启动自噬[17]。研究[18]表明,在大脑缺血再灌注几小时后,自噬相关蛋白表达就开始上升。为了探究RIPC对脑缺血再灌注后自噬的影响,本研究检测了RIPC对各组大鼠缺血侧脑组织自噬相关蛋白Beclin1的表达。研究结果显示,与Sham组相比,MCAO组大鼠脑缺血再灌注后24 h缺血侧脑组织自噬相关蛋白Beclin1表达水平明显升高,表明脑缺血再灌注诱导Beclin1过量产生,自噬被过度激活。通过将Beclin1与NeuN进行免疫荧光双标染色发现,自噬相关蛋白Beclin1与神经元共定位,说明缺血再灌注后Beclin1在缺血半暗带区神经元内表达增多,提示此时神经元发生过度自噬,这可能是造成脑缺血神经元损伤的主要原因之一。本课题组前期的研究[16]结果表明,给予RIPC处理的MCAO大鼠神经功能评分明显降低,脑梗死体积明显减小。而本研究结果显示,予以RIPC的MCAO大鼠脑缺血半暗带区自噬相关蛋白Beclin1表达水平明显下降。因此,RIPC对脑缺血再灌注损伤的保护作用很可能是通过减少Beclin1产生,进而抑制神经元过度自噬实现的。有研究[19]报道,联合应用RIPC和缺血后适应可通过抑制自噬保护脑缺血大鼠,而本研究则证明单独应用RIPC可通过抑制神经元自噬,发挥脑保护作用。
LC3作为自噬体形成的标志,与自噬空泡形成的数量有关,代表自噬的活性程度。LC3有3种不同的亚型(LC3A、LC3B、LC3C),通常检测组织中LC3B蛋白的含量代表组织内LC3的表达量[20]。最近研究[21]显示,ER分子伴侣GRP78的表达上调可以激活自噬,而GRP78的缺失可抑制ERS诱导的自噬激活,说明GRP78很可能是ERS和自噬激活中的桥梁蛋白。本研究选取缺血再灌注24 h大鼠脑组织进行免疫荧光双标染色,结果显示,GRP78分别与自噬相关蛋白Beclin1和LC3B共定位,提示在缺血再灌注后自噬相关蛋白Beclin1和LC3B的产生与ERS有关,ER分子伴侣GRP78的产生很可能诱导自噬过度激活。
ERS导致的UPR反应可激活PERK/eIF2α信号通路,进而引起自噬激活[10]。文献[11]报道,依赖PERK的eIF2α磷酸化可诱导小鼠胚胎成纤维细胞自噬,敲除PERK/eIF2α基因可抑制ERS诱导的自噬。本研究结果显示,ERS相关蛋白p-eIF2α可与自噬相关蛋白Beclin1共定位,提示在脑缺血再灌注后自噬的过度激活与ERS相关蛋白p-eIF2α有关,该结果进一步说明脑缺血再灌注后自噬的过度激活与ERS相关。本研究结果还显示,脑缺血再灌注24 h后p-eIF2α和Beclin1双标阳性细胞数较Sham组明显增多,说明脑缺血再灌注24 h后,ERS很可能通过激活PERK/eIF2α通路,导致自噬过度激活。给予RIPC处理的大鼠脑组织中p-eIF2α和Beclin1双标阳性细胞数较MCAO组大鼠明显下降,提示在脑缺血再灌注后,RIPC可能通过减少ERS的产生,从而抑制自噬过度激活,减少神经元自噬性死亡,发挥对脑缺血再灌注损伤的保护作用。
综上所述,本研究结果表明,RIPC很可能通过抑制ERS,使神经元中的自噬相关蛋白表达下调,进而抑制脑缺血再灌注自噬的过度激活,从而减少神经元死亡,发挥脑保护作用。目前有关RIPC通过抑制ERS调控自噬发挥脑保护作用的相关研究尚未见报道,本研究为深入研究RIPC的相关机制提供了新证据,对临床应用RIPC治疗缺血性脑病有一定的理论指导意义。
