CBA/CaJ和C57BL/6J小鼠全耳蜗毛细胞随着年龄增长不同损害模式的比较
2020-01-01周凌宣伟军丁大连
周凌,宣伟军,丁大连
(1. 黑龙江中医药大学附属第一医院耳鼻咽喉科,哈尔滨 150040; 2. 广西中医药大学第一临床医学院 耳鼻咽喉科, 南宁 530023; 3. 马萨诸塞州总医院, 哈佛大学医学院,波士顿 MA 02114, 美国; 4. 听力与耳聋中心,纽约州立布法罗大学,布法罗 NY 14214, 美国)
老年性聋又称年龄相关性聋(age-related hearing loss, AHL),随着世界人口的老年化, AHL的发病率也逐年递增[1]。 AHL因其病因病机复杂和防治困难, AHL成为当前耳科学研究的重要热门课题之一[2-4]。由于在AHL的临床研究中较难开展组织细胞水平或蛋白水平或基因水平等分子层面的实验研究,因此目前对AHL的组织细胞学及更微细结构的研究大多还是借助动物实验模型。在诸多哺乳类实验动物模型中,由于小鼠的生命周期相对较短而且目前已成功建立起多种AHL相关基因缺陷的小鼠实验模型,因此AHL小鼠模型中的CBA/CaJ和C57BL/6J小鼠得到更多的应用。CBA/CaJ和C57BL/6J小鼠最早是由美国Jackson Laboratory于上世纪四十年代引入通过近交培育出的、具有遗传基因纯合、个体差异小、对试验反应均一、试验结果更准确和更可靠等特点的两个鼠种,并维持应用至今。然而,这两种较常用小鼠模型的耳蜗毛细胞损害规律及发展模式却并不相同[5-6]。本文应用全耳蜗基底膜铺片技术和耳蜗图制备技术,对出生后不同年龄的CBA/CaJ小鼠和C57BL/6J小鼠的全耳蜗毛细胞进行了精确的定位定量观察,并将两种不同小鼠的耳蜗毛细胞病理学改变进行了对比分析及讨论。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验动物为清洁级CBA/CaJ和C57BL/6J成年小鼠各32只,雌雄各半,年龄分别在6个月、12个月、18个月和24个月,每个年龄组各8只,由美国国家核准认定的标准实验动物源提供机构、国际标准CBA/CaJ和C57BL/6J小鼠培育基地Jackson Laboratory(https:/www.jax.org/strain)提供,其mouse strain datasheet-stock No.分别是000654、000664,均饲养于获得美国官方严格认证的美国纽约州立布法罗大学(State University of New York at Buffalo)实验动物中心。研究项目获得美国相关部门严格审查和批准开展。
1.1.2 试剂及仪器
主要实验试剂Hematoxylin Solution, Harris Modified(Sigma-Aldrich,产品号HHS16),Potassium dihydrogen phosphate(Sigma-Aldrich,产品号NIST200B),Disodium hydrogen phosphate(Sigma-Aldrich,产品号NIST218611),Sodium succinate dibasic hexahydrate(Sigma-Aldrich,产品号S2378),Tetranitroblue tetrazolium chloride(Sigma-Aldrich,产品号T4000),Xylenes(Sigma-Aldrich, 产品号是XX0060)。
1.2 方法
1.2.1 耳蜗标本制备与铺片
在麻醉状态下,牵引小鼠颈部造成颈椎脱位,然后开颅取出小鼠颞骨。在解剖显微镜下,在蜗尖钻孔并摘除镫骨同时打开园窗,向耳蜗内灌入4%甲醛固定液并固定24 h以上,再经5%盐酸溶液脱钙48 h后,分离取出全耳蜗基底膜,逐级递减梯度乙醇水化,苏木素染液常规对基底膜染色,自来水冲洗返蓝,逐级递增梯度乙醇脱水,二甲苯透明,最后将全耳蜗基底膜移入载玻片上的甘油滴中,盖上盖玻片,中性树胶封固。或向耳蜗内灌入琥珀酸脱氢酶孵育液,即琥珀酸脱氢酶孵育液由一份0.2 mol/L琥珀酸钠和一份0.2 mol/L磷酸盐缓冲液及两份0.1%氯化硝基四氮唑蓝混合配制而成。将含有琥珀酸脱氢酶孵育液的耳蜗置于37℃恒温箱内孵育40~60 min,然后将耳蜗浸入10%中性福尔马林固定液固定24 h以上,前法脱钙后,分离取出全耳蜗基底膜移入载玻片上的甘油滴中,盖上盖玻片,中性树胶封固[7-9],显微镜下观察。
1.2.2 耳蜗图和毛细胞的定位定量分析
在放大400倍的普通光学显微镜下,分别对6月龄组、12月龄组、18月龄组和24月龄组的CBA/CaJ小鼠和C57BL/6J小鼠的全耳蜗基底膜进行毛细胞缺损的定位定量观察。在置有标记单位长度为0.24 mm的显微测量尺目镜的光学显微镜下,从蜗尖向蜗底逐个视野依次进行内、外毛细胞计数,并将采集的数据输入到计算机中,分别与耳蜗图软件中预先设置的CBA/CaJ小鼠和C57BL/6J小鼠参考数据进行逐一比较,耳蜗基底膜的实际全长被转换为百分比长度单位,单位长度内的毛细胞实际数量被转换成毛细胞密度并按照百分比分布在耳蜗基底膜的各个部位,从而建立其该耳蜗的毛细胞缺损分析图。最后应用本耳蜗图软件程序,将每组8个耳蜗的毛细胞缺损分析图整合成该组动物的平均耳蜗图[7-9]。另外,将不同区域的毛细胞密度值摘出,采集数据被输入到GraphPad Prism 5软件系统,最后进行统计分析。
1.3 统计学分析
采用SPSS 16.0软件进行统计分析。两个或多个构成比比较应用卡方(χ2)检验法,以P<0.05差异有显著性。
2 结果
CBA/CaJ小鼠耳蜗图结果显示,6月龄全耳蜗内外毛细胞数量完整,未见缺损(图1a)。12月龄从蜗尖开始至距离蜗尖15%区域出现外毛细胞缺损,离蜗尖越近缺损越重,最高缺损达到15%。耳蜗底回Hook区域,即距离蜗尖85%至沟端区域也有缺损,离底部越近缺损越多,但不如顶部明显,最高缺损占5%(图1b)。18月龄耳蜗外毛细胞缺损扩大,从蜗尖开始至距离蜗尖30%区域均出现外毛细胞缺损,其中从蜗尖至距离蜗尖15%区域处呈陡降高峰,显示该区域缺损最重,最高缺损达到40%,同时向底回方向逐渐减少。耳蜗底回距离蜗尖85%至沟端区域外毛细胞也有缺损,缺损继续扩大,最高达到15%,与耳蜗顶回缺损相反,外毛细胞缺损向底回方向逐渐加重(图1c)。24月龄全耳蜗各回外毛细胞均有不同程度缺损,比18月龄明显扩大,其中从蜗尖至距离蜗尖35%区域处呈陡降高峰,显示该区域外毛细胞缺损最重,最高缺损达到70%。距离蜗尖65%至沟端区域,外毛细胞缺损也对应扩大,最高缺损占30%。耳蜗顶部和底部内毛细胞开始出现缺损,其中距离蜗尖75%至沟端区域缺损增加,最高可达15%,而顶回有所缺损,最高占5%,比底部轻(图1d)。CBA/CaJ小鼠不同龄全耳蜗铺片顶回、底回毛细胞比较镜下观察见图2A1-D2。总之,CBA/CaJ小鼠耳蜗毛细胞变化特点是,伴随着年龄增长,12月龄开始出现耳蜗外毛细胞轻度缺损,遵循着从顶回和底回两端开始,向中回延伸,但顶回毛细胞损害比底回严重的病变规律。24月龄内毛细胞在顶回和底回两端开始出现缺损,但损害程度较轻。
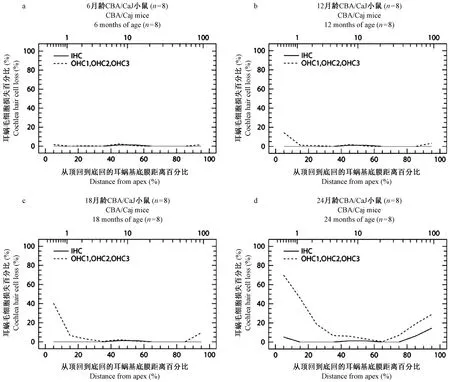
注: IHC:内毛细胞平均曲线。OHC1、OHC2、OHC3:第一、二、 三排外毛细胞平均曲线。图1 CBA/CaJ小鼠不同龄全耳蜗毛细胞计数耳蜗图Note. IHC: average curve of inner hair cells. OHC1, OHC2, OHC3: average curve of the first, second and third row of outer hair cells.Figure 1 Cochleograms of whole cochlea hair cells count in the CBA/CaJ mice at different ages
C57BL/6J小鼠耳蜗图结果显示,6月龄已经出现外毛细胞缺损,以耳蜗底部为主,即从耳蜗底部沟端开始至距离蜗尖75%区域出现外毛细胞缺损,越往底部越重,最高缺损可达65%,同时从耳蜗底部沟端开始至距离蜗尖85%区域也出现了内毛细胞的缺损,最高缺损程度可达25%。耳蜗顶部出现外毛细胞缺损较少,从蜗尖开始至距离蜗尖15%区域出现外毛细胞缺损,离蜗尖越近外毛细胞的缺损数量越多,最高缺损可达20%,但内毛细胞基本完整(图3a)。12月龄耳蜗底部外、内毛细胞缺损明显加重,从耳蜗底部沟端开始至距离蜗尖50%区域都出现了外毛细胞的缺损,最高缺损程度达到100%,同时从耳蜗底部沟端开始至距离蜗尖70%区域开始出现内毛细胞缺损,最高缺损程度达到55%。与6月龄动物相比,耳蜗顶部外毛细胞缺损变化不大,内毛细胞仍然保持基本完整(图3b)。18月龄动物耳蜗底部外、内毛细胞缺损继续扩大,从耳蜗底部沟端开始至距离蜗尖45%区域均出现外、内毛细胞缺损,外毛细胞缺损形成陡降高峰,其中从耳蜗底部沟端开始至距离蜗尖70%区域,外毛细胞的缺损都达到100%,该区域内毛细胞平均缺损达到50%。耳蜗顶部距离蜗尖30%区域外毛细胞缺损最高可达40%,但顶部内毛细胞基本完整(图3c)。24月龄耳蜗外毛细胞缺损基本覆盖了耳蜗基底膜全程,其中从耳蜗底部沟端开始至距离蜗尖40%区域,相当耳蜗底回和中回外毛细胞缺损达到100%,耳蜗顶部距离蜗尖25%以上区域外毛细胞缺损最高可达80%,距离蜗尖25%至35%区域外毛细胞缺损最轻,但也达到25%。耳蜗底部沟端开始至距离蜗尖45%区域,出现内毛细胞大范围缺损,其中距离蜗尖70%以下区域的内毛细胞缺损程度平均达到90%,但出现在顶回区域的内毛细胞缺损仅占10%(图3d)。C57BL/6J小鼠不同龄全耳蜗铺片顶回、底回毛细胞比较镜下观察举例见图4E1-H2。总之,C57BL/6J小鼠耳蜗毛细胞变化特点是,伴随着年龄的增长,6月龄已出现耳蜗外、内毛细胞缺损,并遵循着外毛细胞损害为主和从耳蜗底部开始,逐渐向中回和顶回扩展的病变规律。
两个不同鼠种不同龄耳蜗外、内毛细胞平均损失占比经χ2检验结果表明(表1),C57BL/6J小鼠从6月龄开始至24月龄,与同龄CBA/CaJ小鼠比较,外、内毛细胞损失差异具有显著性意义(P<0.05),与相同鼠种相邻观察年龄段比较,差异也具有显著性意义(P<0.05)。CBA/CaJ从18月龄至24月龄,与相同鼠种相邻观察年龄段外毛细胞缺损比较,差异具有显著性意义(P<0.05),24月龄内毛细胞与前个年龄段比较差异也具有显著性意义(P<0.05)。
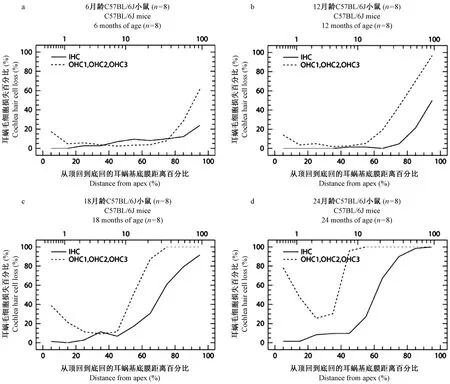
注: IHC:内毛细胞平均曲线。OHC1,OHC2,OHC3:第一、二、 三排外毛细胞平均曲线。图3 C57BL/6J小鼠不同龄全耳蜗毛细胞计数耳蜗图Note. IHC: average curve of inner hair cells. OHC1, OHC2, OHC3:average curve of the first, second and third row of outer hair cells.Figure 3 Chochleograms of whole cochlea hair cells count in the C57BL/6J mice at different ages
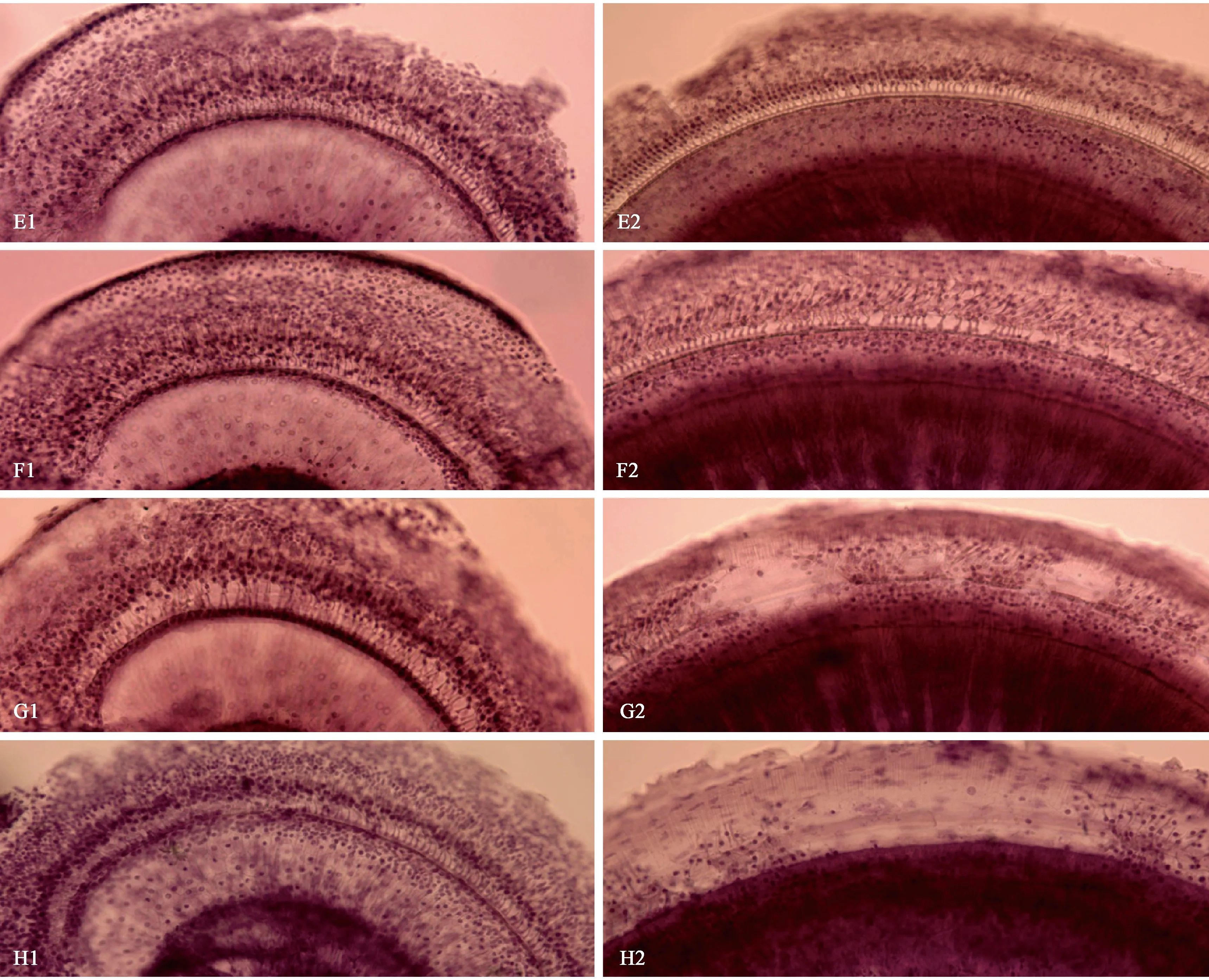
注:E1:6月龄耳蜗基底膜顶回。E2:6月龄耳蜗基底膜底回。F1:12月龄耳蜗基底膜顶回。F2:12月龄耳蜗基底膜底回。 G1:18月龄耳蜗基底膜顶回。G2:18月龄耳蜗基底膜底回。H1:24月龄耳蜗基底膜顶回。H2:24月龄耳蜗基底膜底回。(苏木素染色,×100)图4 C57BL/6J小鼠不同龄耳顶回、底回毛细胞比较镜下观察举例Note. E1,Apical turn of cochlear basement membrane at 6 months of age. E2,Basal turn of cochlear basement membrane at 6 months of age. F1,Apical turn of cochlear basement membrane at 12 months of age. F2,Basal turn of cochlear basement membrane at 12 months of age. G1,Apical turn of cochlear basement membrane at 18 months of age. G2,Basal turn of cochlear basement membrane at 18 months of age. H1,Apical turn of cochlear basement membrane at 24 months of age. H2,Basal turn of cochlear basement membrane at 24 months of age. (Hematoxylin stain,×100)Figure 4 Microscopic comparison of hair cells in cochlear apical turn and basal turn of the C57BL/6J mice at different ages

表1 不同龄CBA/CaJ、C57BL/6J小鼠耳蜗外、内毛细胞平均损失百分比X2检验结果(百分比:%)Table 1 The results of chi-square test for percentage of average loss of outer and inner hair cells in the cochleae of CBA/CaJ and C57BL/6J mice at different ages(Percentage:%)
注: 两个不同鼠种同龄同属细胞比较,*P<0.05。相同鼠种该年龄与上年龄同属细胞比较,△P<0.05。
Note. Comparisons in the same genus cells of two different species at the same age,*P< 0.05. Comparisons between the age and last age in the same genus cells of the same species,△P<0.05.
3 讨论
人类AHL因发病隐匿并呈渐进性发展,病程长,不易观察,一直是临床研究难题,其中如何进行耳蜗细胞形态学临床研究更是研究的瓶颈,因此,如何选择合适的动物模型研究和认识AHL细胞形态学及其发展变化规律,并由此为基础研究分子通路机制、药物干预作用,一直以来成为耳科界探索热点,而观察、研究和比较耳蜗基底膜全程的毛细胞密度则是揭示研究AHL细胞形态学及其发展变化规律的关键,并为寻找合适的实验动物模型提供可参考实验依据。耳蜗图软件可以对全耳蜗毛细胞密度、毛细胞丢失、耳蜗长度进行精准定位定量分析,为全面、完整、正确评估耳聋研究提供了一个重要的研究方法和手段,目前应用耳蜗图对全耳蜗毛细胞定位定量的评估方法已成为国际各权威耳科研究机构普遍采用的常规标准[7-9]。哺乳类动物耳蜗听觉反应的特点是不同频率声波信号在基底膜上不同部位形成最大的振动幅度,从而可以选择性刺激该频率共振特定部位的毛细胞。一般来说,耳蜗底回的毛细胞感应高频声音刺激信号,而耳蜗顶回毛细胞则只对低频声音刺激起反应,由于耳蜗基底膜上不同部位的毛细胞只对特定频率的声音刺激起最大反应,因此沿着耳蜗基底膜的全长便形成了一个重要的耳蜗频率位置对应关系。不同物种动物的耳蜗基底膜长度和听觉频率范围并不相同,例如人类的耳蜗基底膜长度大约在35 mm左右,其可听频率范围一般被认为是从20~20 000 Hz;大鼠的耳蜗基底膜长度大约在9 mm左右,其可听频率范围是从1000~90 000 Hz;小鼠的耳蜗基底膜程度大约在6 mm左右,其可听频率范围是从1000~100 000 Hz。因此,耳蜗基底膜对应不同频率感应区的位置在不同种类的实验动物也不相同。由于实验动物的耳蜗图制备包含着该种类动物的耳蜗基底膜总长度和基底膜上每个不同位点的不同毛细胞密度及其对应的音频反应位置等重要信息,因此耳蜗图成为精准评估各种实验动物全耳蜗毛细胞病理学改变并对应其听觉功能障碍的最可靠研究方法之一[7]。
由于豚鼠寿命长,平均约在5年左右,以豚鼠作为研究老年性内耳损害模型,需要等待若干年直到动物进入老年,因此不易观察和研究。而小鼠生命周期短,尤其是有的特殊基因缺陷型小鼠能够提早发生AHL,因此国际针对AHL研究,更多倾向于采用小鼠AHL模型。研究发现,不同种株近交系小鼠耳蜗毛细胞的退变随着年龄的增长存在着截然不同的病变发生时间和病理学改变进程[7,10]。用于研究AHL动物模型较多的是CBA/CaJ和C57BL/6J小鼠。然而,通过听力学研究表明,在成年早期,CBA/CaJ并没有表现AHL,而C57BL/6J小鼠出现AHL较早,但在后期CBA/CaJ同样也出现AHL[11]。本次通过耳蜗图毛细胞密度、定位定量分析也证实,6月龄C57BL/6J小鼠耳蜗基底部毛细胞已出现损失,但同龄CBA/CaJ小鼠几乎未见变化,至18月龄仅外毛细胞才出现具有统计学意义的时间可比性损失变化,但相较C57BL/6J小鼠,损失不多,而同龄C57BL/6J小鼠耳蜗外毛细胞损失过半,内毛细胞也损失几乎1/3,之后随着年龄老化,CBA/CaJ小鼠耳蜗毛细胞损失迅速增加。这些毛细胞退变和损失变化与前述文献报道的两种小鼠听力学改变一致。两种不同属性小鼠不同时间出现AHL,与它们的基因遗传学密切相关,C57BL/6J小鼠存在隐性等位基因改变,CBA/CaJ小鼠则没有[10]。为了探明C57BL/6J小鼠存在的隐性等位基因改变,通过对C57BL/6J小鼠Sod1(+/+)Cdh23(ahl/ahl)、Sod1(+/+)Cdh23(+/+)、Sod1(-/-)Cdh23(ahl/ahl)、Sod1(-/-)Cdh23(+/+)四种基因型ABR(auditory brainstem-evoked response)听力检测研究发现, Sod1(+/+)Cdh23(+/+)小鼠在15个月龄前仍保持正常听力,其中Sod1(-/-)Cdh23(ahl/ahl)小鼠表现出听力损失最早而且发病最严重,其次是Sod1(+/+)Cdh23(ahl/ahl)、Sod1(-/-)Cdh23(+/+), 由此认为,Cdh23(ahl/ahl)基因缺陷型是导致C57BL/6J小鼠早期即出现AHL病变的主要原因[12-13]。进一步研究显示,C57BL/6J小鼠与CBA/CaJ小鼠不同,在于C57BL/6J隐性Cdh23等位基因(ahl)在纯合子时对AHL的易感性增加,而CBA/CaJ是显性等位基因(Ahl+)则具有对AHL不易感性,通过对3个月、6个月、9个月、12个月、15个月和18个月龄时测量8 kHz、16 kHz和32 kHz纯音刺激的ABR阈值比较,C57BL/6J小鼠32 kHz ABR阈值在6月龄时明显高于CBA/CaJ小鼠,其16 kHz阈值在12个月龄时显著高于CBA/CaJ小鼠。这些结果表明,CBA/CaJ衍生的Cdh23(ahl+)等位基因在其他C57BL/6J遗传背景下可显著减少听力损失和毛细胞死亡,但C57BL/6J小鼠衍生的cdh23(ahl)等位基因对其他CBA/CaJ背景下的听力损失影响不大[14]。最新针对cdh23基因,利用C57BL/6 NJ和129S1/SvImJ胚胎干细胞并使用互联单碱基对替换(B6-Cdh23C.753A>G和129S1-Cdh23C.753G>A),进行同源重组设计小鼠种株,对与许多近交系鼠共同的钙粘蛋白23基因(Cdh23C.753A)的单核苷酸变体(SNV)进行研究,通过检测ABR阈值和耳蜗病理学观察,对这些SNV小鼠同源B6.129S1-Cdh23Ahl+与129S1.B6-Cdh23ahl和亲源(B6N和129S1)进行了比较,结果证实,Cdh23C.753G等位基因对C57BL/6J小鼠至少18个月龄的高频听力损失具有保护作用,而Cdh23C.753A等位基因的AHL诱导作用加重了129S1小鼠的听力损失。两个同源小鼠的ABR阈值不同和互联回交导致差异原因是定位于 Chr 10 QTL。这些结果说明了种株背景和同源区相关听力损失影响与Cdh23C.753等位基因变异有关,即Cdh23C.753A的SNV,可加速AHL,并可恶化其他突变的听觉表型[15]。
综上所述,C57BL/6J小鼠青年时期即可出现与年龄相关的毛细胞损失并由此导致AHL的主要原因是Cdh23基因的缺失,而CBA/CaJ小鼠青年时期尚未出现毛细胞损失并由此导致AHL的主要原因正是因为其具有显性Cdh23基因。因此,CBA/CaJ小鼠所表现出的发生较晚的年龄相关听觉障碍似乎可以被认为是一种天然发生的AHL动物模型。于此不同的是,C57BL/6J小鼠存在着Cdh23ahlAHL等位基因片段的缺失,在这种小鼠身上发生的较早听觉衰退被多数人赞同的看法似乎更像是与遗传基因缺陷有关。以往我们的研究,主要以C57BL/6J小鼠作为AHL动物模型,是利用其早期即出现AHL,便于短期观察的特点[6,16-17]。但C57BL/6J小鼠毕竟属于基因变异种株,相比之下,CBA/CaJ小鼠更接近自然形成的AHL,其导致AHL病理机制与C57BL/6J异同点,有待进一步探讨和揭示。
