Atoh1过表达水平对异位耳蜗毛细胞样细胞的prestin表达及纤毛形态的影响
2020-04-17迟放鲁
郑 宇 马 锐 迟放鲁 △ 赵 萌
(1复旦大学附属眼耳鼻喉科医院耳鼻喉科研究院,2耳鼻喉科,5实验中心 上海 200031;3上海市听觉医学临床中心 上海 200031;4国家卫生健康委员会听觉医学重点实验室 上海 200031)
与低等脊椎动物不同,哺乳动物的耳蜗毛细胞在受损以后无法自发性的再生,这正是导致哺乳动物出现永久性感音神经性聋的关键原因之一。目前认为,通过生物学方式促进耳蜗毛细胞损伤或者缺失之后的功能性再生是实现听觉功能重建的理想方式。
Atoh1,又名math1,在1999年首次被确认是决定毛细胞命运的关键转录因子[1]。Atoh1敲除后,小鼠的内耳毛细胞完全缺失,并且耳蜗毛细胞周围的支持细胞也完全缺失[1-4]。随后相关实验表明,通过质粒或者腺病毒等作为载体的Atoh1过表达可以诱导耳蜗感觉上皮和非感觉上皮的毛细胞再生[5-10]。Pan等[11]通过构建小鼠的“Atoh1表达自我终止”模型表明,Atoh1表达的减少或者自我终止,可以导致在出生后3周内几乎所有的内毛细胞和大部分外毛细胞逐渐丧失,尽管有部分残余毛细胞表达毛细胞标记物myo7a,但这些残余的毛细胞并未分化出正常的纤毛束。另一项研究表明在胚胎发育的第15.5天(E15.5)敲除Atoh1可以导致所有毛细胞的死亡,相比之下,在胚胎发育的第16.5天敲除Atoh1只能导致耳蜗顶圈的毛细胞死亡,但是整个耳蜗毛细胞的表面纤毛形态异常[12]。这些研究表明,毛细胞的生存、分化乃至表面纤毛的发育形态都与Atoh1的表达水平及持续时间相关。
Prestin于2000年首次被确定为耳蜗外毛细胞的运动蛋白,仅在耳蜗的外毛细胞中表达,具有独特的微秒级的机电直接转换能力,它是外毛细胞在收到电刺激时将膜电位的变化转换为胞体的伸缩运动的蛋白分子基础[13-14]。基于马达蛋白prestin的外毛细胞运动对于哺乳动物正常的听觉灵敏度和频率选择性至关重要。据报道,由外毛细胞运动引起的耳蜗放大可使听觉提高40~50 dB[15]。总之,prestin不仅仅是外毛细胞的终末分化标志蛋白之一,更是其充分发挥功能的关键和基础。因此,能否再生出可以表达prestin的毛细胞样细胞是毛细胞再生领域关键的一步。就目前而言,在小上皮嵴区域再生出的异位毛细胞样细胞能否表达prestin蛋白尚不清楚。
本实验主要探究Atoh1过表达水平对耳蜗小上皮嵴区域毛细胞样细胞数量、prestin表达情况及其表面纤毛形态的影响。报告如下。
材料和方法
耳蜗取材及培养将新生第1天(P1)的SD大鼠(上海杰斯捷公司)用CO2麻醉处死,75%乙醇头部消毒后,取出耳蜗组织,解剖方法已有详述[7],之后去除顶回最尖端的1/2圈,去除钩回,将余下的2.5圈分为3段,从顶到底依次为顶段、中段、底段,其中仅取中段基底膜移入培养皿,并按照其原来的弧度,贴在已被多聚赖氨酸包被的小圆玻片上,加入5%FBS培养液,放入培养箱培养(37℃,5%的CO2)24 h后的耳蜗中圈组织的体外培养情况见图1B。
腺病毒感染腺病毒由赛诺公司(中国)合成,含报告基因EGFP(增强的绿色荧光蛋白),实验组使用的腺病毒为Ad5-EGFP-Atoh1,EGFP作为Atoh1的上游基因,其表达的绿色荧光蛋白信号强度可以间接反映Atoh1的过表达水平。对照组转染用的腺病毒为Ad5-EGFP(简称G)。我们先将原先的5%FBS培养液全部更换为B27培养液,并加入Ad5-EGFP-Atoh1(简称GA),使其工作浓度为0.1×108和0.4×108PFU/mL,部分实验增加一组0.2×108PFU/mL,对照组加入 0.4×108PFU/mL的 Ad5-EGFP。放入培养箱中孵育16~20 h,之后全量更换为新鲜的B27培养液继续培养,以加入病毒的时间点开始计时,加入病毒后的第24 h称为DVI 1,以此类推,依次为 DVI 2,DVI 3......。
免疫荧光染色培养组织取出后用4%的多聚甲醛(美国Sigma-Aldrich公司)室温固定2 h,0.1%Triton X-100(溶于PBS)通透30 min后,用10%驴血清封闭液(溶于0.1%Triton X-100,美国Merkmilli Pore公司)室温孵育1 h,然后加一抗4°C冰箱过夜,第二天用0.1%Triton X-100的1×PBS(PBST)漂洗标本3次及以上,每次至少2 h,加二抗,室温孵育2 h,漂洗标本,封片。本实验中用到的一抗:Myosin VIIa(鼠来源抗体,1∶200,美国 Proteus Biosciences 公司),prestin(兔来源抗体,1∶200,美国 Santa Cruz公司)。二抗:驴抗鼠-Cy5(1∶1 000)和驴抗兔—Rho(1∶1 000),均来源于美国Jackson免疫研究实验室。共聚焦扫描显微镜(Leica-SP8)用于免疫荧光染色标本的扫描。其中培养组织块免疫荧光染色无需切片,每个时间点每个浓度下对照组取半只到1只SD新生大鼠(即1~2个耳蜗中圈组织)用于免疫荧光染色,而实验组则至少取3只SD新生大鼠(即6个耳蜗中圈组织)用于免疫染色及后续的计数统计。
RNA的提取和qRT-PCR每个时间点每个浓度取12个体外培养组织(即6只SD新生大鼠)进行RNA的纯化提取,之后拟转录合成DNA,具体步骤已有详述[16],PCR 引物设计(5'-3')如下:GAPDH,AGT GCC AGC CTC GTC TCA TA(Forward);TGA ACT TGC CGT GGG TAG AG(Reverse);Atoh1,TCATCGTCCCATAGTCCGTG(Forward);TCC CTT ACG AGT GAG TGA GC(Reverse)。
扫描电镜取不同浓度下培养后第9天的样本(实验组每个浓度下取2只SD新生大鼠,而对照组只取1只)用PBS冲洗3次,2.5%戊二醛(使用0.1 mol/L PB配制)固定标本,4℃冰箱过夜。之后0.1 mol/L PB漂洗10 min×3次;2%单宁酸常温孵育30 min;0.1 mol/L PB漂洗10 min×3次;1%锇酸固定液,室温 2 h,0.1 mol/L PB 漂洗 10 min×3次,30%、50%、60%、70%乙醇脱水各15 min,70%乙醇4℃过夜,之后80%、90%乙醇脱水各15 min,最后用100%的乙醇(无水乙酸钠处理)脱水2次,每次15 min。临界点干燥,喷金。扫描电镜Topcon DS-130F行样本扫描,电压10 kV。
统计学分析随机选取长度为200 μm且平行于耳蜗长轴的小上皮嵴区域进行观察,每组(每个时间点下的每一个浓度)至少选取5段中圈耳蜗,每段基底膜选取10处进行计数,选取Myosin7a/EGFP双阳性细胞作为异位毛细胞样细胞。使用SPSS 22软件对数据进行处理,本实验的计数统计比较采用的t检验,若t检验不满足,则使用ranksum秩和检验,比例的比较采用χ2检验,P<0.05为差异有统计学意义。Graphpad Prism7绘制柱状图。
结 果
带有Atoh1基因的腺病毒转染浓度与培养组织的Atoh1 mRNA表达水平成正相关在腺病毒转染后第3天,qRT-PCR结果显示在转染了带有Atoh1基因的腺病毒(实验组)中,0.4×108PFU/mL组体外培养组织Atoh1的mRNA表达水平要明显高于0.1×108PFU/mL组(P<0.01)。此外,实验组中0.1×108PFU/mL组的Atoh1 mRNA表达水平亦要高于对照组(P<0.01)。在腺病毒转染第5天和第7天,实验组中0.4×108PFU/mL组的Atoh1 mRNA表达水平均明显高于0.1×108PFU/mL组(P<0.01,P<0.05),结果提示通过提高带有Atoh1基因的腺病毒浓度,可以提高培养组织的Atoh1 mRNA表达水平(图1A)。另外在实验组中,病毒浓度的越高,小上皮嵴区的绿色荧光蛋白信号越强,提示Atoh1的过表达水平越高(图2 E、F、G)。
Atoh1过表达水平对能够表达prestin的异位毛细胞样细胞数量的影响实验组所采用的转染浓度即 0.1×108PFU/mL、0.2×108PFU/mL、0.4×108PFU/mL均能在小上皮嵴再生出异位毛细胞样细胞,在病毒转染后第 5天(DVI5)、第7天(DVI7)及第9天(DVI9)实验组的腺病毒浓度越高,再生的异位毛细胞样细胞(myo7a阳性)数量越多(图3,5 d:4.50±1.66vs.12.55±3.51,26.35±4.96;7 d:8.50+1.24vs.22.05±1.91,36.57±10.19;9 d:18.59±5.77vs.41.36±13.75,60.19+14.70),而对照组小上皮嵴无异位毛细胞样细胞出现。此外无论是实验组还是对照组,体外培养下的原位外毛细胞的prestin均于病毒转染后第7天开始出现表达(图2)。
在实验组中,不同病毒转染条件下,异位毛细胞样细胞也均在病毒转染后第7天开始表达prestin。在病毒转染后第9天,实验组中腺病毒浓度越高,异位毛细胞样细胞中能够表达prestin的细胞数量也越多,差异具有统计学意义(图4,9 d:1.50+1.41vs.3.82±3.47,5.43±2.54),但是小上皮嵴区域所有新生毛细胞中能够表达prestin的新生毛细胞所占的比例,在不同浓度组差异无统计学意义(图5,9 d:8.77%±8.28%vs.8.50%±6.43%,9.76%±5.29%)。
Atoh1过表达水平影响异位毛细胞样细胞表面纤毛形态对照组腺病毒(不含Atoh1基因)转染后第9天,体外培养组织的小上皮嵴区域呈扁平状,细胞表面轮廓为多边形,无纤毛出现(图6A),其原位区域毛细胞的表面纤毛基本正常。在实验组腺病毒(含Atoh1基因)低浓度转染后第9天,体外培养组织的小上皮嵴区域出现不规则的纤毛,突出于细胞表面(图6B)。在实验组腺病毒(含Atoh1基因)高浓度转染后第9天,体外培养组织的小上皮嵴区域出现形态较为规则的纤毛,静纤毛长度从低到高排列,纤毛间可以见侧连接和顶连接(图6C)
讨 论
自Atoh1在1999年被确认是决定毛细胞命运的关键因子之后,许多研究者以Atoh1为目的基因,研究其在毛细胞发育和再生中的作用[8-10,17-19]。目前已经证实,以腺病毒为载体介导的Atoh1过表达可在体内和体外实验中诱导异位毛细胞样细胞的形成[5-6,8-10,19]。本实验同样以腺病毒为载体,通过腺病毒携带Atoh1基因来转染出生后第1天(P1)的SD大鼠的耳蜗基底膜中圈体外培养组织。在2012年,Pan等[11]通过构建“Atoh1表达自我终止”的体内模型来研究Atoh1表达水平及作用时间对毛细胞发育的影响。该模型通过在Atoh1基因两端插入loxp位点,在Atoh1基因表达以后,激活Atoh1的cre重组酶,从而达到Atoh1基因自我敲除的目的。本实验则采用不同浓度的腺病毒分别进行转染,并证实了通过提高带有Atoh1基因的腺病毒浓度,可以提高培养组织小上皮嵴区域Atoh1 mRNA的表达水平。此外,我们还发现实验组的病毒浓度越高,小上皮嵴区的绿色荧光蛋白信号越强,由于报告基因EGFP位于Atoh1基因的下游,其表达水平可间接反映Atoh1的过表达水平,因此该结果可提示病毒浓度的越高,Atoh1的过表达水平越高。

图2 不同Atoh1过表达水平下原位毛细胞和异位毛细胞样细胞的prestin表达情况Fig 2 Expression of prestin in hair cells and ectopic hair-cell-like cells under different Atoh1 over-expression level
通过调控腺病毒的浓度来引导Atoh1在小上皮嵴区域不同水平的过表达,我们发现病毒浓度越高,随着培养时间的延长,小上皮嵴区域的异位毛细胞样细胞数量越多,这一结果与之前的一项研究相吻合[5]。此外,在实验组的3个浓度下,异位毛细胞样细胞均于病毒转染后第7天开始表达prestin,在病毒转染后第9天,表达prestin的异位毛细胞样细胞数量显著增多,并且病毒浓度越高,表达prestin的异位毛细胞样细胞数量越多,差异具有统计学意义。但是实验组在3个不同浓度的条件下,能够表达prestin的异位毛细胞样细胞的比例却并无统计学差异。因此,Atoh1过表达水平与诱导生成的prestin+异位耳蜗毛细胞样细胞绝对数量正相关,其相关性很大程度上可能来源于myosin7a阳性细胞绝对数量的增加,而非Atoh1本身过表达的增加导致prestin表达的提高。虽然目前已经确定Atoh1是耳蜗毛细胞分化的必要基因,但对于耳蜗毛细胞是如何进一步分化成内毛细胞和外毛细胞,或者说是否还有其他因子导致了耳蜗毛细胞的进一步分化目前尚不明朗。考虑到原位的外毛细胞全部都能表达prestin,而本研究中能够表达prestin的异位毛细胞样细胞的比例较低,因此我们推测除了Atoh1以外可能还有其他下游基因参与,促进毛细胞前体细胞向外毛细胞分化。
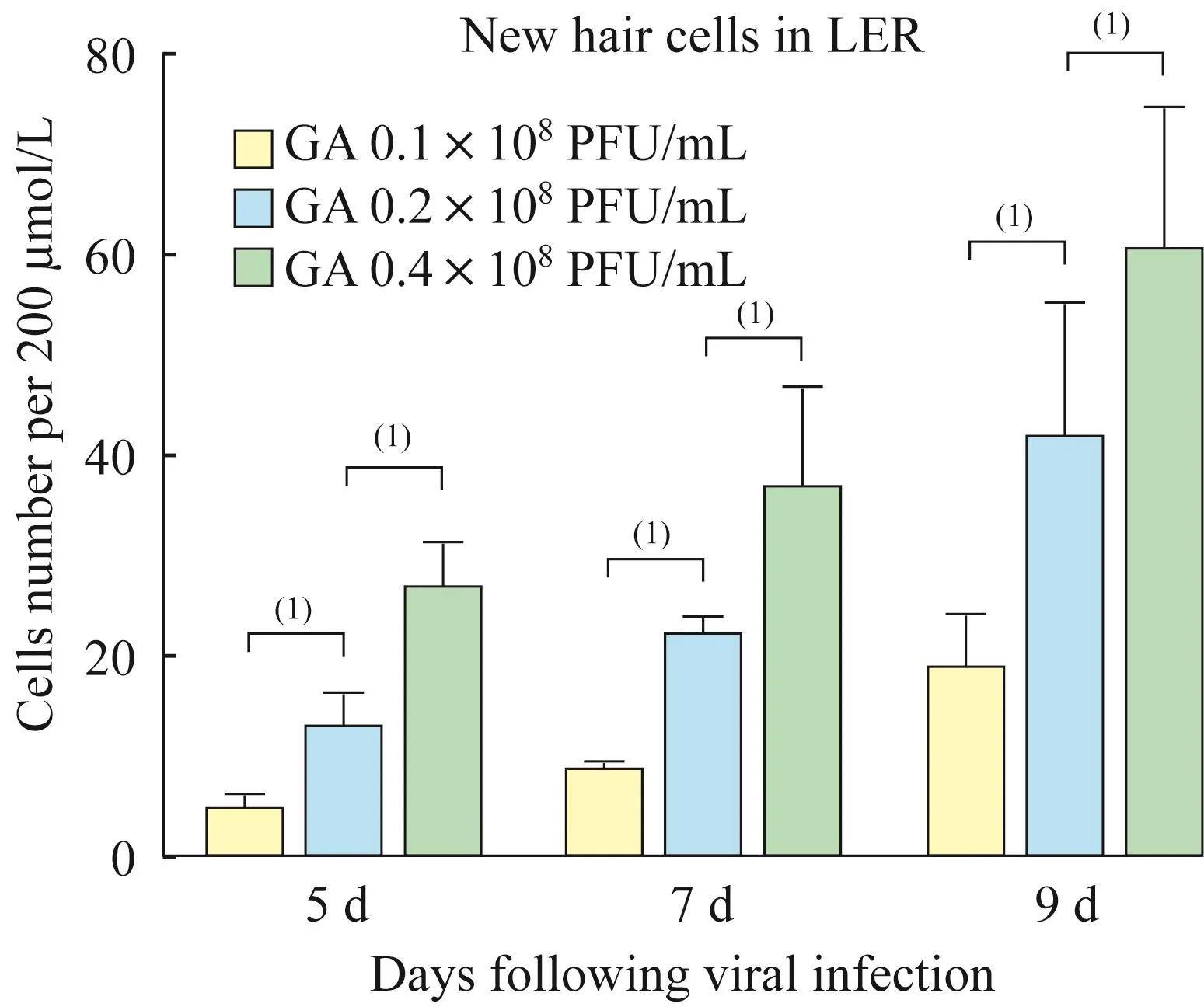
图3 不同Atoh1过表达水平诱导的异位毛细胞样细胞数量比较Fig 3 Comparison of the number of ectopic hair-cell-like cells induced by different Atoh1 over-expression level
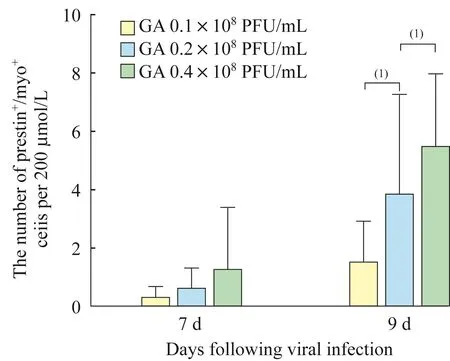
图4 不同Atoh1过表达水平诱导能够表达prestin的异位毛细胞样细胞数量比较Fig 4 Comparison of the number of ectopic hair-cell-like cells induced by different Atoh1 over-expression level that expressed prestin
之前曾有极个别的研究者在原位区域再生出了能够表达prestin的新生毛细胞,但是在小上皮区域目前尚无人证实新生的毛细胞能够表达prestin。因此,本实验首次证实在小上皮嵴区域能够再生出表达prestin的新生毛细胞,并研究了其与Atoh1过表达水平的关系。
除了研究异位毛细胞样细胞在小上皮嵴是否能够表达prestin外,我们还发现无论是对照组还是实验组,P1SD大鼠中圈的基底膜原位区域外毛细胞的prestin表达均于病毒转染后第7天开始。考虑到组织培养的孵育时间,SD大鼠基底膜中圈的外毛细胞相当于在体内的第8天(p8)开始表达prestin。Hang等[20]曾经研究过体内 SD 大鼠的 prestin表达情况,发现SD大鼠底圈、中圈、顶圈的外毛细胞分别于第6天、第7天和第9天开始表达prestin。我们的结果与其相差了仅仅一天,其中一个可能的原因是由于体内外环境差异造成的。但是,考虑prestin的表达是从底圈开始最后到顶圈,更加合理的解释应该是:该实验所表述的第7天是指中圈靠近中底圈的外毛细胞表达prestin,而本实验病毒转染后的第7天(p7)是指中圈靠近中顶圈的外毛细胞表达了prestin,因此我们认为两个实验的结果是相一致的。
此外,本文实验组采用一高一低的病毒浓度,并于病毒转染后第9天进行扫描电镜观察,我们发现实验组腺病毒转染9天后,高浓度转染时,部分再生毛细胞表面静纤毛由低到高排列,纤毛形态规则,形成类V字型结构,类似于耳蜗毛细胞单个细胞的极性形成;低浓度转染时,再生毛细胞的纤毛未找到规则的形态,提示Atoh1过表达的水平越高,异位毛细胞样细胞表面的纤毛相对越规则,越易促使新生毛细胞静纤毛束极性的形成。因此本研究提示,在再生过程中足量的Atoh1过表达水平对于异位毛细胞样细胞表面形成相对正常的纤毛具有重要作用。
总之,通过本实验我们发现通过提高带有Atoh1基因的腺病毒浓度,可以提高培养组织的Atoh1过表达水平,并且本实验首次证实了小上皮嵴区域再生的毛细胞样细胞出能够表达prestin,并研究了其与Atoh1过表达水平的关系,我们发现Atoh1在小上皮嵴的过表达水平越高,诱导生成的异位毛细胞样细胞数量越多,表达prestin的新生毛细胞数量亦越多,当然这些能够表达prestin的异位毛细胞样细胞是否具有像外毛细胞一样的伸缩功能,或其非线性膜电容的特性都值得进一步研究。此外,我们还发现Atoh1过表达的水平越高,异位毛细胞样细胞表面的纤毛越相对规则,单细胞的纤毛极性越易形成。考虑到毛细胞静纤毛的极性排列对于毛细胞的机械-电转换功能过程具有重要的意义,因此我们认为Atoh1的过表达水平与新生毛细胞是否具备机械-电转换功能也可能有一定的相关性。
