三种早发性卵巢功能不全小鼠造模方法的比较研究
2020-01-01苏先芝刘一斐孔文娟闫菲王晓梅韩福国刘清飞史云
苏先芝,刘一斐,孔文娟,闫菲,王晓梅,韩福国,刘清飞*,史云,
(1. 北京中医药大学第一临床医学院,北京 100029; 2. 清华大学药学院,北京 100084; 3. 北京中医药大学东直门医院,北京 100700)
早发性卵巢功能不全(premature ovarian insufficiency, POI),是指40岁之前出现卵巢功能减退,主要表现为月经异常(闭经、月经稀发或频发)、促性腺激素水平升高(FSH>25 IU/L)和雌激素水平波动性下降[1]。由于卵巢功能的减退导致女性生育力的丧失和低雌激素状态,POI已成为影响女性生殖健康和社会稳定性的不可忽视的因素,因此对POI的病因学和诊疗的研究日益受到重视。POI的病因和病理机制尚不明确,自身免疫、遗传、环境、药物和应激因素等都可能引起卵巢功能的减退。目前临床缺乏疗效确切的药物,原因之一就在于建立适宜的POI动物模型存在一定的困难。目前POI的动物模型的制备主要依据不同的发病机制,有化疗药物造模法、半乳糖代谢造模法、化学损伤物质造模法、基因敲除造模法等[2],本文针对目前常用的三种造模方法:雷公藤造模法、化学物质二氧化乙烯基环己烯(4-vinylcyclohexenediepoxide,VCD)造模法、半乳糖代谢造模法进行对比性研究,力求找到更理想的POI动物模型,为临床和实验研究提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雌性ICR小鼠100只,8周龄,体重(28±3)g,购于北京维通利华实验技术有限公司【SCXK(京)2016-0011】,饲养和取材均于北京中医药大学教育部中医内科学重点实验室屏障动物实验设施内进行【SYXK (京) 2015-0001】,实验经过北京中医药大学东直门医院实验动物福利与伦理委员会批准(编号:17-23)。小鼠分笼饲养,实验室温度(20±4)℃,相对湿度60%~70%,光照和黑暗12 h更替,自由进食及饮水。
1.1.2 试剂与仪器
雷公藤多苷片(湖南千金协力药业,20160502),二氧化乙烯环己烯(Sigma,BCBV1352,美国)。芝麻油(Spectrum,2GC0155,美国)。D-(+)-半乳糖(Sigma,WXBC4726 V,美国)。血清促卵泡生成素(FSH)、促黄体生成素(LH)、雌二醇(E2)、抗苗勒管激素(AMH)酶联免疫吸附测定(ELISA)试剂盒(北京易科拜德科技有限公司)。本实验所及仪器均为实验室常规仪器。
1.2 方法
1.2.1 动物分组
适应性喂养3 d后,每日早8:00起对小鼠进行阴道脱落细胞学检测,连续10 d光镜下观察,筛选出有规律动情周期的健康雌性小鼠96只进入正式实验。按随机数字表法随机分为4组:对照组、雷公藤多苷片组(tripterygium glycosides, TG)、VCD组和半乳糖组(D-(+)-galactose, D-gal),每组24只。干预当天设为0 d,干预后第16、46和76天处死随机处死各组8只小鼠,分别设为各组的I、II和III亚组。取血并处死,取小鼠双侧子宫和卵巢,生理盐水清洗后擦干,称重,分组置于4%多聚甲醛中固定。
1.2.2 POI模型的建立
TG组以雷公藤多苷片混悬液按50 mg/(kg·d)灌胃,连续15 d。VCD组以VCD溶液按160 mg/(kg·d)剂量腹腔注射,连续15 d。半乳糖组以半乳糖溶液按500 mg/(kg·d)剂量颈背部皮下注射,连续75 d。
1.2.3 观测指标
(一)造模前后一般情况观察
观察并记录动物皮毛、活动情况、进食、大小便和体重等改变,若有动物死亡,记录死亡数量及原因。
(二)动情周期观察
自干预日起,各组小鼠每日8:00起进行阴道涂片,观察动情周期。取细棉签蘸取0.9%生理盐水后,在小鼠阴道内轻轻旋转一周,在玻片上轻轻滚动,使分泌物均匀地涂布于玻片上,于光学显微镜下直接观察小鼠动情周期变化。观察标准:①动情前期:椭圆形有核上皮细胞占大多数,偶有少量角化细胞和白细胞;②动情期:片状无核角化上皮细胞占绝大多数或间有少量有核上皮细胞和白细胞;③动情后期:白细胞、片状角化上皮细胞、有核上皮细胞均有,且比例无明显差异;④动情间期:有大量白细胞及少量粘液[3]。
(三)血清性激素水平
血液标本于血清管(VACUETTE,#D1703343)中静置1 h后,以4200 r/min离心15 min,取上清液,严格按照试剂盒操作,ELISA法测定血清FSH、LH、E2、AMH水平。
(四)子宫、卵巢指数测定
取双侧子宫和卵巢,剔除脂肪组织后称重,按以下公式计算子宫指数和卵巢指数:卵巢指数=卵巢湿重(mg)/体重(g)×100%;子宫指数=子宫湿重(mg)/体重(g)×100%。
(五)卵巢、子宫组织学观察
称重后将卵巢、子宫分组浸入4%多聚甲醛中固定,常规石蜡切片与HE染色,在光学显微镜下阅片,计数卵巢中各级卵泡和黄体的数量,测量子宫内膜和子宫肌壁厚度。
1.3 统计学分析

2 结果
2.1 一般情况观察
各造模组小鼠在干预期间均出现不同程度的一过性活动减少、摄食减少、皮毛光泽度下降等变化,体重无明显下降;干预结束后,雷公藤组小鼠活动和摄食逐渐恢复,皮毛光泽度亦于第46天时恢复正常,VCD组小鼠皮毛光泽度仍较差。对照组小鼠食欲、皮毛、活动度等均较干预前无明显变化。
2.2 小鼠动情周期变化
对照组小鼠均有规律的动情周期,表现为6~7 d出现一次规律动情周期。干预当天记为0 d,与每组结果比较。结果见图1。
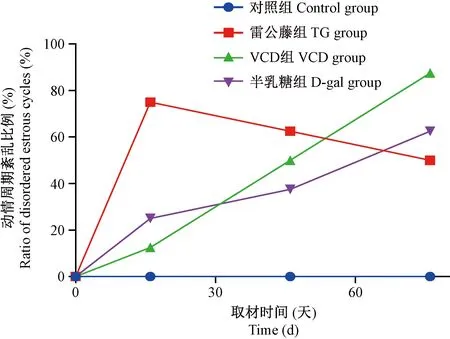
图1 小鼠动情周期紊乱比例(%)Figure 1 Ratio of disordered estrous cycle(%)
2.3 血清性激素水平变化
干预后第16天,各组E2值较对照组均下降,有十分显著性差异(P<0.01),雷公藤组和VCD组AMH均明显下降,VCD组FSH值及FSH/LH比值升高半乳糖组AMH值降低,差异均有显著性(P<0.05)。第46天,雷公藤组、VCD组E2值较对照组仍明显降低,差异有显著性(P<0.05);VCD组AMH值较第16天及同期对照组降低,差异有显著性(P<0.05);半乳糖组与同期对照组相比,E2值降低,差异十分显著(P<0.01),AMH值明显降低(P<0.05)。第76天,雷公藤组E2值较对照组仍降低(P<0.05),其余各值均无显著差异;VCD组AMH、LH、E2值较对照组降低,FSH/LH比值升高,均有显著性差异(P<0.05);半乳糖组AMH、E2值较对照组降低,有显著性差异(P<0.05,P<0.01)。雷公藤组小鼠AMH值在第76天时较第16天时显著升高(P<0.01),VCD组和半乳糖组小鼠E2水平持续性降低,较前有显著性差异(P<0.05)。结果见图2。
2.4 卵巢、子宫湿重指数
小鼠给药前称重,各组小鼠体重差异无显著性。第16天,雷公藤组小鼠体重明显减轻, VCD组卵巢湿重、卵巢指数均明显减少,半乳糖组卵巢指数明显减少,差异均有显著性(P<0.05);第46天,半乳糖组卵巢湿重、卵巢指数均较同期空白对照组明显减少,差异有显著性(P<0.05)。第76天各组卵巢指数无显著性差异(P>0.05)。各组子宫指数与同期空白对照组相比均未产生显著性差异(P>0.05)。结果见表1。
2.5 卵巢与子宫组织结构变化
2.5.1 卵泡计数及子宫厚度测量
第16天,雷公藤组发育中卵泡数、成熟卵泡数、子宫内膜厚度较对照组减少,VCD组子宫肌壁厚度明显减小,半乳糖组子宫内膜厚度明显减小,差异均有显著性(P<0.05,P<0.01);第46天,雷公藤组、VCD组、半乳糖组发育中卵泡数、黄体数较对照组明显减少,差异有显著性(P<0.01,P<0.05);第76天,VCD组成熟卵泡数、子宫内膜厚度、子宫肌壁厚度较对照组均明显减小,半乳糖组子宫内膜厚度明显减小,差异均有显著性,(P<0.05,P<0.01)。结果见图3。
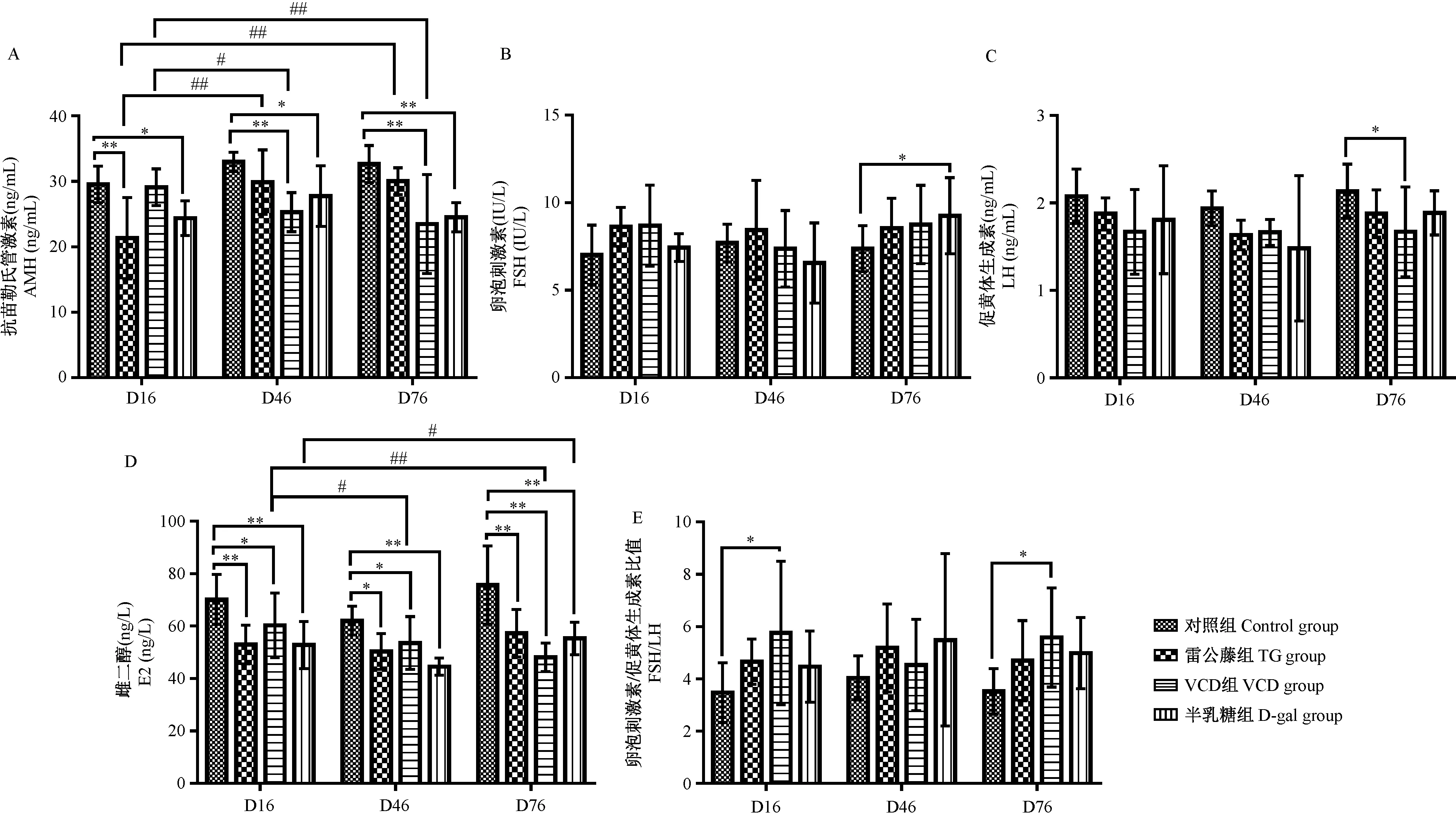
注:与同期空白对照组相比,*P<0.05;与同期空白对照组相比,**P<0.01;与同组第16天相比,#P<0.05;与同组第16天比较,##P<0.01。图2 三种早发性卵巢功能不全小鼠模型的血清性激素比较Note. Compared with the control group at the same period, *P<0.05. Compared with the control group at the same period, **P<0.01. Compared with the same treatment group at day 16, #P <0.05. Compared with the same treatment group at day 16, ##P <0.01.Figure 2 Comparison of the changes of serum hormone levels in the three POI mouse models with premature ovarian dysfunction

表1 三种POI小鼠模型的体重和卵巢、子宫指数变化Table 1 Changes of ovarian and uterine indexes in the three mouse models of premature ovarian dysfunction s)
注:与同期对照组相比,*P<0.05。
Note. Compared with the control group at the same period,*P<0.05.

注:与同期空白对照组相比,*P<0.05;与同期空白对照组相比,**P<0.01;与同组第16天相比,#P<0.05; 与同组第16天比较,##P<0.01。图3 三种早发性卵巢功能不全小鼠模型的卵泡计数及子宫厚度测量Note. Compared with the control group at the same period, *P<0.05. Compared with the control group at the same period, **P<0.01. Compared with the same treatment group at day 16, #P<0.05. Compared with the same treatment group at day 16, ##P<0.01.Figure 3 Ovarian follicle counts and uterine wall thickness measurements in the three mouse POI models
2.5.2 卵巢、子宫形态学观察
对照组小鼠卵巢表现为体积大,皮质区可见各阶段的卵泡,包括发育中的卵泡(初级卵泡、次级卵泡)、成熟卵泡和黄体相间分布,在位子宫内膜无明显增厚或变薄,腺体无扩张或萎缩。与对照组相比,雷公藤组第16天和第46天各级卵泡及黄体所占比例下降,子宫内膜变薄,腺体萎缩,但这一现象在第76天时较前恢复;VCD组发育中的卵泡和黄体所占比例明显下降,腺体和间质萎缩,子宫内膜上皮呈低柱状或立方状,子宫内膜和子宫肌壁变薄,并与时间呈反比;半乳糖组发育中的卵泡和黄体所占比例逐渐下降,子宫内膜厚度变薄。结果见图4、图5。
3 讨论
疾病动物模型的最终目的在于能够解析疾病发生的生理病理机制和服务于疾病预防和治疗药物的研发两个方面[4]。然而POI的发病机制尚不明确,制备理想的动物模型有很多难点,包括致病途径及过程与人类相似,患病后的病理结果与人类一致,模型的自我修复可能,是否具有可重复性等。根据病因的不同,目前有多种方式可以造成POI的动物模型,如雷公藤多苷片造模法、半乳糖代谢造模法、环境化学物质造模法、化疗药物造模法等[5]。
本文选取了目前应用较多也较具代表性的雷公藤多苷片灌胃造模法、VCD溶液腹腔注射造模法和半乳糖溶液皮下注射造模法进入研究,主要针对药物性、环境性和代谢性POI作为研究对象。雷公藤多苷提取自传统中药雷公藤,临床发现雷公藤多苷会导致卵巢功能减退和衰竭,高慧等[6]用雷公藤多苷片给12周龄SD大鼠连续灌胃14 d后,建立较为理想的POI动物模型,然而梁爽等[7]的研究发现,雷公藤致POI动物模型中,停药10 d后,卵巢功能可自然修复。半乳糖血证与POI发病相关,由于半乳糖在体内堆积可导致卵母细胞的过早耗竭,女性卵巢功能对半乳糖血证异常敏感[8],患半乳糖血证的妇女POI的发病率很高[9]。Bandyopadhyay等[10]通过给怀孕雌鼠饲料中添加半乳糖成功建立POI动物模型。然而半乳糖血证导致的POI临床病例很少,缺乏实际研究意义。工业化学品VCD是制造杀虫剂、灭火剂、橡胶、塑料等的副产品[11],可以选择性地损伤雌鼠和灵长类动物卵巢储备池中的原始卵泡及初级卵泡,加速卵泡凋亡,诱导卵巢功能逐步衰竭[12-13],可较好地模拟自然状态下卵巢功能衰竭的进程[14]。有文献报道,连续腹腔注射160 mg/(kg·d)VCD 15 d,待停止注射后(70±5)d时,啮齿类动物的卵巢接近POI的临床特征[12, 15]。

图4 各组卵巢病理图片(HE染色)Figure 4 Pathological changes of the mouse ovarian tissues(HE staining)

图5 各组子宫病理图片Figure 5 Pathological changes of mouse uterine tissues(HE staining)
本研究发现,雷公藤组小鼠在第16天时出现体重减轻,多数动物出现动情周期紊乱,AMH和E2值显著降低,发育中卵泡数和成熟卵泡数减少,子宫内膜变薄,提示雷公藤多苷片造模法15 d确可造成小鼠卵巢功能的减退。第46天时小鼠体重恢复,E2值仍降低,发育中卵泡数和黄体数显著减少,提示停药1个月后,雷公藤多苷片对卵巢功能的损害仍然存在。但第46天时,除E2值仍持续偏低外,雷公藤组小鼠体重、血清性激素值及卵巢、子宫组织结构均与同期空白对照组无显著差异,表明雷公藤混悬液灌胃15 d即能造成小鼠生殖功能的损伤,出现体重下降、动情周期紊乱、卵巢组织病理学变化等现象,但停药1~2个月左右,小鼠动情周期即逐渐恢复,其他各指标逐渐恢复到正常水平,这与文献表述一致[7]。由此说明采用雷公藤多苷造模研究治疗POI药效学方法尚需要探讨。
半乳糖组小鼠在第16天时出现卵巢指数减低,AMH和E2值均减低,子宫内膜厚度减小,提示半乳糖造模法确实能够对卵巢功能造成损害,第46天时E2仍持续减低,发育中的卵泡数、黄体数减低,提示给药46 d后,卵巢功能仍处于损害中。第76天时AMH和E2值减低,子宫内膜厚度减小,半数以上动物出现动情周期紊乱,提示给药75 d后卵巢功能仍在逐步下降,表明半乳糖造模法也是制备POI小鼠模型的较理想造模方法。但与VCD造模相比,半乳糖制造POI模型具有造模时间长,成模率不高(62.5%)等缺点,其造模方法仍需商榷。
VCD组小鼠在第16天时出现卵巢湿重及卵巢指数减低,AMH和E2值显著降低减低,FSH值和FSH/LH升高,提示VCD造模法给药15 d后,已经对卵巢功能造成了损害,但尚未引起动情周期紊乱等表现。第46天时小鼠体重、血清性激素与前无差异,发育中的卵泡数和黄体数较前进一步减少,提示停药1个月后,VCD对卵巢功能的损害持续存在。第76天时小鼠AMH、LH、E2仍明显降低,FSH/LH比值升高,绝大多数小鼠出现动情周期紊乱,发育中卵泡数、成熟卵泡数均减少,子宫内膜和子宫肌壁厚度均减小,提示停药2个月后,VCD对卵巢功能仍产生持久损害,引起POI的临床征象,且这种影响并未发现自然修复,可能对卵巢功能造成不可逆的损伤,表明VCD造模法效果确切,是制备POI小鼠模型的良好造模方法。
环境内分泌干扰物(endocrine-disrupting chemicals, EDCs)可影响机体的激素分泌,长期暴露于EDCs可引起青春期提前、生育力降低、妊娠期并发症发生率增加及绝经期提前等[16-17],是诱发女性POI的因素之一[18]。VCD是VCH(4-vinylcyclohexene)的代谢产物,VCH产生于香烟、矿物或塑料燃烧氧化过程中,可由吸烟、接触农药等方式进入人体,是诱发POI的重要因素之一[19-20]。良好的POI模型应包含以下几个因素:(1)动情周期的改变;(2)血清雌激素明显降低;(3)卵泡数显著减少;(4)生育试验证实产仔数明显减少[21]。综上可见,VCD溶液腹腔注射法致POI造模法致病途径及过程与人类相似,动物卵巢和子宫病理结果与人类一致(如卵巢萎缩,各级卵泡减少,子宫内膜和子宫肌壁厚度减小等),动情周期明显改变,血清雌激素明显降低,卵泡数显著减少,未观察到自然修复。因此,本实验证实化学毒性物质VCD能诱导小鼠卵巢功能减退,模拟POI的病理过程,在三种造模方法中最为优选,可作为探讨POI发病机理和用药研究的动物模型。
