紫苏籽提取物在ApoE-/-小鼠中的抗动脉粥样硬化和心脏保护作用
2020-01-01郑双谭伟江李想马俊峰任学聪郑凌云王丽京杨丰华黄韧
郑双,谭伟江,李想,马俊峰,任学聪,郑凌云,王丽京,杨丰华*,黄韧*
(1. 广东药科大学,生命科学与生物制药学院,血管生物学研究所,广州 510006; 2. 广东省实验动物监测所,广东省实验动物重点实验室,广州 510633)
高胆固醇血症是心血管疾病的主要原因,与全球死亡率增加密切相关。研究表明,高胆固醇血症可诱发左心室质量增加和心脏病理性重构[1-3],其为不可逆转的疾病,最终转归为心脏收缩功能损伤和心衰[4]。有研究表明其与能量生成障碍[5]和肌丝收缩调控相关[6]。
紫苏籽油性提取物(PSO)含有丰富的α-亚麻酸(ALA)[7]。ALA为n-3多不饱和脂肪酸的一种,流行病学研究显示从饮食中摄入的ALA具有显著的心脏保护作用[8-9]。目前少有研究探索PSO对高胆固醇血症患者心脏功能的影响,探究PSO对心脏的保护和作用机制具有重要意义。
载脂蛋白E敲除(ApoE-/-)小鼠具有高胆固醇水平,可发展类似于人类的动脉粥样硬化病变[10],另外有报道ApoE-/-小鼠心脏出现肥大性重构[11-12]、纤维化[13]和功能障碍[14],是一个适宜用于药物治疗研究的模型。本研究旨在利用ApoE-/-小鼠探索PSO在抗动脉粥样硬化和保护心脏功能的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
40只3月龄ApoE-/-雄性小鼠(B6背景),体重20~25 g,广东药科大学合作实验室馈赠;10只3月龄B6雄性小鼠体重20~25 g,购于广东省医学实验动物中心【SCXK (粤) 2013-0002】,所有小鼠均饲养于广东省实验动物监测所SPF环境中【SYXK(粤)2016-0122】,温度:22℃~25℃,湿度:50%~70%,昼夜明暗交替时间为12 h/12 h。所有操作符合广东省实验动物监测所动物保护和使用委员会(IACUC)的要求。
1.1.2 试剂与仪器
阿托伐他汀(浙江新东港药业,中国),羧甲基纤维素钠(阿拉丁,美国),甲醇(阿拉丁,美国),ATP测试盒(南京建成,中国),Takara试剂盒(Takara,日本),引物(生工,中国),Triton X-100(Sigma,美国),Pro-Q Diamond磷酸化蛋白凝胶染色试剂(赛默飞,美国),气相色谱(安捷伦GC-7820A,美国),全自动生化分析仪(日立7080型,日本),Vevo2100高分辨率超声系统(Visual Sonics,加拿大)。
1.2 方法
1.2.1 实验分组
PSO成人剂量为每人4.5 g/d,小鼠剂量按体表面积折算,约为1000 mg/(kg·d),经预实验确定使用剂量。将ApoE-/-小鼠随机分为4组,分别为ApoE-/-:0.5%羧甲基纤维素钠;ApoE-/-+ 0.5 g/kg PSO:0.5 g/(kg·d) PSO;ApoE-/-+ 1.0 g/kg PSO:1.0 g/(kg·d) PSO;ApoE-/-+ Ato:2.1 mg/(kg·d) 阿托伐他汀(Ato),PSO口服给药8周。B6小鼠作为对照(WT组),接受正常饮食,给予与ApoE-/-相同剂量的溶媒。
1.2.2 PSO的制备和组成
使用二氧化碳超临界流体萃取(SFE-CO2)获得PSO[15]。萃取压力、温度和CO2流速分别为20 MPa、40°C和30 L/h。使用气相色谱分析PSO的脂肪酸组成[16]。PSO用甲醇酯化后提取脂肪酸甲酯,使用气相色谱-火焰离子化检测器(GC-FID)进行分析,确定PSO的碘值、皂化值、非皂化物质的量和酸值。
1.2.3 血清生化指标测定
治疗8周后动物禁食12 h,眼眶静脉采血,经3500 r/min、离心20 min取上清液,采用全自动生化分析仪及匹配试剂盒测量血清总胆固醇 (TC)、甘油三酯 (TG)、低密度脂蛋白 (LDL-C,)和高密度脂蛋白 (HDL-C)。
1.2.4 超声心动图和脉冲波多普勒测量
治疗8周后使用Vevo2100高分辨率超声系统和MS-550D探头以左室短轴切面探测,采集B型和M型超声图;取心脏长轴切面,采用脉冲波多普勒测定经主动脉血流压力。测量舒张末期左室后壁厚度(LVPW;d)、收缩末期左室后壁厚度(LVPW;s)、收缩末期室间隔厚度(IVS;s)、舒张末期室间隔厚度(LVS;d)、收缩末期左室内径(LVID;s)、舒张末期左室内径(LVID;d),计算射血分数(EF)和短轴缩短率(FS)。
1.2.5 组织学分析
治疗结束后处死小鼠,取心脏和主动脉,用4%多聚甲醛固定,HE染色后观察主动脉根部和心肌,使用ImagJ软件测量斑块面积,使用公式计算斑块面积百分比:斑块面积%=动脉粥样硬化病变面积/管壁面积。
1.2.6 ATP含量测定
50 mg心肌组织匀浆后经3500 r/min、4℃离心10 min,取上清液使用试剂盒测定ATP含量。
1.2.7 qPCR分析
采用Trizol法提取心脏组织总RNA,用逆转录酶PrimeScriptTMRT合成cDNA后进行PCR扩增,检测心脏重塑标记基因(心钠肽(ANP)、脑钠肽(BNP)、β肌球蛋白重链(β-MHC))[17-19]和心肌能量代谢相关基因[20](过氧化物酶体增殖物激活受体α/γ(PPARα/γ)、过氧化物酶体增殖物激活受体γ共激活因子(PGC-1α)、核呼吸因子(NRF-1))的mRNA表达水平。引物序列见表1。数据标准化后使用2-ΔΔct比较法进行分析。

表1 定量PCR引物Table 1 PCR primers
1.2.8 心肌丝磷酸化分析
心脏收缩是消耗ATP并由肌丝蛋白实施的一种活动,肌丝磷酸化水平可评估其活性状态。本实验使用匀浆器将心肌组织匀浆,经12 000 r/min离心后去除上清液。沉淀物重悬于含有1%Triton X-100的裂解液裂解后离心获得心肌丝,定量和变性后使用12%凝胶电泳分离肌球蛋白结合蛋白C(MyBP-C)、肌钙蛋白T(TnT)、肌钙蛋白I(TnI)、肌球蛋白轻链2(MLC2),使用Pro-Q Diamond磷酸化蛋白染色试剂检测肌丝蛋白的磷酸化水平,评估其活性状态,考马斯亮蓝染料检测上样量,用激光扫描仪器扫描。使用Image J软件分析条带强度。
1.3 统计学分析
2 结果
2.1 PSO的成分
PSO的成分见图1。ALA是PSO中最丰富的脂肪酸,其次是油酸、亚油酸、棕榈酸和硬脂酸。PSO的脂肪酸谱包括饱和脂肪酸和不饱和脂肪酸(表2)。

图1 PSO成分分析Figure 1 The PSO component analysis
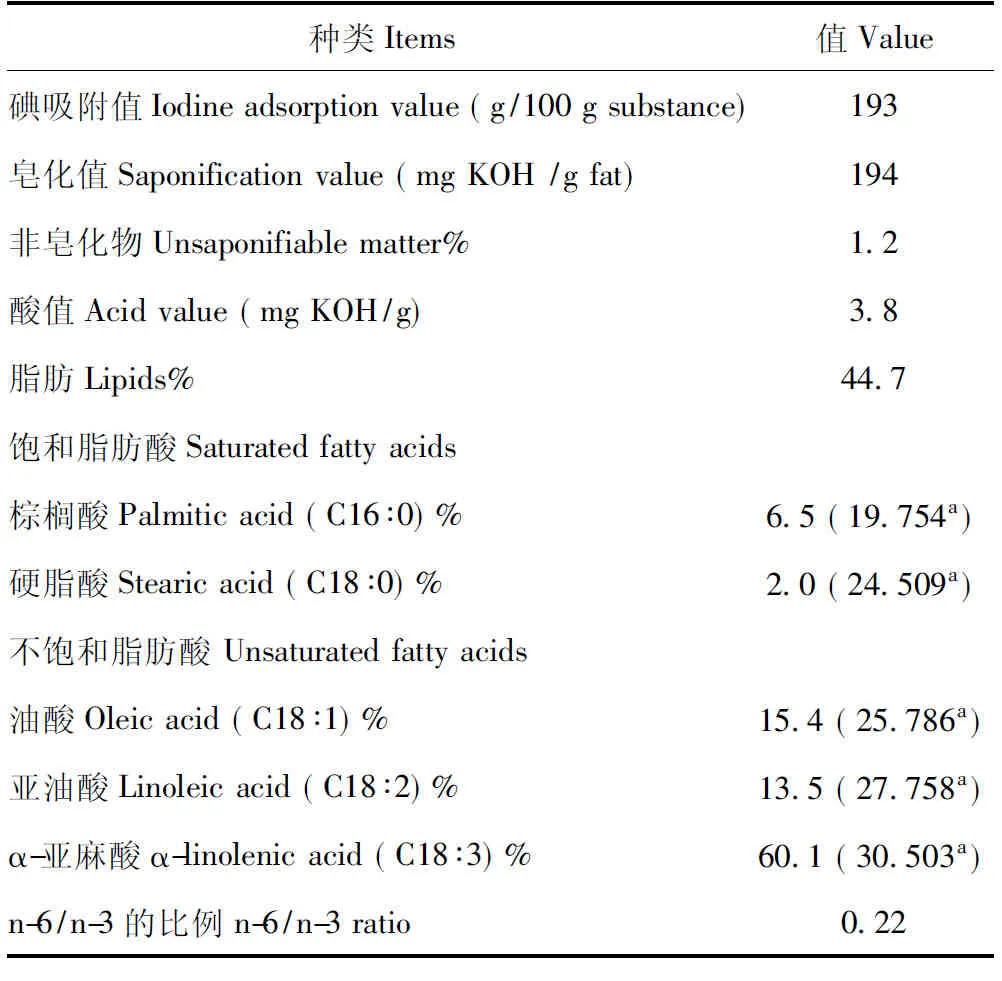
表2 PSO的理化特征Table 2 The physicochemical characteristics of PSO
2.2 PSO对血脂水平的影响
治疗结束时,与WT组相比,ApoE-/-组血清TC、HDL-C和LDL-C水平显著升高,PSO治疗后与ApoE-/-组比较LDL-C和HDL-C水平有改善趋势,但未见显著差异。与ApoE-/-组相比,Ato组显示小鼠血清脂质水平均显著降低(表3)。
表3 血清脂质水平Table 3 Serum lipid levels ± s,n =10)
注:**P< 0.01, vs WT group;#P< 0.05, vs ApoE-/-。
Note.**P< 0.01, vs WT group;#P< 0.05, vs ApoE-/-.
2.3 PSO对主动脉压的影响
主动脉血管弹性纤维HE染色显示WT组中弹性内膜的平滑肌细胞排列整齐,结构完整,而ApoE-/-组管壁有斑块沉积,泡沫细胞浸润。与ApoE-/-组相比,PSO组和Ato组主动脉斑块显著减少,血管结构相对完整 (图2A,B)。脉冲多普勒结果显示,ApoE-/-组主动脉压显著高于WT组,PSO和Ato治疗后,升高的主动脉压恢复到WT组的水平(图2C)。
2.4 心肌组织的病理学观察
HE染色显示WT组心肌结构正常,ApoE-/-组心肌纤维的解体、碎裂或丢失。与ApoE-/-组相比,PSO和Ato治疗后心肌结构显著改善,心肌纤维整齐排列并且没有显著碎裂(图3)。
2.5 PSO对心脏结构与功能的影响
与WT组小鼠相比,ApoE-/-组小鼠IVS; s和LVPW; s显著降低,LVID; s和LVID; d显著增加,表明心脏结构异常(图4A-E),EF(57.93 ± 2.62% vs 71.27 ± 2.66%,P< 0.001)和FS(30.05 ± 1.65% vs 41.53 ± 2.14%,P< 0.001)显著降低 (图4A,F-G),表明心脏功能障碍。与ApoE-/-组相比,PSO组的IVS; s和LVPW; s均显著增高,LVID; s和LVID; d均显著减小(图4A,B-E),EF(0.5 g/kg PSO:68.08 ± 1.63% vs 57.93 ± 2.62%,P< 0.01; 1.0 g/kg PSO: 71.27 ± 2.56% vs 57.93 ± 2.62%,P< 0.001)和FS(0.5 g/kg PSO,37.09 ± 1.23% vs 30.05 ± 1.65%,P< 0.001; 1.0 g/kg PSO,39.84 ± 2.02% vs 30.05 ± 1.65%,P< 0.001)均显著增加,并恢复到与WT组接近水平(图4A,F,G)。另外,Ato组与PSO组的各项指标一致,表示PSO治疗显著保护了心脏结构和功能,具有效果。
2.6 PSO对细胞内ATP含量和基因表达的影响

注:A:主动脉血管弹性纤维与主动脉血流多普勒;B:斑块面积与管壁面积的比值;C:主动脉压。蓝色箭头表示弹性纤维,黄色箭头表示斑块。*P< 0.05 vs WT组;#P < 0.05,### P < 0.001 vs ApoE-/-组。图2 小鼠主动脉压的检测Note. A, Aortic vascular elastic fiber and aortic Doppler images. B, Ratio of plaque area to wall area. C, Aortic pressure. The blue arrow indicates elastic fiber and the yellow arrow indicates plaque.*P< 0.05 vs WT group;#P < 0.05,### P < 0.001 vs ApoE-/- group.Figure 2 Detection of the mouse aortic pressure
与WT组相比,ApoE-/-组的ATP含量显著降低,与ApoE-/-组相比,PSO组的ATP水平得到恢复,Ato组的ATP含量无显著差异(图5A)。与WT组相比,ApoE-/-组小鼠ANP,BNP和β-MHC 的mRNA表达水平增加。与ApoE-/-组相比,PSO组BNP和β-MHC 的mRNA表达显著降低,并且接近WT,但ANP无显著改变, Ato组中ANP,BNP和β-MHC 的mRNA表达水平也显著降低(图5B-D)。以上结果表明PSO减少ApoE-/-心脏重塑。与WT组相比,ApoE-/-组PPARα,PPARγ 和NRF-1 的mRNA表达降低,PCG-1α的mRNA表达升高(图5E-H)。与ApoE-/-组相比,PSO组PPARα 的mRNA(0.5 g/kg PSO,1.65 ± 0.35 vs 0.62 ± 0.11,P< 0.01;1.0 g/kg PSO,1.87 ± 0.34 vs 0.62 ± 0.11,P< 0.01),NRF-1 的mRNA(0.5 g/kg PSO,0.59 ± 0.03 vs 0.28 ± 0.08,P< 0.01;1.0 g/kg PSO,0.66 ± 0.12 vs 0.28 ± 0.08,P< 0.05),PGC-1α 的mRNA(0.5 g/kg PSO,4.58 ± 0.36 vs 0.97 ± 0.11,P< 0.01;1.0 g/kg PSO,5.89 ± 0.6 vs 0.97 ± 0.11,P< 0.01)表达显著增加(图5F-H)。PPARγ 的mRNA表达没有显著差异(图5E)。与ApoE-/-组相比,Ato组PPARα,NRF-1的mRNA表达均得到恢复(图5F-G),但PGC-1α的mRNA水平降低(图5H)。以上结果表明PSO有助恢复ApoE-/-心脏的能量供给。
2.7 PSO对肌丝蛋白磷酸化的影响
Pro-Q Diamond染色结果见图6A。统计显示ApoE-/-组中MyBP-C、TnT、TnI和MLC2的磷酸化水平显著低于WT组(图6A-E);与ApoE-/-组相比PSO治疗后MyBP-C、TnT、TnI和MLC2得到一定程度的恢复(图6A-E),其中1.0 g/kg PSO组和Ato组TnI的磷酸化水平恢复显著,接近WT组水平(图6D),表明心肌丝活性状态得到改善。

注:光学显微镜下的小鼠主动脉根部, 以及肌纤维和主动脉壁。绿色箭头表示心肌纤维,黄色箭头表示斑块。图3 心肌组织HE染色Note. Mouse aortic root, and aortic wall and cardiac muscle fiber. The green arrows indicate myocardial fibers and the yellow arrows indicate plaques.Figure 3 Histological changes of the mouse myocardial tissues(HE staining)

注:A:超声显示小鼠心脏的M型和B型图;B:收缩末期室间隔厚度;C:收缩末期左室后壁厚度;D:收缩末期左室内径;E:舒张末期左室内径;F:射血分数;G:短轴缩短率。a:舒张末期室间隔厚度;b:舒张末期左室后壁厚度;c:收缩末期室间隔厚度;d:收缩末期左室后壁厚度;e:舒张末期左室内径;f:收缩末期左室内径。*P < 0.05,**P < 0.01,***P< 0.001 vs WT组;#P < 0.05,## P< 0.01,### P < 0.001 vs ApoE-/-组。图4 小鼠心功能检测Note. A, Typical B-mode and M-mode ultrasound images of the mouse heart. B, Internal ventricular septum thickness at end-systole. C, Left ventricular posterior wall thickness at end-systole. D, Left ventricular internal dimension at systole. E, Left ventricular internal dimension at diastole. F, Ejection fraction. G, Short axis shortening rate. a, Internal ventricular septum thickness at diastole. b,Left ventricular posterior wall thickness at diastole. c, Internal ventricular septum thickness at end-systole. d, Left ventricular posterior wall thickness at end-systole. e, Left ventricular internal dimension at diastole. F, Left ventricular internal dimension at systole.*P < 0.05,**P < 0.01,***P< 0.001 vs WT group;# P < 0.05,## P< 0.01,### P < 0.001 vs ApoE-/- group.Figure 4 Measurements of cardiac function of the mice
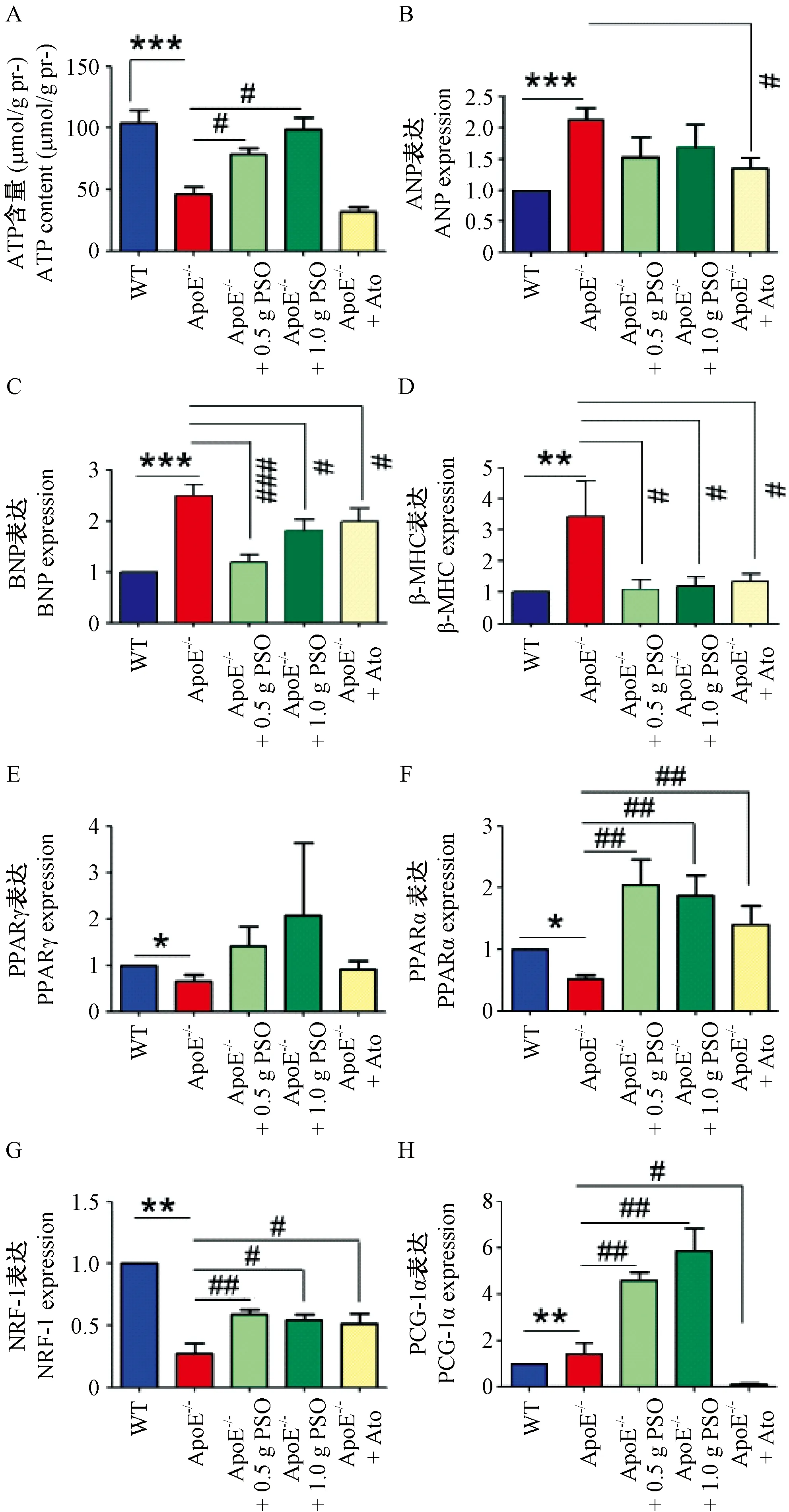
注: A:ATP含量;B:ANP的表达;C:BNP的表达;D:β-MHC的表达;E:PPARγ的表达;F:PPARα的表达;G:NRF-1的表达;H:PCG-1α的表达。*P<0.05,**P<0.01,***P< 0.001 vs WT组;# P< 0.05,## P< 0.01,### P< 0.001 vs ApoE-/-组。图5 ATP含量和基因表达水平Note. A, Content of ATP. B, Expression of ANP. C, Expression of BNP. D, Expression of β-MHC. E, Expression of PPARγ. F, Expression of PPARα. G, Expression of NRF-1. H, Expression of PCG-1α.*P < 0.05,**P < 0.01,***P< 0.001 vs WT group;#P<0.05,## P< 0.01, ### P < 0.001 vs ApoE-/- group.Figure 5 The content of ATP and gene expression levels

A:Pro-Q Diamond染色;B:肌球蛋白结合蛋白C磷酸化水平;C:肌钙蛋白T磷酸化水平;D:肌钙蛋白I磷酸化水平;E:肌球蛋白轻链2磷酸化表达水平。*P < 0.05,**P < 0.01,***P< 0.001 vs WT组;# P < 0.05 vs ApoE-/-组。图6 肌丝蛋白磷酸化水平Note. A, Pro-Q Diamond staining. B, Phosphorylation levels of MyBP-C. C, Phosphorylation levels of TnT. D, Phosphorylation levels of TnI. E, Phosphorylation levels of MLC2.*P < 0.05,**P < 0.01,***P< 0.001 vs WT group; # P < 0.05 vs ApoE-/- group.Figure 6 Phosphorylation level of myofilaments
3 讨论
本实验中, ApoE-/-小鼠可检测到心脏扩张、心功能障碍和心肌结构损伤,与其他报道结果一致,例如肥大性心脏重构[21-23]和内皮功能障碍[21]。但是我们的小鼠出现的时间较早,约为5个月,其它文献报道出现症状的时间有长于或短于此时间的,如正常饮食的ApoE-/-小鼠7.5个月出现显著的心脏重构和内皮功能障碍[21],13个月大的ApoE-/-小鼠出现明显的肥大性心脏重构[22],较短时间的则显示正常饮食4周龄ApoE-/-小鼠已出现左心室肥大性重构[23]。ApoE-/-病理表型出现时间不一致可能与饲养管理情况和实验时间点有关。另外,研究表明动脉粥样硬化病变与巨噬细胞能量代谢异常[22]、线粒体功能损伤引起的能量代谢障碍[23]密切相关,本研究中PSO没有显著降低血脂但却减少动脉粥样硬化斑块,可能与能量代谢的机制相关,本研究中的基因表达检测结果也支持这个观点,具体机制有待于进一步研究。
哺乳动物需要大量的ATP来维持正常的心脏收缩功能,能量代谢异常与心功能失常密切相关。PGC-1α是线粒体合成的“主控制器”,与PPARs和NRF-1共激活起作用[24]。研究表明多不饱和脂肪酸能激活PPARs与PGC-1α调节心脏代谢[25-26],而PPARα的激活可改善心肌能量代谢、延缓心力衰竭[27]。我们的结果显示,PSO治疗改善了ApoE-/-小鼠心功能,提高了PPARα,PCG-1α和NRF-1的mRNA表达水平,表明这些基因表达在PSO治疗机制中起到关键作用。PSO治疗后PPARγ的mRNA表达水平没有显著差异,这可能是因为PPARγ的激活主要受n-6脂肪酸调控[28],并且其激活未参与左心室重构[29]。同时,心肌丝磷酸化结果提示PSO可通过调节心肌丝活性状态改善心脏功能收缩,但其如何与能量代谢相互协调保护心脏的机制仍有待探索阐明。
ApoE-/-小鼠发生心脏结构和功能异常,PSO可抑制其动脉斑块形成、维持正常心脏结构和功能。PSO可能通过调节PPARα/PCG-1α/NRF-1轴增加ATP和肌丝蛋白磷酸化、改善能量代谢、发挥心脏保护作用。
