冠心病人源肠道菌群小鼠模型的建立及评价
2020-01-01朱华李卓苏磊郭亚茜杜晓鹏袁建松秦川
朱华,李卓,苏磊,郭亚茜,杜晓鹏,袁建松,秦川*
(1. 卫健委人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心, 北京 100021; 2. 中国医学科学院 阜外心血管医院,北京 100037)
冠状动脉粥样硬化性心脏病简称冠心病,是一种非常常见的心血管疾病。截止到2016年的数据显示,我国城乡居民因冠心病死亡173.6万例[1]。冠心病是一种遗传因素与环境因素共同作用导致的慢性复杂性疾病。在遗传因素方面,有文献报道通过全基因组关联研究发现了46个与冠心病相关的危险基因,占冠心病遗传因素的10.6%,并且这些因素只与脂质和血压相关且稳定性高,不易受饮食、性别、年龄和药物的影响[2],从而使危险基因较难成为预防治疗冠心病的靶点。肠道菌群作为环境因素的重要组成部分越来越受到研究者重视。直接利用人进行肠道菌群研究存在伦理学限制,动物模型是研究肠道菌群与宿主健康与疾病关系是必不可少的手段。由于实验动物肠道菌群组成及代谢活性与人存在显著差异,因此将动物体内实验结果外推到人不是完全可靠的。以无菌(germ free mice, GF)小鼠为研究对象通过粪菌移植方式建立人源菌群(human flora-associated, HFA)动物模型,其微生物背景清晰,可有效控制遗传基因、肠道微生物、饮食、性别年龄等因素造成的混杂性偏倚[3-4]。本研究通过灌胃方式给无菌小鼠接种冠心病患者的新鲜粪便悬液建立冠心病 HFA 动物模型,为探索肠道菌群在冠心病发生发展过程中的作用机制提供研究基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
本实验室自己繁育的无菌雌性C57BL/6J小鼠28只,饲养于专用无菌隔离器,设施合格证号:【SYXK(京)2018-0019】。饲养环境:温度21~25℃,湿度40%~70%,光照周期明暗比12 h:12 h。动物自由摄入经50 kGy60Co γ射线辐照消毒的定制无菌小鼠饲料。实验中使用的饮水、垫料、鼠盒、水瓶、灌胃针等均经过126℃,30 min的高温高压灭菌处理。本实验已获得中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)批准,批准号:ZH17001。
1.1.2 试剂与仪器
抗体芯片检测试剂:仪器校准试剂盒Bio-Plex Validation Kit (Bio-Rad);Bio-Plex Calibration Kit (Bio-Rad)。检测试剂盒Bio-Plex Pro Mouse Cytokine GrpⅠPanel 23-plex(货号M60009RDPD)。主要仪器:悬液微珠芯片平台,Bio-Plex MAGPIX System (Bio-Rad)。组织脱水机、石蜡包埋机、石蜡切片机(德国Leica)、IQ5PCR仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 志愿者信息
采集2位冠心病患者、1位健康志愿者的新鲜粪便用于建立HFA模型(表1)。冠心病及健康志愿者均来自北京,为典型非素食中国饮食,体检、血相正常;健康志愿者及冠心病患者的消化系统无其它器质性疾病;消化道未进行过手术;无酗酒史、糖尿病及其它影响肠道菌群的问题;取样前8周未服用处方药、益生菌、抗生素、非甾体类药物。冠心病患者符合世界卫生组织/国际心脏病学会制定的冠心病诊断标准[5]。
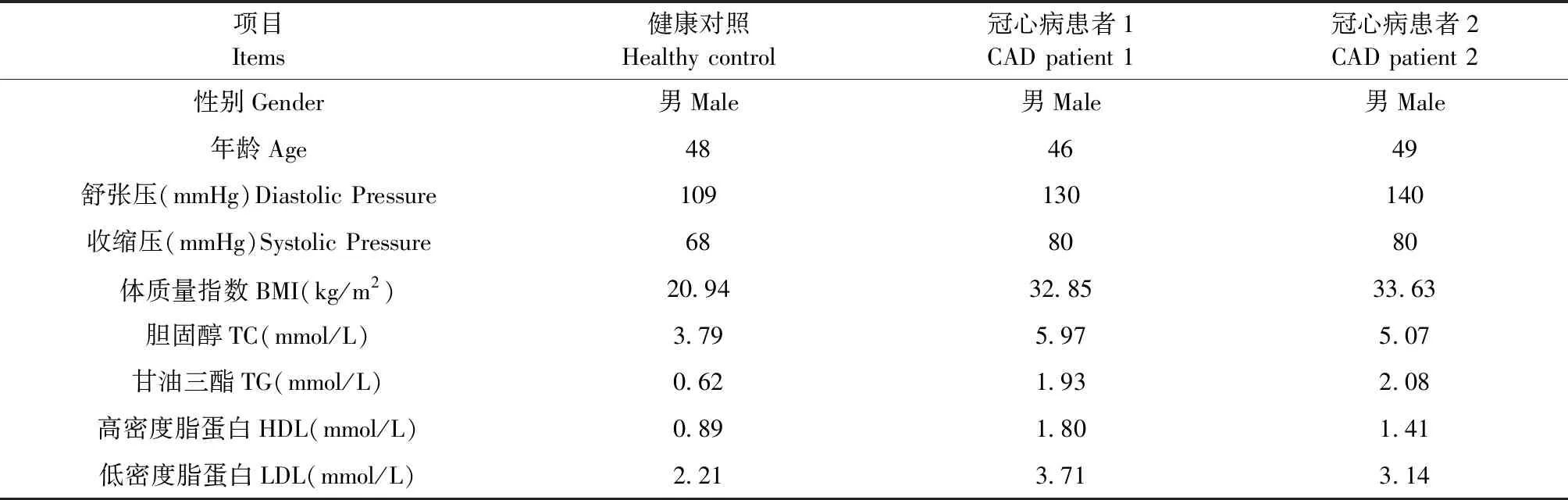
表1 实验志愿者信息Table 1 General information of the volunteers
1.2.2 模型建立
8周龄雌性无菌 C57BL/6J 28只,分为健康对照组(CON)与冠心病(CAD)组,每组14只。收集3位志愿者清晨第1次排出的新鲜粪便,无菌、厌氧条件下称量1 g加入100 mL 0.1 mol/L PBS (pH 7.2)缓冲液,振荡混匀,制成粪便菌悬液待用。分别向2组的每只无菌小鼠体内经口灌喂0.4 mL粪便悬液,建立冠心病人源菌群动物模型。
1.3 检测指标
动物每周称体重,在粪菌移植6周、10周后每组分别安乐7只动物,进行以下指标的检测:
1.3.1 肠道菌群16S rDNA的检测
动物安乐死前在隔离器内采集粪便,-80℃冰箱冷冻保存。按参考文献[6]的方法进行基因组DNA提取和PCR扩增文库构建、测序及生物信息学分析。
1.3.2 血液学指标:
动物用舒泰(25 mg/kg)麻醉后腹主动脉取血,取血结束剪断腹主动脉放血将动物安乐死。血液3000 r/min离心10 min取上清,样品送北京中同蓝博临床检测有限公司,采用比色法进行TG、TC、LDL-C、高密度脂蛋白(HDL-C)、LDH、CK的检测。
1.3.3 细胞因子检测
血液用10 000 r/min离心10 min,取上清。使用 Luminex抗体芯片技术检测血清中与粥样硬化斑块形成相关的细胞因子:IL-1β、 IL-2、IL-4、IL-5、IL-6、INF-γ、IL-10、 IL-12p70、TNF-α的浓度变化。
1.3.4 组织病理学
动物安乐死后,打开胸腔,取出心脏,自升主动脉处将心脏与主动脉分离并切除心脏的下半部分,用PBS洗净残血后4%中性甲醛固定进行HE染色。
1.4 统计学分析
2 结果
2.1 动物一般情况
在整个动物实验过程中,模型组和对照组动物小鼠精神良好、毛色光滑、摄食饮水正常,体重平稳增长。从第5周开始,CAD组动物体重增长加快,与CON组比较差异有显著性(P< 0.05)(图1)。
2.2 肠道菌群16S rDNA检测结果
2.2.1 肠道菌群多样性分析
根据OTUs代表序列与数据库注释文件对比,在 97%(种)水平上进行OTUs 划分,CAD组在造模后6 周和10周时所获得的OTUs数均减少,与CON组比较差异有显著性(P<0.05)。Shannon指数大、Simpson指数小表示肠道菌群的多样性强,CAD组的Shannon指数在造模后两个时间点均降低(P<0.05,P<0.01),Simpson指数均升高(P<0.05,P<0.01),与CON组比较差异有显著性。ACE和Chao1指数大表示菌群丰度高,CAD组的ACE和Chao1指数在造模后两个时间点的数值均降低(P<0.05),与CON组比较差异有显著性(表2)。
2.2.2 肠道菌群在门和属水平上的构成
在造模6周和10周两个时间点CON组reads主要分布在以下8个门:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobacteria)、软壁菌门(Tenericutes)。
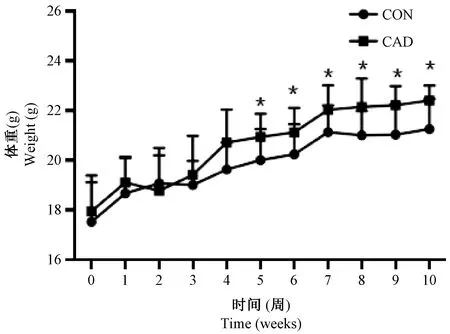
图1 体重变化Figure 1 Body weight change in CON groups and CAD groups
表2 模型组与对照组肠道菌群α-多样性分析指数比较Table 2 Comparison of the α-diversity indexes of gut microbiota between CON groups and CAD

组别GroupsSimpsonACE造模6 周6 weeks after gavage造模10周10 weeks after gavage造模6 周6 weeks after gavage造模10周10 weeks after gavage对照组Control group130.00±17.20128.70±12.20219.33±22.29209.37±35.24模型组CAD group1114.20±12.50101.60±11.04177.31±16.42171.24±19.17P值P value0.0470∗0.0000∗∗0.0132∗0.0124∗
注:与对照组比较,*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.
造模6周时,CAD组厚壁菌门、软壁菌门丰度降低(P<0.05),与对照组比较差异有显著性。拟杆菌门、疣微菌门丰度升高(P<0.01),与对照组比较差异有显著性。造模10周时,CAD组厚壁菌门丰度降低(P<0.01),与对照组比较差异有显著性。拟杆菌门、疣微菌门丰度升高(P<0.01),与对照组比较差异有显著性(图2)。
在属水平,对相对丰度较高的菌株进行分析,造模6周时拟杆菌属(Bacteroides)、Akkermansia菌属相对丰度增高(P<0.01),Blautia菌属、Parasutterella菌属相对丰度降低(P<0.05,P<0.01),与对照组比较差异有显著性。造模10周时拟杆菌属(Bacteroides)、Akkermansia菌属相对丰度增高(P<0.01),肠杆菌属(Lactobacillus)、Blautia菌属、Parasutterella菌属相对丰度降低(P<0.05,P<0.01),与对照组比较差异有显著性(图3)。
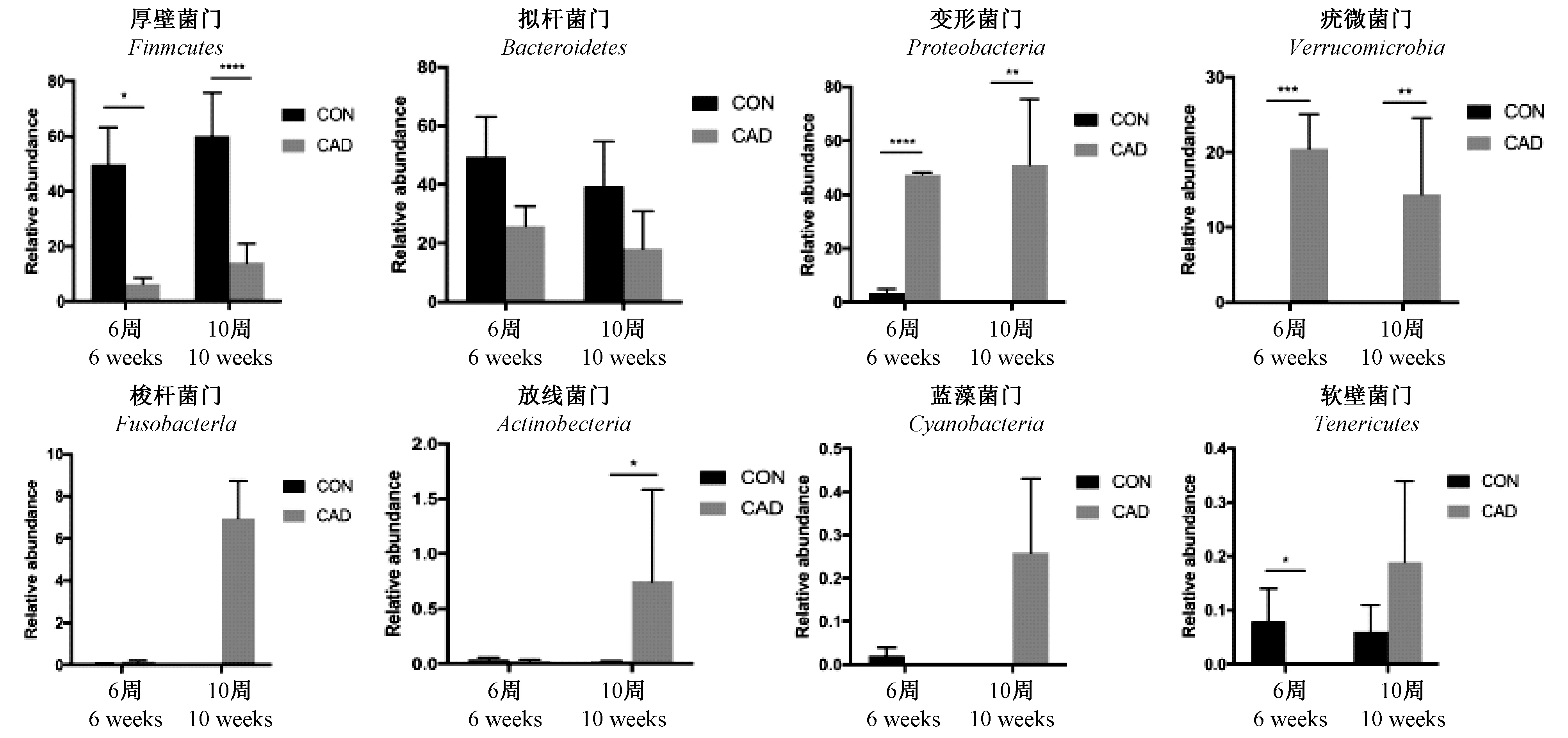
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。图2 肠道菌群在门水平上的构成Note. Compared with the control group,*P<0.05,**P<0.01,***P<0.001,****P<0.0001.Figure 2 Relative abundance of the bacteria in gut microbiota at phylum level in the CON and CAD groups

注:与对照组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。图3 肠道菌群在属水平上的构成 Note. Compared with the control group,*P<0.05,**P<0.01,***P<0.001,****P<0.0001.Figure 3 Relative abundance of the bacteria in gut microbiota at genus level in the CON and CAD groups
2.2.3 β-多样性分析
β-多样性研究是使用 Weighted Unifrac 距离来衡量组间相异系数,此系数越大表示组间物种多样性的差异越大。分析结果显示,CAD组在建模 6周、10周时的Weighted Unifrac 距离分别为0.658、0.681。表明CAD组与CON组在微生物物种构成方面存在显著性差异(P<0.05),差异有统计学意义(图4A)。CAD组、CON组的肠型分布在不同区域,同一组的不同阶段则分布在相同区域(图4B)。
2.3 血液学指标
CAD组小鼠在建模6周和10周时,血液中TG(P<0.05,P<0.01,图5A),TC(P<0.05,图5B),LDH(P<0.01,P<0.0001,图5E)和CK(P<0.01,P<0.05,图5F)值均升高,与CON组比较差异有显著性。LDL-C在建模6周时升高(P<0.05),与CON组比较差异有显著性,10周时未见差异有显著性(图5D)。HDL-C在两个时间点均未见差异有显著性(图5C)。
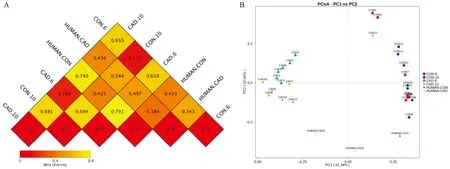
图4 β-多样性分析结果Figure 4 β-diversity analysis of the CON and CAD groups

注:与对照组比较,*P<0.05,** P<0.01,****P<0.0001。图5 血脂和心肌酶标检测结果Note. Compared with the control group, *P<0.05,** P<0.01,****P<0.0001.Figure 5 Detection of the serum lipid levels and myocardial enzymes in the CON and CAD groups
2.4 细胞因子检测
结果显示,与斑块形成、进展相关的细胞因子中,IL-6 在建模6周时浓度升高(P< 0.05),10周时减低(P< 0.0001,图6A);IL-10在建模10周时浓度降低(P< 0.05,图6E); IL-2、IL-4、IL-5、IL-1β 在建模10周时浓度升高(P< 0.0001,P< 0.05,P< 0.0001,P< 0.01,图6B,C,D,F),与CON组比较差异有统计学意义。IL-12p70、TNF-α、INF-γ在建模6周和10周时差异均无统计学意义(图6G,H,I)。

注:与对照组比较,*P<0.05,** P<0.01,****P<0.0001。图6 细胞因子检测结果Note. Compared with the control group, *P<0.05,** P<0.01,****P<0.0001.Figure 6 The serum levels of cytokines in the CON and CAD groups
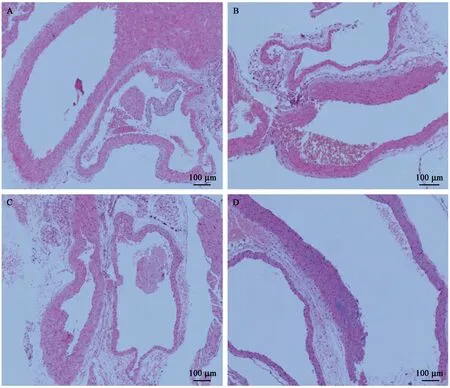
图7 心脏组织的病理学改变Figure 7 Histopathological changes in the mouse myocardial tissues of the CON and the CAD groups
2.5 心脏组织病理学
在建模6周(图7A,B)和10周(图7C,D)时,CON组及CAD组小鼠胸主动脉无斑块形成,血管内膜平滑,未见断裂增厚,内皮细胞排列整齐,中膜厚度正常,平滑肌细胞排列整齐,均未见泡沫细胞形成等动脉粥样硬化改变。
3 讨论
根据Hazenberg等[7]、Che等[8]的研究结果,在接种人肠道菌群2周后,HFA 动物肠道内菌群结构丰度与志愿者菌群几乎完全一致,并且至少保持5周稳定不变。所以本研究选择在灌胃接种志愿者粪便菌悬液6周和10周后,收集CON组和CAD组小鼠的新鲜粪便、血液、组织样品进行检测。通过对肠道菌群β-多样性进行分析,CON组小鼠与健康志愿者分布在同一象限、CAD组小鼠与冠心病患者分布在同一象限,而健康志愿者及接种了健康志愿者肠道菌群的小鼠与冠心病患者及接种了患者菌群的小鼠分布在不同区域,且Weighted Unifrac 距离差异有显著性。α-多样性分析结果,CAD组的Shannon指数在两个时间点均降低,Simpson指数均升高,ACE和Chao1指数在造模后6周和10周两个时间点的数值均降低,与CON组比较差异有显著性。表明志愿者肠道菌群在无菌小鼠体内成功定植,并可形成复杂且与志愿者菌群相似的微生物区系,且CON组、CAD组小鼠肠道菌群结构与丰度差异显著。
血脂是动脉血管壁发生病变的基础物质,高血脂既是冠心病的独立危险因素,也是其病理表现,其机理可能与心肌受损后泵血功能下降导致的血液流变学改变相关[9-11]。Fu等[12]的研究发现厚壁菌门和拟杆菌门的丰度与体质量指数、甘油水平、高密度脂蛋白水平呈有相关性。Velagapudi等[13]通过动物实验证实肠道菌群可影响小鼠的能量代谢和血脂水平。我们的实验中,2名冠心病志愿者的体质量指数、血脂均高于正常值。粪菌液接种到无菌小鼠肠道后,CAD组动物体重在移植后5周上升幅度增加,小鼠血清中的TG、TC、LDL-C与CON比较显著升高。厚壁菌门和拟杆菌门是CON组与CAD组肠道菌群中丰度差异最大的两个门,结果与已有的研究报道相符。
动脉粥样硬化是一个慢性的炎症发展过程[14],其机制目前较为认同的是损伤反应学说及在此基础上发展出的炎症学说,在这个过程里始终存在各种炎症细胞和大量炎症介质参与[15-16]。IL-6作为心脏不良事件的独立危险因素标志物参与易损斑块的炎症全程[17]。IL-10的作用主要是在免疫应答进行负调节,它可以通过直接抑制免疫细胞的功能实现免疫抑制[18],也可以通过控制IL-1β产生的炎症反应避免组织过度损伤[19]。IL-2与IL-2受体α亚基结合后可调节T淋巴细胞的活化,而活化的T淋巴细胞能分泌趋化因子增强炎症反应,从而促进动脉粥样硬化斑块的形成及进展[20]。实验结果显示,移植冠心病患者的肠道菌群后,小鼠血清中IL-6,IL-2升高,IL-10降低而被IL-10调节的IL-1β升高,验证了上述研究结果。IL-4参与粥样硬化的机制比较复杂,目前尚无定论。我们的结果显示移植6周时IL-4已经升高但无显著性差异,10周时显著升高,说明IL-4参与的体液免疫可能促进动脉粥样硬化的发展。
上述实验结果证明移植冠心病患者肠道菌群10周后HFA小鼠的心肌细胞和血管内皮细胞已发生功能上的损伤,导致血脂、细胞因子的含量发生变化。但由于斑块形成是一个复杂且缓慢的过程,移植10周时心肌细胞和血管内皮细胞还未发生器质性改变,故HE染色中未发现泡沫细胞浸润等斑块形成的病理学变化。
理想的动物模型应具备以下特点:发病过程和机制尽量接近临床情况;能够对相关药物或治疗手段作出客观评价;模型的制备应操作简便、经济、可重复性高[21]。本研究利用粪菌移植方法建立了冠心病HFA小鼠模型,除肠道菌群的结构与丰度与人类似外,体重、血脂、细胞因子含量也出现了与临床类似的改变,为研究肠道菌群与冠心病关系研究提供了更多可选择的动物模型。
