TLR4基因敲除小鼠对噪声性耳蜗损伤的反应
2019-12-13杨卫平许阳胡博华杨仕明
杨卫平 许阳 胡博华 杨仕明
1 解放军总医院耳鼻咽喉头颈外科,耳鼻咽喉研究所(北京100853)2 解放军总医院呼吸科(北京100853)3 美国纽约州立布法罗大学听力及聋病研究中心(NY 14214 USA)
强噪声暴露引起耳蜗损伤,导致听觉功能障碍。噪声暴露后耳蜗免疫系统被激活,产生炎性介质和免疫细胞渗入[1-4]。然而,耳蜗免疫激活的分子机制尚不清楚。本课题组前期采用RNA序列分析技术研究发现,噪声暴露后大鼠、小鼠耳蜗感觉神经上皮主要表达相同的基因包括免疫应答、创伤、防护、趋化和炎性反应等基因,及趋化因子、NOD 样受体、Toll 样受体(Toll-like receptor, TLR)等信号通路基因[5]。
TLR 家族共有13 个成员,主要承担识别感染性疾病中“病原体相关分子模式”(pathogen-associated molecular patterns, PAMP)和非感染性疾病中坏死的细胞释放“损伤相关的分子模式”(damage associated-molecular paternals, DAMPs)因子,TLR与相应的配体相结合后通过级联信号传导引起细胞免疫炎症反应[6,7]。Toll 样受体4(Toll-like receptor 4,TLR4)是Toll样受体家族中的成员,是固有免疫系统中最重要的致炎信号通路之一,主要分布于免疫细胞和具有免疫功能的细胞[8]。TLR4 与配体结合后启动相关通路,导致多种炎性因子的释放[9]。我们的前期研究发现TLR4 蛋白表达于内耳细胞,噪声暴露后内耳细胞TLR4 蛋白表达增强[10]。本实验选用TLR4 基因敲除(TLR4 KO)小鼠,观察Toll 样受体4 缺失小鼠耳蜗对噪声刺激的反应,分析其作用的机制。
1 材料和方法
1.1 实验动物
本实验采用C57BL/6J 小鼠(野生型,WT,对照组)和B6.B10ScN-Tlr4lps-del/JthJ 小鼠(TLR4 基因敲除型,TLR4 KO,实验组)4~5周龄,雌雄各半,购自杰克逊实验室(Jackson Laboratory, Bar Harbor,ME,USA)。小鼠的使用得到美国布法罗大学实验动物中心的许可。
1.2 实验步骤
首先检测小鼠听功能,筛选对照组动物,评估实验组动物听力学基线。噪声暴露后1天,CO2麻醉后动物断头处死(每组各4 只),观察CD45 标记的噪声暴露后小鼠耳蜗基底膜鼓阶面巨噬细胞及单核细胞形态的变化。噪声暴露后25 天,听功能检测(每组各7只)后动物处死,鬼笔环肽染色耳蜗基底膜毛细胞丝状肌动蛋白,计数耳蜗基底膜缺失的外毛细胞。
1.3 听功能检测
使用美国TDT 测听设备(Alachua,FL,USA)检测小鼠ABR阈值。听功能检测在屏蔽的隔声间内进行。噪声暴露后25 天,腹腔注射氯胺酮(87mg/kg)和赛拉嗪(3mg/kg)麻醉动物,将成功麻醉后的小鼠置于保温毯上保持恒定体温。记录电极放置于小鼠颅顶皮下,参考电极放置于小鼠测试耳的耳后皮下,接地电极放置于小鼠非测试耳的耳后皮下。四个频率(4kHz、8kHz、16kHz 和32 kHz) 的短纯音诱发小鼠两耳ABR 阈值,重复率为21 次/秒。带通滤波为100~3000Hz,叠加次数为1024次。刺激的强度从100 dB SPL 开始,以5 dB 间隔递减至ABR图形的消失,重复最低dB测试的ABR图形。
1.4 噪声暴露
将美国TDT RP2.1 信号发生器(TDT, USA)、PA5 信号衰减器(TDT, USA)和美国Crown XLS 202信号放大器(Harman International Company,USA)发出的噪声信号传至美国NSD2005-8 扩音器(Eminence,USA)。选用宽带1-7kHz,强度120dB SPL的强噪声对WT 和TLR4 KO 实验组小鼠持续噪声暴露1小时。噪声暴露过程在隔声室内进行,将小鼠放置于小铁笼内,扩音器悬挂于鼠笼之上。噪声暴露前,使用美国LD-PCB,model 800B声级计(APCB Piezotronics Div., Larson Davis,USA)、LD-PCB model 825 前置放大器( Larson Davis, USA)和Larson and Davis电容式微音器(LDL 2559,USA)校准噪声暴露区域声场的强度。
1.5 耳蜗毛细胞丝状肌动蛋白染色
噪声暴露前和噪声暴露后25 天,听功能检测后处死动物,解剖取出双侧耳蜗。自圆窗缓慢注入10%福尔马林液,室温固定耳蜗组织4小时。采用本项目组建立的原位耳蜗基底膜毛细胞丝状肌动蛋白染色观察法[10],染色评估强噪声暴露后耳蜗毛细胞形态学的变化。
1.6 免疫细胞的荧光标记
采用免疫细胞的CD45 荧光标记方法染色小鼠耳蜗基底膜[3]。噪声暴露前和噪声暴露后1 天,解剖取出小鼠双侧耳蜗,将固定后分离的耳蜗基底膜移入10 mM PBS 稀释的免疫荧光蛋白CD45一抗液中(goat CD 45 polyclonal antibody 1:200,AF114, RD Inc., USA) 4°C 孵育过夜。PBS 液清洗后将耳蜗基底膜移入PBS 稀释的Fluor®488 二抗液中(Alexa Fluor®488 donkey anti-goat IgG, 1:200,Invitrogen)室温孵育2h。PBS液清洗后将标本置入10mM PBS 配制的5μg/ml 碘化丙锭(propidium lodide, Molecular probe, OR, USA) 液中,室温避光染色10min,抗荧光退变剂(ProlongTM Antifade kit,Molecular Probes Inc.USA)封片。
1.7 显微镜观察及图像处理
使用Leica 荧光显微镜(Z6 APO Manual Macro-Fluo,USA)观察Alexa Fluor 488 鬼笔环肽染色的耳蜗基底膜毛细胞和CD45 荧光免疫抗体标记的耳蜗基底膜鼓阶面的组织巨噬细胞和单核细胞。利用SPOT RT显微镜配制的相机(Color Diagnostic Instruments, MI, USA)依次拍照全耳蜗基底膜,采用Adobe Photoshop CS6 计算机图像处理软件(version 13.0.1, San Jose, CA, USA) 将连续拍照的图像合图。观察噪声暴露后1 天耳蜗基底膜鼓阶面组织巨噬细胞和单核细胞形态变化,噪声暴露后25 天耳蜗基底膜毛细胞形态变化,计数全耳蜗基底膜图像中缺失的外毛细胞。
1.8 统计学处理
实验数据的统计分析采用美国SigmaStat Version3.5软件处理,各组数据以±s表示。比较噪声暴露前WT和TLR4 KO小鼠四个频率ABR阈值,及噪声暴露后25 天两组小鼠ABR 阈移,采用两因素方差分析。比较噪声暴露前及噪声暴露后25天两组小鼠全耳蜗基底膜外毛细胞缺失数目,采用t检验分析,P<0.05为具有统计学意义。
2 结果
2.1 生理条件下Toll 样受体4 基因敲除没有影响小鼠耳蜗基底膜感觉细胞的生存
荧光显微镜下观察,Alexa 488-labeled 鬼笔环肽染色的生理条件下WT 和TLR4 KO 小鼠耳蜗基底膜毛细胞结构正常,偶见毛细胞缺失(见图1A和B)。比较WT(14.3±3.4)与TLR4 KO(15.3±3.9)小鼠全耳蜗缺失外毛细胞数目无显著性差异(t 检验,P=0.578,见图1C)。
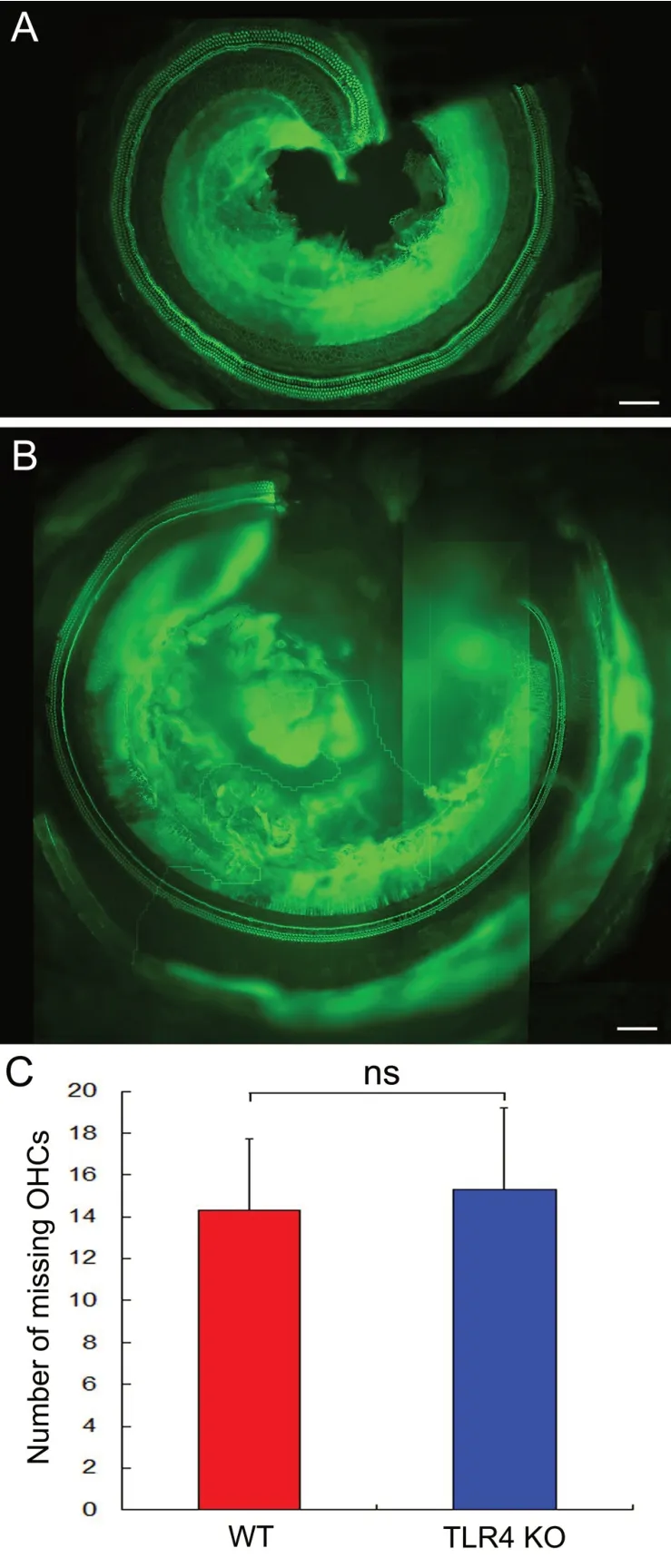
图1 Alexa 488-labeled 鬼笔环肽染色的生理条件下TLR4 KO 小鼠耳蜗毛细胞。A:耳蜗顶回毛细胞;B:耳蜗底回毛细胞;C:生理条件下WT 和TLR4 KO 小鼠全耳蜗外毛细胞缺失数目;标尺=100 μm。Fig.1 Typical image of F-actin staining in hair cells in the cochlea of TLR4 KO mice under physiological conditions. A:Hair cells in an apical section of cochlea.B:Hair cells in the basal section of cochlea. C: Comparison of the average numbers of missing outer hair cells between WT and TLR4 KO mice under physiological conditions.Bar=100 μm.
2.2 噪声暴露后TLR4 KO小鼠听功能下降幅度小于WT小鼠
噪声暴露前检测TLR4 KO 与WT 小鼠听功能正常,两组动物ABR 阈值无显著性差异(F=0.126,df=1,100,P= 0.724; Tukey test,P>0.05),见图2A 所示。噪声暴露后25 天听功能检测发现,四个频率短纯音诱发的TLR4 KO小鼠ABR阈移均明显低于WT 小鼠对照组(F=71.590,df=1,90,P<0.001;Tukey test,P<0.001),见图2B所示。
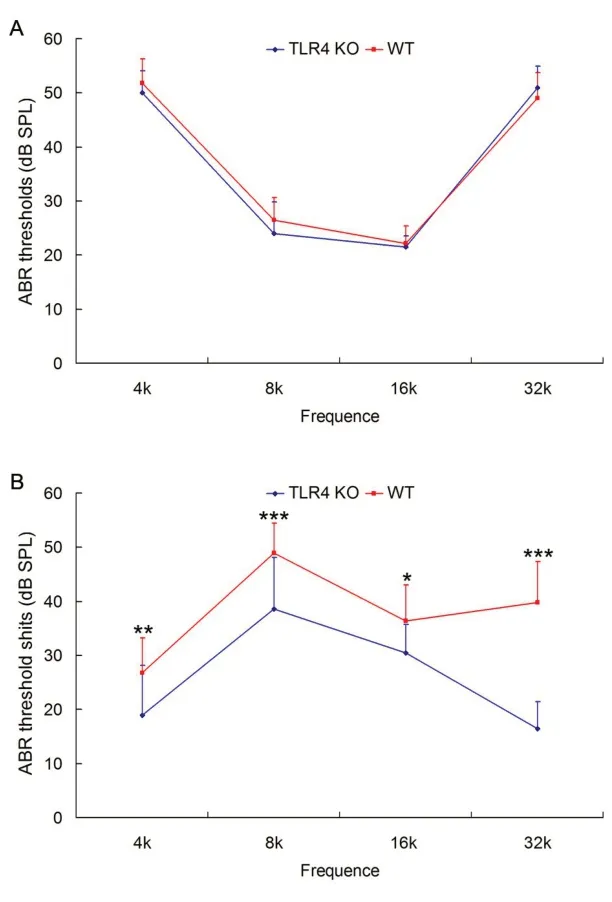
图2 噪声暴露前后WT 和TLR4 KO 小鼠听功能变化。A:噪声暴露前WT 和TLR4 KO 小鼠四个频率短纯音诱发的ABR阈值;B:噪声暴露后25天两组小鼠ABR阈移。Fig. 2 Comparison of auditory function between WT and TLR4 KO mice before and after noise exposure.A: Comparison of ABR thresholds at the 4 tested frequencies between WT and TLR4 KO mice before noise exposure. B: Comparison of ABR threshold shifts at the 4 tested frequencies between WT and TLR4 KO mice after noise exposure 25 days.*:P<0.05,**:P<0.01,***:P<0.001.
2.3 噪声暴露后TLR4 KO 小鼠耳蜗外毛细胞损伤程度轻于WT小鼠
荧光显微镜下观察,鬼笔环肽染色的强噪声暴露后两组小鼠耳蜗基底膜顶回外毛细胞损伤程度较轻(见图3A 和C),耳蜗底回为外毛细胞缺失的主要部位(见图3 B和D)。两组动物耳蜗缺失的外毛细胞数目比较显示,噪声暴露后25 天TLR4 KO小鼠全耳蜗基底膜外毛细胞缺失数目明显少于WT小鼠对照组(图3E,F=8.996, df =1, 17,P=0.008;Tukey test,P=0.008)。

图3 噪声暴露后25 天WT 与TLR4 KO 小鼠全耳蜗外毛细胞缺失数目。A-D:鬼笔环肽染色的小鼠耳蜗基底膜毛细胞;A:WT 小鼠耳蜗顶回毛细胞;B:WT 小鼠耳蜗底回毛细胞;C:TLR4 KO 小鼠耳蜗顶回毛细胞;D:TLR4 KO 小鼠耳蜗底回毛细胞;箭头示缺失的外毛细胞区域,Apical:耳蜗基底膜顶回,Basal:耳蜗基底膜底回,标尺=100 μm;E:噪声暴露后25天WT与TLR4 KO小鼠耳蜗基底膜外毛细胞缺失数目比较图,TLR4 KO 小鼠耳蜗基底膜外毛细胞缺失数目明显少WT对照组(P=0.008)。Fig. 3 Comparison of the number of missing OHCs at 25 days after noise exposure between WT and TLR4 KO mice cochlea.A-D: Typical images of F-actin staining in hair cells in the basilar membrane of mice cochlea.A:Typical image of F-actin staining in hair cells in the apical section of WT mice cochlea. B: Typical image of F-actin staining in hair cells in the basal section of WT mice cochlea. C: Typical image of F-actin staining in hair cells in the apical section of TLR4 KO mice cochlea. D: Typical image of F-actin staining in hair cells in the basal section of TLR4 KO mice cochlea. Arrows point to the areas of missing OHCs. Bar = 100 μm. E: Comparison of the number of missing OHCs after noise exposure between WT and TLR4 KO mice cochlea. The average number of missing OHCs in theTLR4 KO mice cochlea is significantly less than in the WT mice cochlea.**:P<0.01.
2.4 TLR4基因缺失没有阻止噪声暴露后单核细胞渗入耳蜗
在生理条件下,WT 和TLR4 KO 小鼠耳蜗顶回和底回基底膜鼓阶面可见CD45染色阳性的巨噬细胞(多形型,Fig.4 A,C,E,G)。噪声暴露后1天,两组小鼠耳蜗基底膜顶回和底回巨噬细胞形态无明显变化(Fig.4 B,D,F,H),但在两组小鼠耳蜗底回基底膜与外侧壁连接处均可见CD45染色阳性的单核细胞(小圆型,Fig.4 F和H),表明TLR4基因缺失没有阻止噪声暴露后单核细胞浸入耳蜗基底膜。
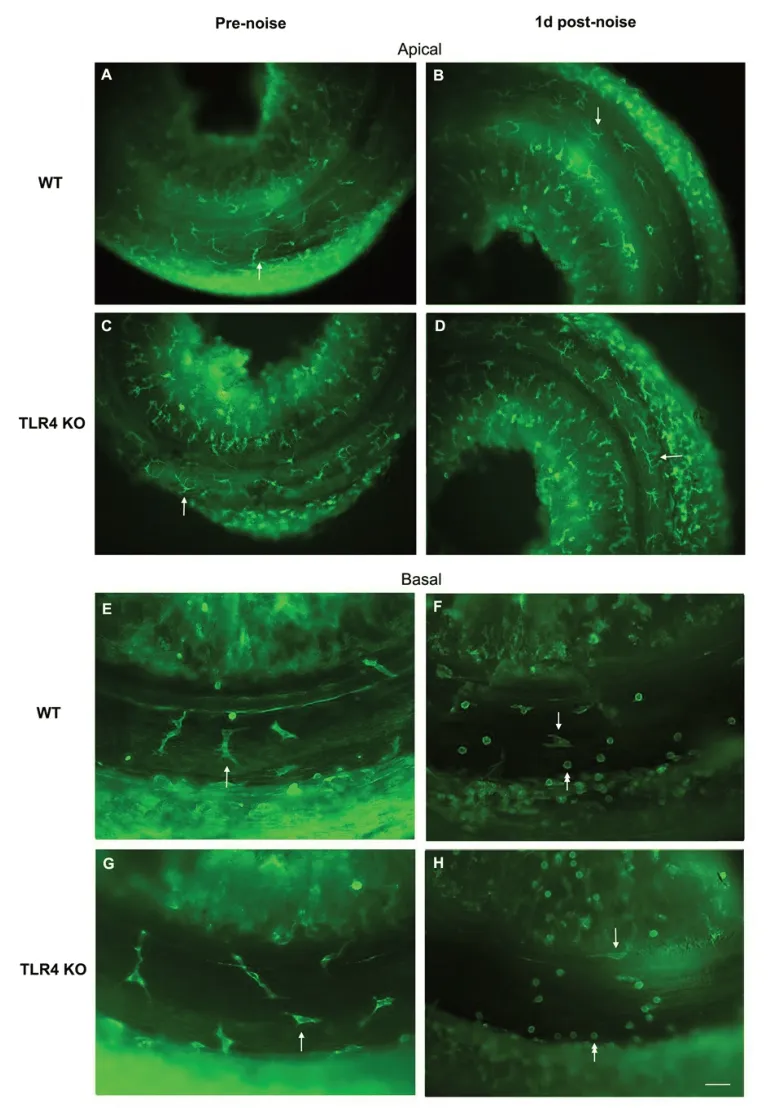
图4 噪声暴露前后WT和TLR4 KO小鼠耳蜗基底膜鼓阶面CD45 标记的组织巨噬细胞和单核细胞。A 和C:噪声暴露前WT 和TLR4 KO 小鼠耳蜗顶回的组织巨噬细胞; E 和G:噪声暴露前WT 和TLR4 KO 小鼠耳蜗底回的组织巨噬细胞;B和D:噪声暴露后1天WT和TLR4 KO小鼠耳蜗顶回的组织巨噬细胞;F和H:噪声暴露后1天WT和TLR4 KO小鼠耳蜗底回的组织巨噬细胞和单核细胞;单箭头示典型的组织巨噬细胞,双箭头示典型的单核细胞,Pre-noise:噪声暴露前,1d post-noise:噪声暴露后1天,Apical:耳蜗基底膜顶回,Basal:耳蜗基底膜底回,标尺=40μm。Fig.4 Typical morphology of tissue macrophages and monocytes stained with CD45 in the cochlear basilar membrane of before and 1day after noise exposure. A and C: Morphology of tissue macrophages in the apical section of WT and TLR4 KO mice cochlea before noise exposure. E and G: Morphology of tissue macrophages in the basal section of WT and TLR4 KO mice cochlea before noise exposure.B and D:Morphology of tissue macrophages in the apical section of WT and TLR4 KO mice cochlea 1 day after noise exposure.F and H: Morphology of tissue macrophages and monocytes in the basal section of WT and TLR4 KO mice cochlea 1 day after noise exposure.Arrows point to the typical morphology of tissue macrophages.Double arrows point to the typical morphology of monocytes.Bar=40 μm.
3 讨论
我们的前期研究发现,耳蜗基底膜鼓阶面存在固有组织巨噬细胞,暴露后1天出现单核细胞浸入耳蜗基底膜[3]。本实验检测暴露后1天TLR4 KO小鼠耳蜗基底膜免疫细胞形态变化,目的揭示TLR4基因缺失是否影响单核细胞浸入耳蜗基底膜。暴露后25天检测外毛细胞的数量,目的是评估TLR4基因缺对耳蜗外毛细胞形态的作用。我们对WT和TLR4 KO小鼠耳蜗外毛细胞计数及ABR阈值检测结果发现,生理情况下TLR4 基因敲除并未影响小鼠耳蜗毛细胞形态和听觉功能,表明TLR4 基因与正常听觉功能无关。暴露后1 天,WT 和TLR4 KO 小鼠均出现耳蜗基底膜单核细胞的浸润,表明TLR4基因敲除并未影响噪声暴露后血液中单核细胞向耳蜗基底膜鼓阶面的浸润。
本实验的主要目的为揭示TLR4基因敲除对噪声性耳蜗感觉细胞损伤、听觉功能障碍和耳蜗免疫活力的影响。采用TLR4 KO小鼠模型,以WT小鼠为对照,观察强噪声暴露后25 天耳蜗外毛细胞缺失数目和ABR 阈值的变化。发现强噪声暴露后,TLR4基因敲除减少噪声暴露后小鼠耳蜗外毛细胞死亡数量,减轻听功能损伤程度,表明TLR4参与了噪声暴露后耳蜗外毛细胞的损伤,其可能机制:
高强度噪声暴露后耳蜗毛细胞的机械性损伤继发代谢性损伤和免疫炎性反应[11]。耳蜗外毛细胞对强噪声性耳蜗损伤最为敏感,强噪声暴露后耳蜗外毛细胞主要以凋亡和坏死方式死亡[12],细胞凋亡是噪声性耳蜗毛细胞死亡的主要方式[13]。凋亡细胞由于细胞内溶酶体膜完整,死亡后被吞噬细胞吞噬,很难造成周围细胞的损伤[14]。坏死细胞内溶酶体膜破裂,释放大量多种酸性的水解酶,造成坏死细胞的自溶和周围细胞的炎性反应[15]。同时,坏死的细胞释放多种DAMPs 因子,DAMPs 与固有免疫功能细胞上的“模式识别受体”(pattern recognition receptors,PRRs)结合,进而激活固有免疫系统,直接或间接启动适应性免疫应答[16]。我们的前期研究发现,高强度噪声致耳蜗毛细胞的死亡发生在噪声暴露后数分钟内[12],并可延续至噪声暴露后30天[13],表明强噪声暴露后耳蜗毛细胞存在明显的次级损伤。因此,本实验选择观察强噪声暴露后25 天TLR4 基因敲除小鼠耳蜗毛细胞形态和听觉功能的变化。本课题组前期研究证实,本实验采用的噪声暴露条件(宽带1-7kHz、120dB SPL、噪声暴露1 小时)能造成小鼠听功能障碍,出现永久性听力阈移(permanent threshold shift,PTS)[17]。
我们的前期实验发现,TLR4 蛋白表达在耳蜗感觉神经上皮中毛细胞临近的支持细胞,噪声暴露后1 天过表达的TLR4 集中在死亡毛细胞周围的Deiters 细胞[10]。另有研究报道,TLR4 表达在耳蜗柯蒂氏器与外侧壁螺旋韧带之间的外沟细胞[18]。本实验形态学检测发现,噪声暴露后TLR4 KO 小鼠耳蜗基底膜外毛细胞损伤程度明显轻于WT 对照小鼠,结合噪声暴露后TLR4 蛋白过表达于死亡毛细胞周围的检测结果,我们认为TLR4 促进噪声性耳蜗毛细胞的损伤。
能够与TLR4 相结合的DAMPs 主要有热休克蛋白(HSPs)、高迁移率族蛋白1(HMGB1)、组蛋白(Histones)、S100 蛋白(S100s)等[7]。有研究报道,强噪声暴露后4 小时小鼠耳蜗组织HSP 的表达量为未接触噪声暴露小鼠的20余倍[19]。作为DAMPs之一的HSP 能与耳蜗免疫功能细胞膜上TLR4 相结合,激活免疫功能细胞,诱导促炎因子的产生。本实验采用免疫细胞荧光抗体CD45 染色耳蜗基底膜发现,噪声暴露后1天TLR4 KO 和WT小鼠耳蜗基底膜底回均出现单核细胞浸入。我们的前期实验证明,噪声暴露后4 天,浸入耳蜗基底膜的单核细胞开始转化为巨噬细胞[3]。从时间上分析,噪声暴露后早期TLR4 参与的耳蜗免疫反应主要由耳蜗基底膜固有组织巨噬细胞和免疫功能细胞执行。
参与耳蜗免疫反应的细胞主要包括免疫细胞如巨噬细胞(固有型和游走型)、单核细胞[3],和具有免疫功能的非免疫细胞如:柯蒂氏器的支持细胞、外侧壁的纤维细胞和耳蜗基底膜鼓阶面的间皮细胞[1]。目前有研究发现,柯蒂氏器中的支持细胞是产生炎性因子的一个重要来源[10],螺旋韧带的纤维细胞产生多种炎性因子[20-21]。噪声暴露后TLR4 与配体结合激活免疫功能细胞,激活的免疫功能细胞释放炎性因子,导致耳蜗细胞的炎性反应和听功能的下降。本实验噪声暴露后TLR4 KO小鼠耳蜗外毛细胞缺失数量减少,听功能下降程度减轻,表明TLR4的缺失对噪声性耳蜗毛细胞损伤起到了一定的防护作用。
总之,本文发现TLR4 缺失减轻噪声暴露后耳蜗基底膜外毛细胞的损伤,表明TLR4 促进噪声暴露后耳蜗的炎性反应。我们认为噪声机械性耳蜗毛细胞坏死导致DAMPs 的释放,DAMPs 与耳蜗具有免疫功能的支持细胞和纤维细胞膜上的TLR4结合,激活免疫功能细胞,诱导促炎因子的释放,导致耳蜗细胞免疫炎性反应。TLR4的缺失部分阻断炎症过程,降低促炎因子的表达,减轻噪声暴露后耳蜗感觉细胞和听功能损伤的程度。TLR4作为启动机体先天性免疫应答的开关,在噪声性耳蜗损伤中起着重要的作用。然而,噪声暴露后耳蜗死亡的细胞释放哪些DAMPs? TLR4 与DAMPs 结合后释放哪些促炎因子?促炎因子如何作用到毛细胞?诸多问题有待于进一步研究揭示。深入探讨TLR4在噪声性耳蜗损伤的免疫炎性机制,将成为临床早期干预的研究方向。
