复发外耳道基底细胞癌诊治一例
2019-12-13许国珍宋升桥王国建谢焕清
许国珍 宋升桥 王国建 谢焕清*
1 南京医科大学附属苏州科技城医院耳鼻咽喉科(苏州215153)2 解放军总医院第一医学中心耳鼻咽喉头颈外科(北京100853)
1 病例资料
患者女,63 岁,以“右耳反复流脓8 年”为主诉就诊。患者8年前无明显诱因出现右耳内瘙痒,反复流粘液,偶有血性,伴听力下降,无眩晕及耳痛。4 年前于外院行右外耳道病灶切除及外耳道成形术(范围不详),病理为“乳头状瘤伴中度不典型增生”。术后不久耳漏复发伴听力进行性下降,时有耳痛,曾多次于多家医院就诊,予滴耳液及药膏外用,症状无改善。入院查体见右外耳道脓液,峡部以内皮肤可见大量肉芽样新生物,质脆,易出血,无面瘫,听力学检查提示右耳重度传导性聋,骨-气导差40dB;颞骨CT 提示右侧外耳道、中耳及乳突充满软组织影,外耳道壁骨质轻微虫蚀样破坏(图1);颅脑MRI提示右侧外耳道及中耳乳突异常信号影并有局部增强(图2),颈部淋巴结及腮腺超声未见异常。外耳道活检报告为“基底细胞癌”(图3)。
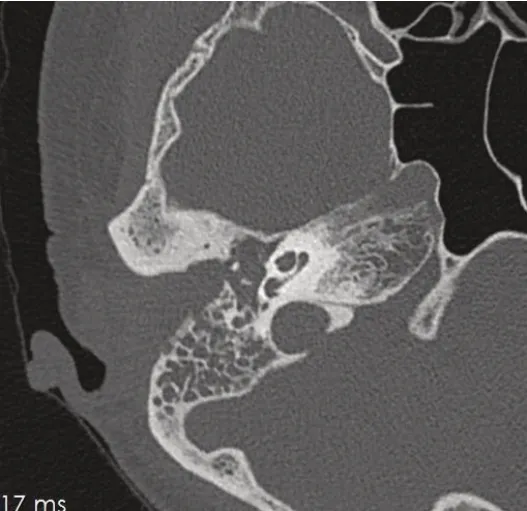
图1 术前颞骨CT平扫提示右侧外耳道、中耳、乳突内软组织影,外耳道壁及听骨的骨质虫蚀样改变,鼓室内壁、颈动脉管、乙状窦及颈静脉球骨壁完整。Fig. 1 Preoperational CT scan shows that there are soft mass in right EAC, middle ear and mastoid cavity, and wormlike bone destruction of ossicles and EAC. The medial bone wall of tympanic cavity, bone walls of carotid artery, sigmoid sinus and jugular bulb were intact.

图2 颅脑冠状位T2 加权MRI 显示右侧上鼓室等T2 信号,脑膜未见明显增厚。Fig.2 Coronal T2-weighted MRI shows iso-intensity in attic without prominent thickening of the adjacent dura.

图3 右侧外耳道中耳病理切片显示多个大小不等的癌巢,由基底样细胞组成,呈“栅栏状”排列,周围有裂隙,裂隙内有黏液样物质,肿瘤与皮肤基底部相连,向真皮内浸润性生长(HE染色,x 100)。Fig. 3 Histopathological examination shows multiple cancer nests of different sizes.The basal-like cells are composed of a fence-like arrangement with fissures around them. There are mucus-like substances in the fissures, the tumor connects the base of the skin and infiltrates into the dermis. (HE, original magnification x 100).
患者全麻下行右侧扩大颞骨外侧切除术、腮腺浅叶部分切除术及外耳道封闭术。行耳后大C 型切口,将耳廓皮瓣自骨皮质分离向前翻起至颧弓根及外耳道处,下方暴露腮腺及胸锁乳突肌前缘。在病灶外侧0.5cm横断外耳道。冰冻病理提示“基底细胞癌及外切缘阴性”。轮廓化乳突。磨除外耳道后壁,断桥,暴露中、上鼓室,鼓膜不完整,鼓室内可见大量成簇状肉芽样新生物,颈内动脉骨管完整。将锤砧骨及上鼓室病灶彻底清除,轮廓化上鼓室,见鼓室天盖骨质受累,对应硬脑膜表面局部略显粗糙及微充血,软硬度与正常脑膜无异,充分双极电烧至正常范围。探查面神经水平段暴露,但未受累。切除受累的镫骨上结构,磨除大部分鼓部骨质并探查颞颌关节囊,未见其受累。将耳囊外侧、鼓室下及后壁、咽鼓管鼓口及颈内动脉管周围骨质充分磨除至正常骨质暴露。将外耳道连同新生物一并切除。考虑外耳道软骨部前内下部受累明显,故将切除耳屏软骨及部分腮腺浅叶。取腹部脂肪填塞术腔并封闭外耳道。复位缝合耳廓皮瓣。术后病理提示:外耳道基底细胞癌(图3),各切缘、腮腺浅叶及淋巴结均未见癌,鼓室天盖区可见癌。术后3天内眩晕,一周后明显改善。无耳鸣及面瘫。术后1个月追加瘤床的根治性放疗(70Gy),及瘤床区外扩2cm作为预防照射区放疗(63Gy),行同步推量照射,分35 次照射,总共7 周完成。目前持续随访中,定期复查颞骨CT 平扫及颅脑MRI 平扫及增强序列等,2年未见复发迹象(图4)。

图4 术后2 年颞骨CT 平扫(A)及MRI 脂肪抑制增强T1WI(B:冠状位;C:轴位)均显示,右颞部未见明显复发迹象。Fig. 4 Postoperative 2-year temporal bone CT scan (A) and fat-suppressed enhanced MR T1WI(B:coronal view;C:axial view)showed no evidence of recurrence.
2 讨论
外耳道恶性肿瘤以鳞状细胞癌、腺样囊性癌多见,原发于外耳道的基底细胞癌(Basal cell carcinoma,BCC)非常少见,多发生于老年人,病因不明,早期多无明显症状,以耳内瘙痒起病,后出现慢性耳痛、血性耳漏和听力下降等[1]。BCC极易误诊、漏诊[2],原因在于:临床少见,医生缺乏认识及经验;病史长且发展缓慢,容易忽视;早期缺乏典型临床表现,容易与炎症、湿疹等混淆。因此,通过详细询问病史,仔细检查,对迁延不愈者及时活检以早期明确诊断,可减少误诊、提高预后[3]。本例中,首次术后长期不愈,即应及时活检明确病因。BCC临床分为结节溃疡型、色素型、硬斑瘤样或纤维型、浅表型等,因易发生继发感染和水肿,要注意钳取深部组织以提高阳性率。BCC极少发生淋巴结转移、累及腮腺,这点也体现在本例中,但术前颈部淋巴结及腮腺超声检查仍必不可少。此外,术前CT 和MRI可显示肿瘤部位及累及范围,对治疗方案制定有重要指导意义。
与其他颞骨恶性肿瘤相比,原发颞骨的BCC总体预后较好,5 年生存率和无瘤生存率分别为78%和77%[4]。多数学者推荐手术联合术后放疗的治疗策略,仅在手术禁忌时才行姑息放化疗。术前应根据临床表现和影像学评估确定肿瘤的范围,明确TNM 分期,准确评估病情,选择术式及治疗方案,判断预后。在已报道的多个外耳道恶性肿瘤分期系统中,由美国匹兹堡大学Moody等[5]于2000年基于外耳道鳞癌提出的分期系统得到较多认可,其将肿瘤侵袭局限于外耳道定为早期(T1、T2),推荐颞骨外侧切除;将肿瘤侵袭超过外耳道,包括周围软组织、中耳、乳突和中枢神经系统等,界定为晚期(T3、T4),推荐颞骨近全切除或全切除术,并行腮腺浅叶或全叶切除及颈廓清。本例分期据此为T4N0M0。
近些年来,外耳道恶性肿瘤的外科治疗较以往相比更为强调首次手术的根治性切除。文献报道,早期较局限的外耳道癌,经根治性手术切除, 超85%得到长期控制,但复发再手术则预后较差[6],而切除不彻底是造成局部复发的主要原因,因此尤其强调切缘阴性。此外,累及脑膜及面神经也显示出与较低生存率显著相关[5]。实际工作中会经常遇到一些情况,使选择术式及处理受累部位成为一件较困难的两难决定。例如本例,因首次手术未能彻底切除病灶而致局部复发,且破入鼓室累及中耳乳突甚至脑膜,按照上述匹兹堡分期推荐应行颞骨近全切或全切除,有可能达到根治、降低复发几率。但考虑到以下几点,最终选择扩大颞骨外侧切除术式(即在外侧切除范围基础上,将镫骨切除、包括耳囊在内的鼓室、乳突内壁黏膜骨质充分磨除至暴露正常骨质):1、BCC 恶性度低且对放疗较敏感[7];2、本例患者年龄较大且无面瘫及感音神经性聋;3、颞骨近全或全切可能带来严重功能障碍及致命并发症风险;4、鼓室、乳突内壁骨质未见明显破坏;5、基于外耳道鳞癌建立的匹兹堡分期,未必适用于肿瘤生物学特性差异显著的BCC。有报道称颞骨次全切除及全切并不能改善总体颞骨BCC 预后[4,5]。Moody[5]亦认为,侵入性肿瘤的根治性手术使硬脑膜受累的患者未必受益。对于本例鼓室天盖对应脑膜的处理,因无明确受累证据,且其范围小、程度轻,同时考虑到硬脑膜本身就是极好天然屏障,如将其切除修补,则有脑脊液漏及颅内感染之虞,且一旦复发将因失去屏障而直接累及颅内,因此本例仅行硬脑膜广泛烧灼,后期补充根治量放疗。对于术后放疗,研究提示辅助放疗可提高侵犯范围较广的T2-T4 期颞骨BCC 患者术后疗效[4,5]。通常肿瘤切缘及淋巴结阴性者给以辅助量放疗;切缘和/或淋巴结阳性者则给予根治量放疗。本例因中耳乳突病灶较广且脑膜受累,故术后给予根治量辅助放疗,控制良好,但仍需继续长期随诊观察其预后。最后,近年来通过阻断BCC 发病过程中的Hedgehog 信号通路的药物,如维妥昔单抗等已被用于治疗不能耐受或无法手术、肿瘤复发等患者[8],也很有应用前景,值得关注。
综上,颞骨BCC 罕发且恶性度低,如何选择术式及辅助放疗是一个值得深入思考和研究的问题,希望借本例引起领域内同道的重视,通过多中心研究制定出更具针对性、使患者最大受益的综合治疗策略。
