银杏内酯K通过抑制小胶质细胞介导的炎性反应保护髓鞘
2019-09-06张晓雪阴俊俊任思思韩庆贤于婧文李俊莲尉杰忠肖保国马存根
苗 强 ,张晓雪 ,阴俊俊 ,任思思 ,韩庆贤 ,于婧文 ,李俊莲 ,尉杰忠 ,肖保国 ,马存根 ,
(1.山西中医药大学国家中医药管理局多发性硬化益气活血重点研究室、神经生物学研究中心,山西晋中030619;2.山西大同大学脑科学研究所,中枢神经炎症变性疾病新药创制省市共建山西省重点实验室培育基地,山西大同037009;3.复旦大学附属华山医院,上海200025)
多发性硬化(Multiple sclerosis,MS)是一种自身免疫介导的炎性脱髓鞘疾病[1]。对于多发性硬化中医典籍尚无明确记载,当代医家对MS的辨证论治主要依据其临床症状,各自的认识也不尽相同。一般来说,MS的发病是在先天禀赋不足的基础上,受毒邪侵扰,导致络脉瘀阻,产生病变[2-3]。尽管MS的病因病机尚不完全清楚,但本虚标实是其基本的病理特征,本虚可见肾虚、气虚、气血两虚等虚证,标实则以络脉瘀阻为主[3-5]。血瘀证是 MS常见证型之一,活血可显著改善MS临床征象[6]。
活血化瘀通络是银杏叶的主要功效[7]。在中国,银杏叶提取物常被制成口服药片和胶囊或注射用针剂用于缺血性心脑血管疾病,如心绞痛和中风[8]。银杏内酯 K(Ginkgolide K,GK)是一种从银杏叶提取物中分离的萜类物质。研究发现,GK能有效减少缺血性脑卒中大鼠的脑梗死区域和脑水肿,改善神经功能缺损评分[9]。GK还可以通过激活肌醇需求酶1α/X盒结合蛋白通路保护心脏[10]。然而,目前还没有关于GK是否能够保护髓鞘的报道。
CPZ诱导的脱髓鞘常被用来模拟人类MS[11]。CPZ可选择性螯合线粒体复合体IV中的铜离子,导致成熟的少突胶质细胞因能量代谢紊乱而死亡,最终造成髓鞘脱失。目前,髓鞘保护或髓鞘再生的确切机制尚未完全阐明,市场也缺乏髓鞘保护或再生的治疗药物。因此,本研究利用CPZ诱导的脱髓鞘,探讨了GK在脱髓鞘疾病中的髓鞘保护能力和治疗潜力,并分析了其可能的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 24只雄性C57BL/6小鼠(10~12周龄),体质量20~25 g,购自北京维通利华实验动物有限公司,饲养于山西中医药大学清洁级动物实验室。实验开始前所有小鼠先适应性喂养1 w。
1.1.2 实验试剂 双环己酮草酰双腙(Cuprizone,CPZ)购于美国Sigma公司;抗髓磷脂碱性蛋白(MBP)抗体、抗诱导型一氧化氮合酶(iNOS)抗体和抗精氨酸酶1(Arg-1)抗体购自Abcam公司,抗Iba-1抗体购自日本Wako公司;肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)、白介素-10(IL-10)和转化生长因子-β(TGF-β)试剂盒购于R&D System;Alexa Flour 488标记的羊抗兔IgG和HRP标记的羊抗兔IgG购自康维公司。GK由江苏康缘药业股份有限公司友好提供。
1.2 实验方法
1.2.1 分组与给药 将小鼠随机分成正常组(Norma)l、CPZ组和GK组3组,每组8只。CPZ按0.2%(质量分数)的比例与饲料混合,CPZ组和GK组小鼠投食含CPZ的饲料,正常组投食普通饲料,累计6w。按10mg/mL的比例将GK用PEG400超声5min溶解,随后用生理盐水稀释到2μg/μL。CPZ喂食4 w后,GK组小鼠每只腹腔注射GK溶液200μL(20 mg/kg),CPZ组和正常组小鼠腹腔注射等体积的PEG400和生理盐水混合溶液,直到实验结束,累计2 w。
1.2.2 组织准备 每组一半小鼠用10%水合氯醛深度麻醉,并用生理盐水经心脏内灌注,然后用4%多聚甲醛固定。取出脑组织分别浸泡在浓度为15%、25%和30%的蔗糖溶液中梯度脱水,随后OTC包埋组织,使用低温切片机对脑组织进行切片,厚度为10μm。脑切片储存在-80℃的冰箱,用于免疫荧光染色。各组的另一半小鼠麻醉后,仅进行生理盐水心脏内灌注,分离脑组织并储存于-80℃的冰箱,随后进行组织匀浆用于Western blot和ELISA检测。
1.2.3 免疫荧光染色 首先从-80℃冰箱中取出脑组织切片室温复温30min,然后用1%BSA/PBS在室温下封闭30 min,洗净封闭液后分别添加兔抗 MBP(1∶500)和兔抗 Iba-1(1∶500)4 ℃孵育过夜,次日洗净一抗,按1∶1 000的比例添加山羊抗兔IgG,在室温下孵育2 h。随后洗净二抗,50%甘油封片。CPZ组参照上述步骤,但不添加一抗。用荧光显微镜获取免疫荧光图像,通过Image-Pro Plus 6.0软件进行分析和定量。
1.2.4 Western Blot检测 脑组织经 RIPA 裂解液裂解,BCA法测定蛋白浓度。用10%SDS-PAGE凝胶电泳分离蛋白,上样量为40μg。电泳条件为浓缩胶100 V 20min,分离胶150 V 40min。甲醇活化PVDF膜,随后用标准湿式转膜装置额定电流200mA转膜2 h。取出蛋白膜5%脱脂奶粉封闭,随后用抗 iNOS 抗体(1∶1 000)和抗 Arg-1(1∶1 000)抗体4℃孵育过夜,Tubulin作为内参。次日TBST洗膜后,用HRP标记的二抗室温孵育2 h,然后重复洗膜步骤,经化学发光显色液显色。
1.2.5 ELISA检测 ELISA实验采用双抗夹心法,根据试剂盒说明书操作,分别检测各组小鼠脑组织中 TNF-α、IL-1β、IL-6、IL-10 和 TGF-β 的浓度。
1.3 统计学方法
所有的实验结果都基于3次独立实验,数据分析运用GraphPad Prism 7软件。多组比较采用单因素方差分析(ANOVA),两两比较采用Tukey检验或者t检验。数据结果表示为均值±SEM,并设定P<0.05具有统计学意义。
2 结果
2.1 GK减少了CPZ导致的髓鞘脱失
MBP是髓鞘的主要蛋白成分,CPZ导致的小鼠脱髓鞘主要集中在脑胼胝体区。我们采用免疫荧光染色观察小鼠胼胝体区的MBP表达情况。结果显示,与正常组相比,CPZ组小鼠胼胝体区MBP 荧光强度显著降低(P<0.01),表明 CPZ 造成了小鼠严重的髓鞘脱失。而与CPZ组相比,GK组小鼠胼胝体区MBP荧光强度明显增加(P<0.05),这表明GK有效改善了CPZ诱导的髓鞘脱失,显示出对脱髓鞘疾病的治疗潜力。结果见图1。

图1 GK减少了CPZ诱导的脱髓鞘小鼠的髓鞘脱失
2.2 GK减少了小胶质细胞的活化
CPZ喂食6 w后,小鼠胼胝体中Iba-1+小胶质细胞的数量显著增加,GK组则明显下降。与正常小鼠相比,用CPZ喂养的小鼠胼胝体区Iba-1+小胶质细胞的数量增加(P<0.001)。相反,GK 明显抑制了胼胝体中Iba-1+小胶质细胞的数量(P<0.01)。表明小胶质细胞可能参与了中枢脱髓鞘病程。结果见图2。

图2 GK减少了CPZ诱导的脱髓鞘小鼠胼胝体小胶质细胞的活化
2.3 Western Blot检测 iNOS 和 Arg-1 的表达
活化的小胶质细胞可以分化为M1型和M2型,其中M1型主要表达iNOS,分泌促炎细胞因子;M2型主要表达Arg-1,分泌抗炎细胞因子。我们通过Western Blot法检测小鼠脑组织中iNOS和Arg-1的表达,观察小胶质细胞的亚型表达情况。结果显示,与正常组相比,CPZ诱导的脱髓鞘小鼠脑组织 iNOS 的表达明显升高(P<0.001),Arg-1 的表达明显下降(P<0.001);与 CPZ 组相比,GK降低了 iNOS 的表达(P<0.001),相反促进了 Arg-1的表达(P<0.001)。表明 GK 促进了活化的小胶质细胞向抗炎型分化。结果见图3。
2.4 ELISA检测各组小鼠脑组织中细胞因子的浓度
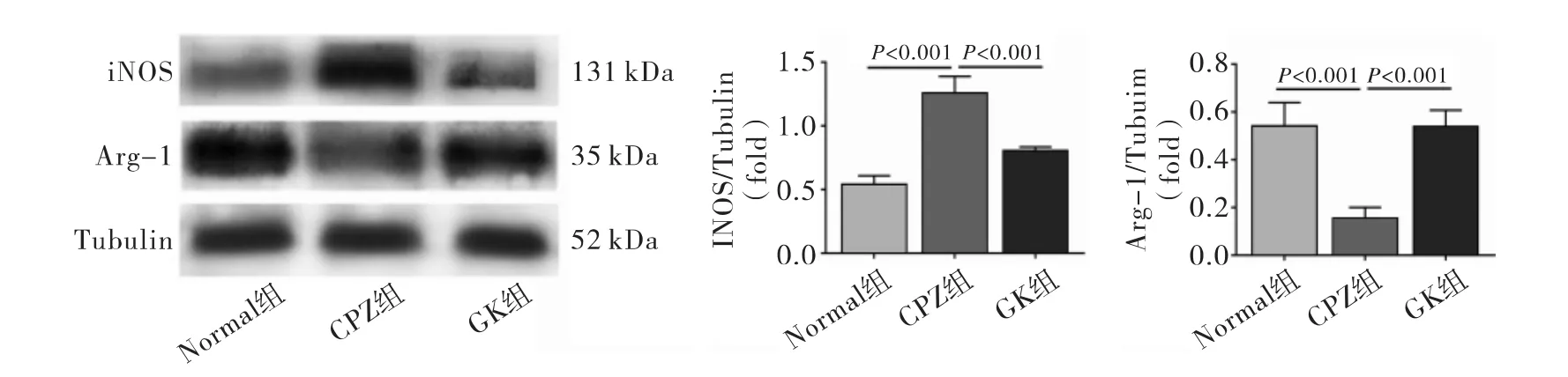
图3 GK对iNOS和Arg-1的影响
我们用ELISA法测量了小鼠脑组织中的炎性/抗炎细胞因子的浓度。与正常小鼠相比,CPZ组小鼠脑组织中炎性细胞因子IL-1β和IL-6的浓度明显增加(P<0.001),而GK显著地降低了IL-1β 和 IL-6 的浓度(P<0.01)。然而各组 IL-1β表达差异无统计学意义。此外,我们也检测了抗炎细胞因子IL-10和TGF-β的表达。与正常组相比,CPZ 组 IL-10 的表达明显降低(P<0.001),但TNF-α的表达差异无统计学意义。而与CPZ组相比,GK显著提升了IL-10和TNF-α的表达(P<0.001,P<0.05)。结果表明,CPZ 诱导的脱髓鞘伴随着明显的神经炎症,GK可以有效抑制CPZ导致的神经炎症。结果见图4。

图4 GK对CPZ诱导的脱髓鞘小鼠脑组织中促炎/抗炎细胞因子的影响
3 讨论
CPZ模型是一种常用的脱髓鞘动物模型,它反映了MS患者病理的基本特征,包括行为功能障碍和脱髓鞘[12]。少突胶质细胞和髓鞘形成细胞的丢失以及由此导致的髓鞘分解是MS的主要发病机制[13]。CPZ诱导的脱髓鞘伴随着显著的小胶质细胞活化和神经炎症反应,表明神经炎症与脱髓鞘关系密切。而GK的神经保护作用,不仅与减少髓鞘脱失有关,也与抑制小胶质细胞活化和神经炎症反应有关。
在本研究中,我们发现Iba-1+小胶质细胞的数量在喂食CPZ的小鼠胼胝体区大量增加,表明小胶质细胞的活化可能与少突胶质细胞的丢失和死亡有关[14]。一些研究表明,活化的小胶质细胞通过分泌各种细胞毒性分子加重神经炎症[15-16]。iNOS是M1型小胶质细胞的重要标志物,M1型小胶质细胞表达TNF-α和IL-6等炎性细胞因子,这些细胞因子导致了中枢神经系统炎性微环境的形成和少突胶质细胞的损伤[17-18]。免疫荧光染色、Western blot和ELISA的数据显示,GK有效地抑制了小胶质细胞的活化,下调了iNOS、TNF-α等炎性细胞因子,表明GK的有效性与抑制小胶质细胞活化及其介导的炎症反应有关,这都有利于减轻髓鞘损伤和促进髓鞘再生。然而,抑制小胶质细胞介导的炎症微环境是否与脱髓鞘的改善相一致仍需要进一步的研究。
