4-羟基-2,2,6,6-四甲基哌啶对糖尿病大鼠肾脏和脊髓p22phox的影响
2019-09-06王知平
王知平,胡 涛
(1.山西卫生健康职业学院,山西晋中030619; 2.山西省人民医院,山西太原030012)
糖尿病(Diabetes mellitus,DM)是临床常见慢性病之一,严重威胁患者生活质量和生存时间。由于我国居民寿命增长、起居变化、饮食改变等原因,糖尿病的患病率逐年猛增,国际糖尿病学会(IDF)研究表明,2017年我国糖尿病患病人数居全世界第一,为 1.14 亿,年龄调整患病率为 9.7%[1]。糖尿病患者的死亡原因是严重并发症的发展,并发症主要损害的是肾、神经、血管等器官和组织。其发病机制尚未完全清楚,但有研究表明其损伤与氧化应激引起的细胞凋亡、坏死有密切关系[2]。患有糖尿病,体内的高血糖、高血脂、血管紧张素Ⅱ等都可通过各种途径激活还原型辅酶Ⅱ(NADPH)氧化酶。NADPH氧化酶是活性氧自由基(Reactive oxygenspecies,ROS)产生的主要调控酶之一,可通过调控ROS的产生而参与糖尿病并发症的发生和发展[3]。p22phox是NADPH氧化酶的亚单位之一,可以代表其在细胞中的表达水平。
4-羟基-2,2,6,6-四甲基哌啶(tempol)能够清除ROS,但机制尚不明确。本研究创建糖尿病大鼠模型,旨在观察糖尿病氧化应激反应导致的主要并发症对大鼠肾脏和脊神经的损伤,以及用Tempol干预后,对大鼠肾脏、脊神经的保护作用以及对p22phox表达水平的影响,为临床研究糖尿病并发症发生发展和治疗提供一定的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SD大鼠成年健康雄性(山西医科大学实验动物中心,清洁级),体质量(250±25)g,许可证号:SCXK(晋)2014-0001。
1.1.2 实验试剂Tempo(l美国Sigma公司);一抗:p22pho(x兔抗大鼠)单克隆抗体,二抗:生物素标记(山羊抗兔)(美国USCN公司);三抗:辣根酶标记链霉卵白素、酶底物显色剂DAB(北京中杉金桥生物技术公司);PBS(磷酸盐缓冲液)0.01mol/L,PH7.4(博奥森生物技术公司);4%多聚甲醛溶液(自配);30%高糖溶液(自配);链脲佐菌素(STZ)(美国Sigma公司)。
1.1.3 实验仪器 冰冻切片机(LEICACM1850);BPH-9052电热恒温培养箱(杭州艾普仪器设备有限公司);DP27显微数码相机(Olympus Japen);超低温冰箱(美国Forma公司);三诺血糖仪(长沙三诺生物传感股份有限公司)。
1.2 实验方法
1.2.1 分组与造模 SD大鼠若干只(>30只)适应性饲养1 w后,参照文献[4]开始造糖尿病大鼠模型。造模成功后,随机分为糖尿病组和干预组,每组8只。另设正常对照组8只。
1.2.2 给药 造模成功后,配制10mg/mL的tempol生理盐水溶液。干预组每天按60 mg/kg灌胃tempol,正常对照组和糖尿病组每天灌胃等量生理盐水。3组大鼠实验期间均正常饮食。
1.2.3 组织收集和冰冻切片 饲养4 w,全部大鼠禁食12 h后称重麻醉并处死,用灌流针从心尖刺入,沿心腔插入升主动脉。先快速灌注生理盐水400mL冲出组织中的残留血液,再缓慢灌注4%的多聚甲醛400mL固定组织。灌注结束后精心取出固定好的肾、脊髓等组织器官,注意不要损坏,否则影响切片效果,特别是脊髓,由于脊柱包裹必须耐心用骨钳一点点剥离,留取肾交感神经主要传出的脊髓胸腰段这部分组织。把取出的组织器官先放入提前配好的4%多聚甲醛30min固定,再放入盛有30%蔗糖溶液的棕色瓶中过夜脱水,置于4℃冰箱保存备用。
冰冻切片机预冷30min,设置好冰台和冰刀的温度;从蔗糖溶液瓶中取出肾脏、脊髓,分别用OCT包埋剂包埋冻于冰台;精心切片,厚度为15μm,漂片法贴于多聚赖氨酸预处理的载玻片上,室温挥干,保存于-40℃冰箱待用。
1.2.4 免疫组化方法 严格按照免疫组化试剂说明书操作。切片出现黄棕色产物时,停止反应,梯度酒精脱水,二甲苯透明,中性胶封片,37℃烘干,数码显微拍照,统计结果。脊髓切片由于结构在显微镜下不明显,所以用苏木素复染。
1.2.5 观察指标评价 ①阳性细胞:细胞膜呈现棕黄色圆圈或线条。②阳性细胞百分率:每张切片以逆时针顺序,同等条件下取5个40倍视野,分别计算各个视野阳性细胞的百分率,再计算平均值,得出每只大鼠的阳性细胞百分率,再进行统计分析。③阳性强弱评价:以阳性细胞的百分率评价,≥60%为强阳性(+++)、31%~59%为中阳性(++)、6%~30%为弱阳性(+)、<5%为阴性(-),过表达水平为强中阳性。
1.3 统计学方法
数据分析应用SPSS20.0统计学软件处理,计量资料用均数±标准差(±s)表示,组间比较用LSD法检验,以P<0.05为差异有统计学意义。
2 结果
与正常对照组比较,糖尿病足和干预组肾阳性细胞核脊髓阳性细胞百分率明显升高,差异有统计学意义;与糖尿病组比较,干预组肾阳性细胞和脊髓阳性细胞百分率明显降低,差异有统计学意义;经LSD法两两比较,3组之间的肾组织和脊髓阳性细胞百分率比较差异有统计学意义(P<0.05)。结果见表1。由免疫组化显微数码照片可知,空白对照组大鼠肾和脊髓的p22phox为阴性表达,镜下细胞膜上罕见棕色线条或颗粒,无棕色线圈;糖尿病组为强阳性表达,镜下随处可见有棕黄色颗粒、线圈或线条,色彩明显。干预组为弱阳性表达,镜下散在分布棕黄色颗粒或线条,色彩较淡。因此可知p22phox在正常大鼠的肾和脊髓细胞中表达水平很低,当大鼠患糖尿病后,高血糖启动氧化应激反应,诱导p22phox大量产生,使用Tempol干预,p22phox为弱阳性表达,说明tempol可以抑制DM大鼠p22phox的生成。结果见图1~图2。

图1 大鼠肾脏p22phox的表达

图2 大鼠脊髓p22phox的表达
表1 各组大鼠肾和脊髓阳性细胞百分率的比较 (±s)
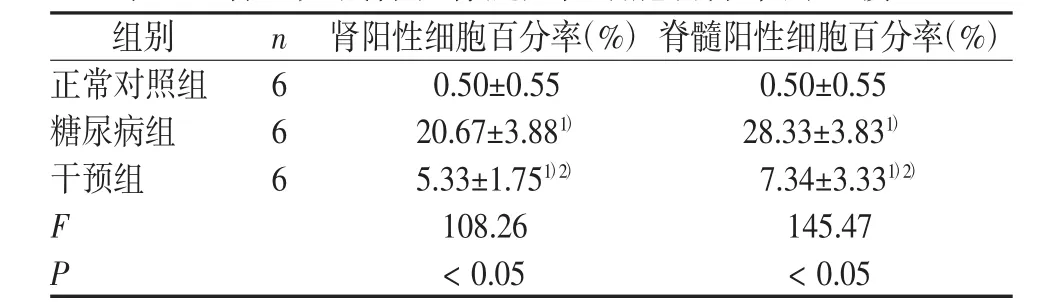
表1 各组大鼠肾和脊髓阳性细胞百分率的比较 (±s)
注:与正常对照组比较,1)P<0.05;与糖尿病组相比,2)P<0.05
?组别 n 肾阳性细胞百分率(%)脊髓阳性细胞百分率(%)正常对照组 6 0.50±0.55 0.50±0.55糖尿病组 6 20.67±3.881) 28.33±3.831)干预组 6 5.33±1.751)2) 7.34±3.331)2)F 108.26 145.47 P< 0.05 < 0.05
3 讨论
糖尿病时肾组织和脊髓氧化应激损伤发生的途径众多,其中高糖是最主要的诱因,诱导细胞生成ROS,ROS激活细胞内的蛋白激酶C、蛋白激酶使转录因子核因子κb及活化蛋白-1活化,启动细胞因子及生长因子的转录,导致糖尿病并发症的发生及病情进展[5]。
进入胞内的葡萄糖怎样诱发ROS的原因目前还不清楚。但已知ROS主要来自于NADPH氧化酶,NADPH 氧化酶由 p22phox、gp91phox、p47phox和p67phox等亚基组成,前两种在细胞膜表达,后两种在细胞浆表达。不同器官NADPH氧化酶的构成不同,肾脏和脊髓细胞含有p22phox、p47phox和p67phox。NADPH氧化酶调控肾脏和脊髓细胞ROS的生成增多,诱发氧化应激,参与DM并发症发生[6]。氧化反应会引起机体的应激调节,最关键的调节方式就是交感神经兴奋,他们有着紧密关联[7]。由于交感神经发自脊髓,可能在脊髓有NADPH氧化酶表达,因此取脊髓交感神经传出部位实验。
DM大鼠肾脏p22phox表达强阳性,提示NADPH氧化酶的增多,ROS氧化应激增强;脊髓的p22phox的表达增加,表示DM大鼠脊髓NADPH氧化酶含量增多,氧化能力增强。可外周组织和中枢神经的氧化应激具体有何种关联还有待下一步研究。Tempol是ROS的清除剂,通过抑制自由基的产生,增强机体的抗氧化能力来减少氧化损伤。干预组大鼠肾脏和脊髓的p22phox表达降低,提示Tempol能使DM大鼠肾和脊髓的p22phox表达降低,减轻氧化应激对肾组织和脊髓的损伤,有一定的保护作用,它不仅是ROS的清除剂,而且对NADPH氧化酶也有一定的抑制作用。
