野百合碱诱导的大鼠肺动脉高压对大鼠肺Hippo信号通路相关分子表达的影响*
2019-07-25赵旭勇姜文兵
朱 宁, 陈 皓, 赵旭勇, 赵 玮, 姜文兵, 王 毅
(温州医科大学温州市第三临床学院, 温州市人民医院心血管内科, 浙江 温州 325000)
动脉性肺动脉高压(pulmonary arterial hypertension,PAH)是肺动脉高压(pulmonary hypertension,PH)的一个亚型,以肺小动脉重塑为特征,导致肺血管阻力增加和肺动脉压增高[1]。PAH是一种进行性发展的疾病,最终导致右心室衰竭和死亡。据报道,PAH在成人中约为每百万人中有12~50万人最终死亡。肺动脉重构主要是由于平滑肌细胞的异常生长、过度增殖和抗凋亡能力减弱所致[2]。因此,抑制肺小动脉平滑肌细胞(pulmonary arteriole smooth muscle cells,PASMCs)增殖或诱导平滑肌细胞凋亡是PAH的有效治疗策略。研究调控PASMCs增殖和凋亡的关键分子,能为PAH的防治提供有效的药物靶点。
近20年的多模型生物研究已经确立了Hippo通路作为器官大小和组织稳态的关键调控信号途径。通过抑制Hippo通路下游的Yes相关蛋白(Yes-associated protein,YAP)和tafazzin (TAZ),Hippo途径能够调节细胞增殖、凋亡和干性[3]。目前许多研究已经表明Hippo通路的失调对肿瘤的发展有重要影响[4]。在心血管疾病方面,Hippo通路也受到了越来越多的重视。但尚无研究表明Hippo通路在PAH中的表达情况以及探讨可能的作用。 因此,本实验通过观察野百合碱(monocrotaline,MCT)诱导的PAH大鼠肺Hippo通路相关蛋白的表达,探讨Hippo通路在PAH发生发展中可能的作用和机制。
材 料 和 方 法
1 试剂
MCT购自Sigma;抗YAP、TAZ、PCNA、GAPDH和TEAD抗体以及鼠和兔 II 抗均购自Cell Signaling Technology;牛血清白蛋白(bovine serum albumin,BSA)购自Sigma;HE及Masson染色试剂盒购自北京索莱宝科技有限公司;TRIzol 购自国药集团化学试剂有限公司;AMV逆转录试剂盒购自Promega;PCR 引物购自TaKaRa;BCA蛋白检测试剂盒及3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)购自碧云天公司。
2 方法
2.1动物模型与分组 45只健康雄性 SD 大鼠购自上海动物实验中心,合格证编号为SCXK (浙) 2008-0033。随机分为 2组:对照组(control组,n=15)和模型组(model组,n=30)。造模组所有大鼠给予一次性颈部皮下注射 60 mg/kg MCT(将 0.2 g MCT 溶解于1 mol/L HCl中,加入1 mol/L NaOH调整pH至7.2~7.4,生理盐水定容至10 mL);对照组大鼠注射等量的生理盐水。
2.2血流动力学和心室肥厚检测 MCT 注射造模4 周后,称量2组大鼠体重(body weight,BW),水合氯醛(4 mL/kg)腹腔注射麻醉,连接压力换能器,将微导管(PE50)沿着大鼠颈外静脉插入右心室,此时可见振幅较大的右心室波,并记录右心室收缩压(right ventricular systolic pressure,RVSP)。处死动物后取出心肺组织,去除心房及大血管,分离右心室和左心室以及室间隔,滤纸吸干组织并称重,计算右心室肥厚指数(right ventricular hypertrophy index,RVHI)=RV/(LV+S);计算右心室质量指数(right ventricular mass index,RVMI;mg/g)=RV/BW。肺组织标本一部分迅速存放于液氮中,后于-80 ℃冻存,剩余部分用福尔马林固定。
2.3肺小动脉重构的检测 肺组织石蜡切片常规脱蜡至水,HE染色,脱水透明后,中性树胶封片,显微镜选取肺小动脉(直径50~200 μm)观察形态变化。 采集图像后采用ImageJ软件分析,根据公式计算中膜厚度百分比:M/E%(medial thickness/external diameter)=中膜厚度/外径×100%。Masson染色同样参照说明书,肺组织石蜡切片常规脱蜡至水,依次在Masson染液进行染色,中性树脂封片。光镜下观察蓝色的胶原纤维。
2.4Western blot检测蛋白表达 从-80 ℃冰箱取出肺组织,生理盐水漂洗,滤纸吸干,每只称量0.1 g,RIPA 裂解液裂解,静置30 min后离心取上清,BCA法测定蛋白浓度。经过SDS-PAGE,半干式法转膜,BSA封闭,放入相应的 I 抗4 ℃冰箱过夜,经漂洗,最后用辣根过氧化物酶标记的 II 抗孵育。FluorChem FC3凝胶成像系统摄像并分析,检测条带灰度值。GAPDH作为内参照,统计数据做归一化处理。
2.5免疫组织化学染色检测蛋白表达 肺组织石蜡切片常规脱蜡至水,过氧化氢(30 g/L)封闭10 min去除内源性过氧化物酶活性,PBS孵育3次,每次5 min,置于有柠檬酸钠液高压锅中煮沸修复抗原,PBS孵育3次,每次5 min,37 ℃ 用I 抗孵育1 h,滴加生物素标记的 II 抗,37 ℃孵育30 min,PBS孵育3次,每次5 min,DAB显色剂显色1~2 min。苏木精复染细胞核,脱水透明后,中性树胶封片。光镜下观察蛋白的表达。
2.6RT-qPCR检测mRNA表达 所用引物参照已发表文献,序列见表1。TRIzol法提取肺组织总RNA,提取总RNA,20 μL 体系中进行反转录为cDNA,50 μL体系中进行扩增。反应完成后,软件将自动分析所有标本的记录曲线,计算出Ct值。GAPDH作为内参照,统计数据做归一化处理。
表1 RT-qPCR 实验所用YAP、 TAZ、 TEAD 和 GAPDH的引物序列
Table 1.The primer sequences of YAP, TAZ, TEAD and GAPDH for RT-qPCR

NameSequence (5’-3’)YAPForward: TACACCCACAGCTCAGCATCReverse: GCCATGTTGTTGTCTGATCGTAZForward: GGAGAGAGAAAGGATTCGAATGCReverse: TGTCGACAGAGGGCAGCTTTEADForward: CCACCAAAGTTTGCTCCTTTGGGAReverse: ACTTCAAACACACAGGCCATGCAGGAPDHForward: GCAGATTACCAGCCAACGTCAReverse: CGCCAGTAGACTCCACGACATA
3 统计学处理
所有实验数据用SPSS 22.0 软件进行统计分析。实验结果均以均数±标准差(mean±SD)表示。组间比较用非配对t检验。以P<0.05 为差异有统计学意义。
结 果
1 造模大鼠存活率
4周时实验组30只大鼠中 11只因病重死亡,2只麻醉后死亡,最终存活大鼠 17 只,存活率为 56.6%,基本与之前的文献报道符合。对照组全部大鼠没有死亡。
2 血流动力学和心室肥厚的比较
与对照组相比,模型组大鼠体重增长明显不如对照组,而且RVSP、RVHI 和 RVMI均显著增高(P<0.01),提示 PAH 造模成功,见表2。
表2 右心室收缩压、右心室肥厚指数和右心室质量指数的结果
Table 2.The results of RVSP, RVHI and RVMI (Mean±SD.n=6)

GroupRVSP (mmHg)RVHI (%)RVMI (%)Control19.90±1.9229.08±2.280.61±0.01Model58.26±6.01∗∗64.96±4.93∗∗1.68±0.17∗∗
**P<0.01vscontrol group.
3 肺小动脉重构的检测
HE染色结果显示模型组中小肺动脉血管内中膜和外层纤维层均明显增厚,管腔显著狭窄,甚至可见血管腔几乎完全闭塞等血管丛样改变,见图1。造模组M/E%明显大于对照组(P<0.01),见图2。Masson染色结果显示模型组血管外层代表胶原纤维的蓝色明显多于对照组,见图1。
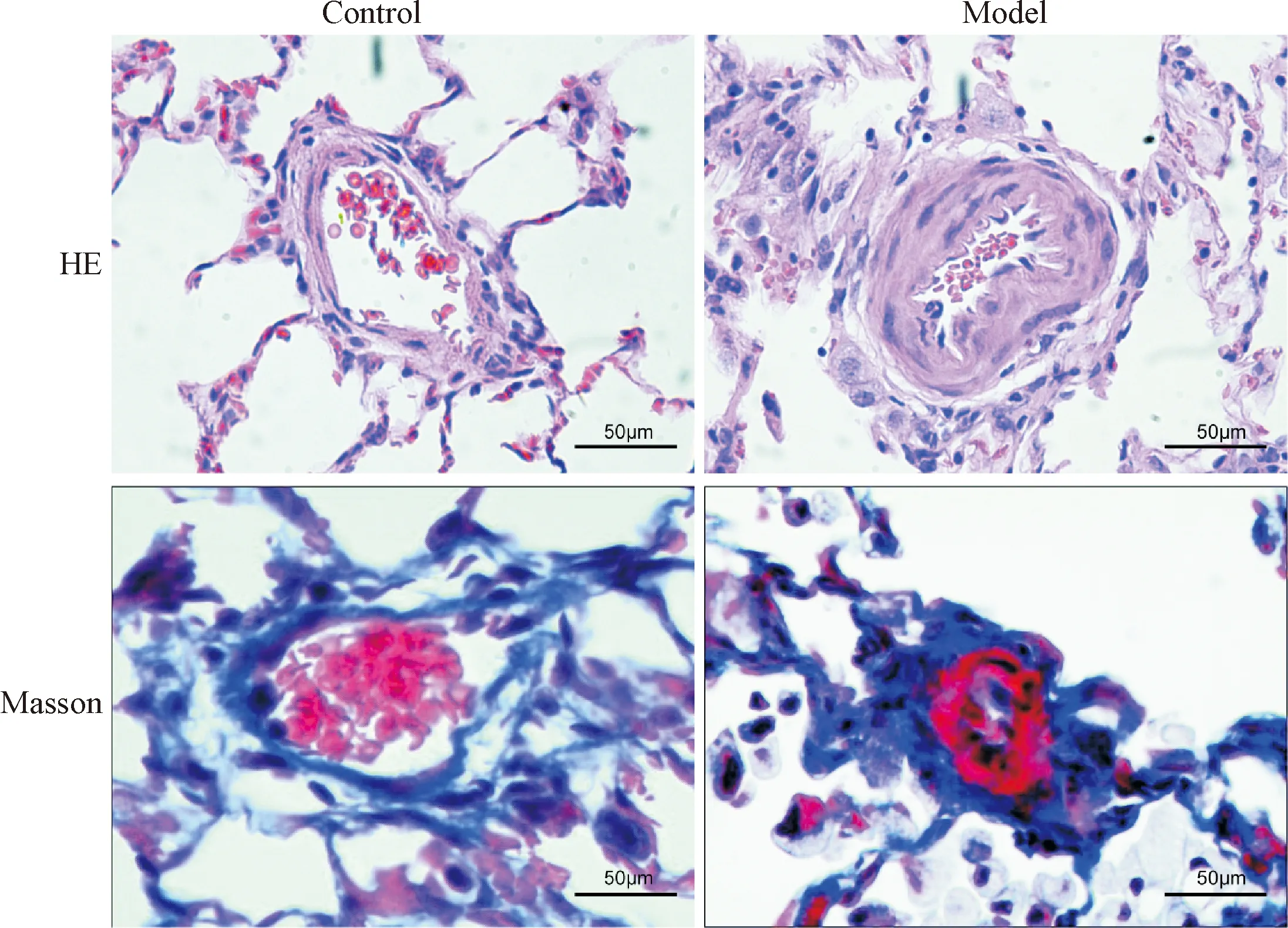
Figure 1.Observation of pulmonary arterial remodeling by HE staining and Masson staining (×400).
图1 HE染色观察肺动脉重构的病理变化
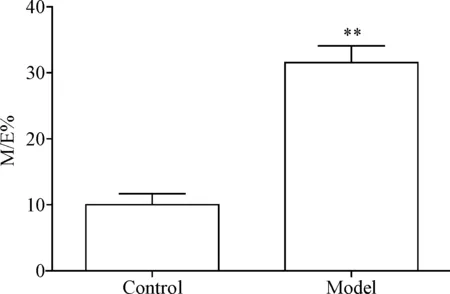
Figure 2.The quantitative analysis of M/E% in the pulmonary arterioles. Mean±SD.n=6.**P<0.01vscontrol group.
图2 肺动脉中膜厚度/外径百分比的定量分析
4 Hippo信号通路相关分子的检测
免疫组化实验结果显示, YAP、TAZ和TEAD蛋白主要在肺小动脉中层及外层中表达,并且明显多于对照组,见图3。同时Western blot及RT-qPCR结果提示全肺组织YAP、TAZ和TEAD蛋白及mRNA水平都明显高于对照组(P<0.05),见图4及表3。
讨 论
本研究通过给予MCT诱导大鼠PAH模型的建立,4周后大鼠RVSP显著升高,RVHI和RVMI明显增加,肺小动脉增厚,说明成功建立了PAH模型。Masson染色提示肺组织纤维化炎症。与对照组相比,免疫组化染色染色结果提示肺小动脉的YAP、TAZ和TEAD蛋白显著上调,在中层及外层均有明显表达,Western blot和RT-qPCR结果显示肺组织的YAP、TAZ和TEAD蛋白和mRNA也明显升高。这提示Hippo信号通路可能促进PASMCs增殖以及肺小动脉重构,进而参与PAH的发生发展过程。
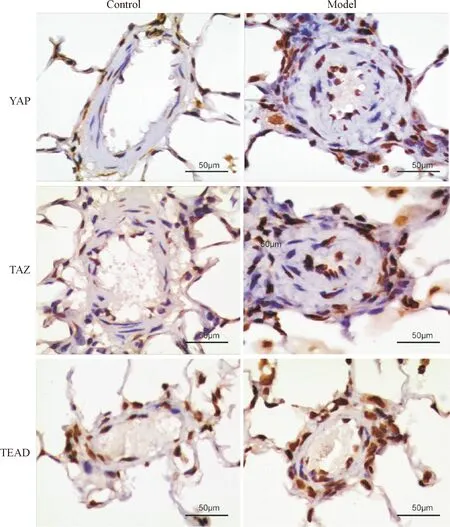
Figure 3.The results of YAP, TAZ and TEAD expression in the pulmonary arterioles detected by immunohistochemical staining (×400).
图3 肺动脉YAP、TAZ和TEAD的免疫组化染色结果
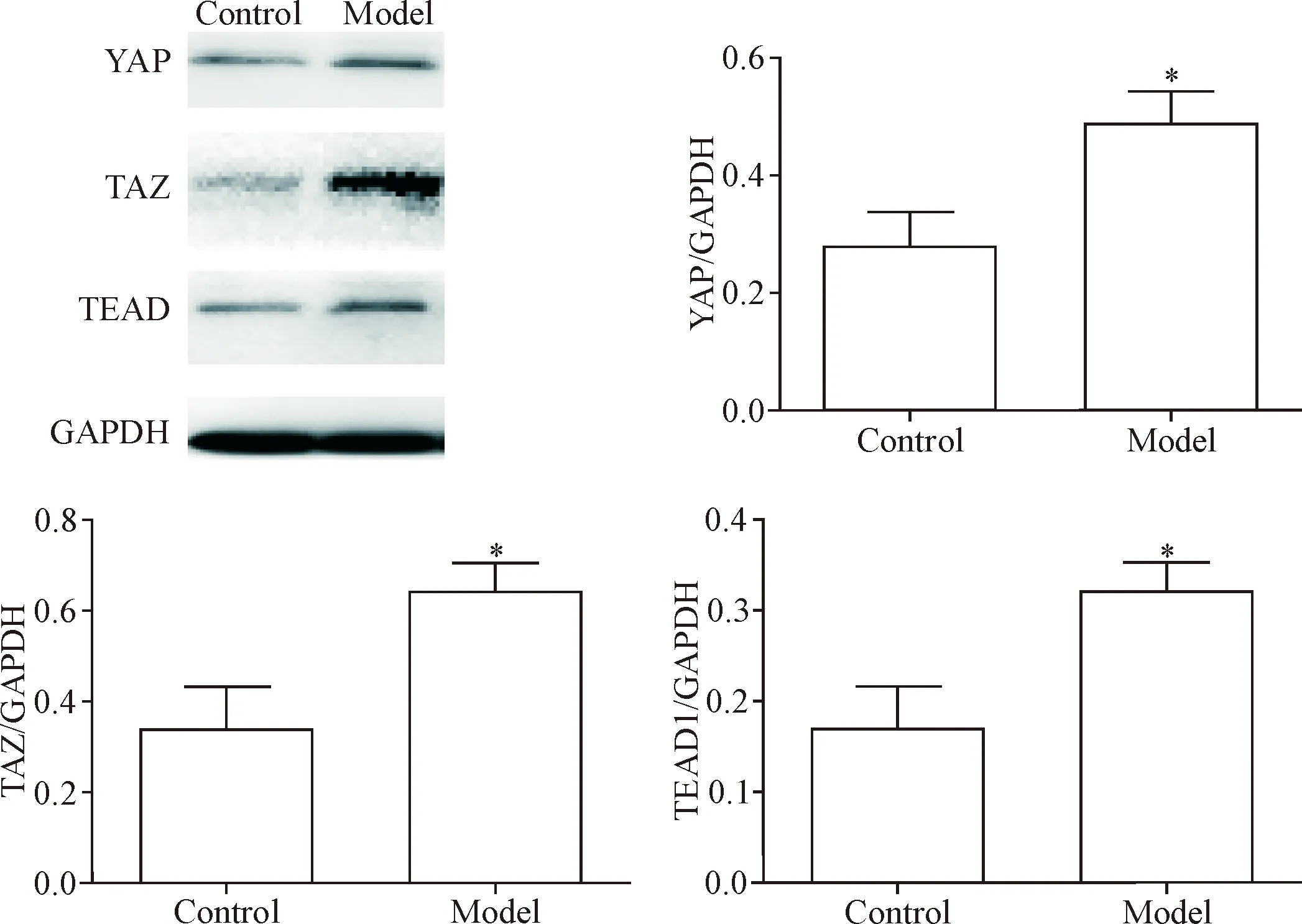
Figure 4.Western blot was used for determining the protein expression of YAP, TAZ and TEAD in the lung tissues. Mean±SD.n=8.*P<0.05vscontrol group.
图4 Western blot检测肺组织中YAP、TAZ和TEAD蛋白的表达
表3 YAP、 TAZ和TEAD的mRNA水平
Table 3.The mRNA levels of YAP, TAZ and TEAD (Mean±SD.n=8)

GroupYAPTAZTEADControl0.46±0.030.39±0.020.28±0.02Model0.79±0.06∗0.58±0.05∗0.48±0.04∗
*P<0.05vscontrol group.
PAH的主要特点是肺血管阻力增加,导致右心室肥厚(right ventricular hypertrophy,RVH)和最终的右心衰竭。在所有类型的PAH中,肺血管阻力增加的主要病理改变是肺动脉重塑,这主要归因于PASMCs的过度增殖和受损的细胞凋亡[5]。目前来说前列环素、内皮素和5型磷酸二酯酶抑制剂能提高PAH患者生活质量和改善临床症状,但是仍然无法提高长期获益以及改善生存率[6]。这些药物疗效的局限性通常是因为它们的作用机制主要是舒张肺小血管,尚不能真正改善血管重构。因此研究靶向PASMCs增殖的信号分子将为PAH患者带来改善生存率的治疗药物。
多细胞生物的出现是一个进化的里程碑。支持多细胞性的最基本机制是确保组织和器官的适当大小和形状以满足功能性需求。近年的研究揭示Hippo通路在器官大小的控制上具有重要的作用。Hpo、SAV、WTS和MAT在基因和生理上相互作用,其突变引起显著的器官增大的表型在其他已建立的发育信号途径中是前所未有的;因此,它们被归类为一种新的信号转导模块:以河马的巨大体型命名的Hippo信号通路。转录共激活剂YAP和TAZ在许多细胞类型的生长调节中有关联。YAP/TAZ是Hippo途径中进化保守的关键效应因子,目前认为正是YAP/TAZ通过调节基因转录来介导Hippo途径的生物学功能。YAP同源物在果蝇中的过度表达导致了蝇类椎间盘的过度生长[7],而过度表达YAP的转基因小鼠产生多个肿瘤[8]。同样,一些研究已经将YAP旁系TAZ的表达与许多细胞类型的生长调节有关。虽然YAP和TAZ可以与多个转录因子相互作用,但它们促进生长的作用主要通过与转录因子TEAD家族成员的相互作用来介导。例如,沉默TEAD能阻断大部分YAP诱导的基因表达,并在很大程度上减弱YAP诱导的过度生长表型。此外,TEAD1/2基因缺失小鼠的表型类似于YAP基因缺失的小鼠[9]。同样地,在果蝇中TEAD同源物介导YAP同源物过度生长的表型[10]。
越来越多的研究显示Hippo通路在心血管疾病中的重要作用,特别是对平滑肌细胞的调节作用。之前的研究已经表明,YAP促进VSMC增殖的表型以及正向调控了小鼠颈动脉球囊损伤[11]。YAP在小鼠心血管系统中的缺失导致胚胎致死,而YAP条件敲除小鼠表现为胚胎血管平滑肌细胞增殖受限,导致严重的血管异常,包括血管壁变薄和头臂动脉的短或缺失[12]。YAP通过与心肌蛋白(myocardin)的作用也能调节平滑肌细胞的表型转换[13]。最近的研究表明YAP和TAZ共同通过TEAD促进毛喉素介导的人主动脉平滑肌细胞的增殖[14]。
虽然Hippo通路中关键效应分子YAP和TAZ已经充分被证明在平滑肌细胞增殖以及平滑肌细胞参与的心血管疾病模型中的作用,但是尚没有研究表明它们在PAH中的作用。我们的研究结果提示YAP、TAZ和TEAD在野百合碱诱导的PAH大鼠肺小动脉中高表达;并且我们还发现这些蛋白分布于中层和外层,说明它们同时也促进血管外层成纤维细胞的增殖。研究结果说明Hippo通路中的YAP和TAZ可能通过TEAD介导PASMCs以及成纤维细胞的增殖,从而促进肺小动脉的重构,最终导致了PAH的形成。目前尚缺乏YAP和TAZ有效且安全的抑制剂,野百合碱诱导的PAH大鼠模型可作为为进一步靶向药物研究的实验载体。YAP、TAZ亦或是TEAD有望成为肺动脉高压治疗的新途径。
