miR-489-3p靶向负调控BDNF并抑制PC12细胞增殖*
2019-07-25刘得水李丽波兴桂华高志影
刘得水, 吴 雪, 李丽波, 兴桂华, 高志影△
(齐齐哈尔医学院 1医药科学研究院, 2附属第二医院耳鼻喉科, 黑龙江 齐齐哈尔 161006)
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经生长因子家族的重要成员之一,它广泛分布于中枢神经系统,可以调控脑的神经发育、突触传递和神经突触可塑性,影响脑的认知、学习和记忆[1],参与神经内分泌反应和情绪调节[2]。在人类和啮齿类动物模型中,BDNF功能紊乱与一些神经系统紊乱有关,如抑郁症[3]、老年痴呆[4]和亨廷顿舞蹈症[5]等,但是BDNF的调控仍然有很多未知之处。BDNF对神经发育和多种神经系统疾病发生的病理过程至关重要,因此,探究BDNF的精准表达调控具有重要意义。
调控BDNF表达的机制非常复杂,它的转录过程通过多种启动子驱动不同编码转录产物来调节,然而BDNF表达的转录后水平调节也日益受到研究者的关注。微小RNA(microRNA,miRNA,miR)是长约19~23个核苷酸的非编码RNA,与靶mRNA的3′-非翻译区(3′-untranslated region,3′-UTR)部分序列反向互补结合,对靶基因的转录后水平进行负性调控[6]。本课题组前期研究通过生物信息分析软件预测发现miR-489-3p可以靶向结合BDNF的高度保守区序列,并且接近BDNF 3′-UTR的末端。miR-489-3p在中枢神经系统广泛表达,与神经系统疾病具有密切关系[7]。本项目旨在探究miR-489-3p是否是可以靶向调控BDNF,以期进一步深入理解BDNF的表达调控机制。
材 料 和 方 法
1 细胞株
大鼠嗜铬细胞瘤PC12细胞购自中科院上海细胞库。
2 主要试剂
DMEM/F12培养基和灭活胎牛血清购自HyClone;Lipofectamine 2000 购自Invitrogen;Taq酶、Reverse Transcriptase XL和dNTP Mixture购自TaKaRa;Luciferase Assay System购自Promega; 兔抗BDNF单克隆抗体(ab108319)购自Abcam;鼠抗GAPDH(sc-47724)单克隆抗体和HRP标记的山羊抗兔IgG购自Santa Cruz。miR-489-3p mimic、 mimic control、miR-489-3p inhibitor和inhibitor control由吉玛公司合成,序列见表1。Luciferase质粒和RT-qPCR引物由金斯瑞公司根据设计合成,序列见表2和表3。

表1 合成miRNA的序列
3 主要方法
3.1转染实验 转染前1 d,接种1×105个细胞至24孔板中。细胞密度长至60%~70%融合度时进行转染。配制Opti-MEM培养基+Lipofectamine 2000溶液;用Opti-MEM培养基稀释重组质粒、miR-489-3p mimic和miR-489-3p inhibitor,轻轻混匀,室温放置20 min。弃掉原培养液,加入Opti-MEM培养基,并将上述混合液逐滴加入培养液中,6 h后换液,置于37 ℃、含5% CO2的培养箱内培养,进行后续实验。

表2 Luciferase报告基因质粒序列

表3 RT-qPCR引物序列
3.2Luciferase报告基因检测 从NCBI上查找BDNF mRNA的3′-UTR序列及结合位点并设计BDNF 3′-UTR引物,构建BDNF 3′-UTR野生质粒(WT)和突变质粒(Mut)。细胞转染24 h后,收集细胞,裂解细胞,提取蛋白。加入底物,迅速混匀。在生物发光分析仪上测定萤火虫萤光素酶和海肾萤光素酶的发光强度,以两者的比值为相对萤光素酶活性。
3.3RT-qPCR实验 采用TRIzol一步法提取细胞总RNA,紫外分光光度法测定RNA的浓度及纯度。逆转录,使用TaqMan探针法检测miR-489-3p,SYBR Green嵌合荧光法检测BDNF的mRNA水平,进行RT-qPCR检测,保存结果并分析。采用比较Ct值定量方法进行相对定量,公式为2-ΔΔCt,其中ΔΔCt=(Ct目的基因-Ct看家基因)实验组-(Ct目的基因-Ct看家基因)对照组。
3.4Western blot检测 收集细胞,冰上裂解细胞20 min,12 000 r/min离心20 min,取上清。采用SDS-PAGE测定,每孔道加50 μg蛋白,用积层胶和分离胶电泳,将蛋白转移到硝酸纤维素膜上。用抗BDNF和抗GAPDH抗体孵育4 ℃过夜,相应的 II 抗孵育,增强化学发光法显色。
3.5CCK-8法检测细胞活力 转染6 h细胞换液后,分别于12 h、24 h、36 h、48 h和60 h加入CCK-8试剂,反应2 h,酶标仪测吸光度(A)值。每组实验重复3次。
3.6EdU实验检测细胞增殖能力 转染后24 h,细胞消化下来,接种于48孔板中,培养至密度70%~90%;制备适量50 μmol/L EdU培养基;50 μmol/L EdU培养基孵育12 h,弃培养基;PBS洗细胞。4%多聚甲醛固定,甘氨酸孵育5 min,弃甘氨酸溶液,PBS洗;0.5% Triton X-100孵育10 min,PBS洗。Apollo染色,避光、室温孵育30 min后;0.5% Triton X-100洗2次;甲醇洗2次;PBS洗。DAPI避光孵育10 min,弃染色反应液;PBS洗。采集图片,数据分析。
4 统计学处理
采用SPSS 18.0软件进行分析,数据以均数±标准差(mean±SD)表示,组间比较采用Student’st检验或单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 BDNF 3′-UTR 和miR-489-3p结合位点之间的相互作用
通过RNAhybrid和TargetScan软件预测发现BDNF 3′-UTR 有2个miR-489-3p结合位点,见图1。RNAhybrid软件计算出其结合自由能预测值分别为-21.5和-18.3 kcal/mol。
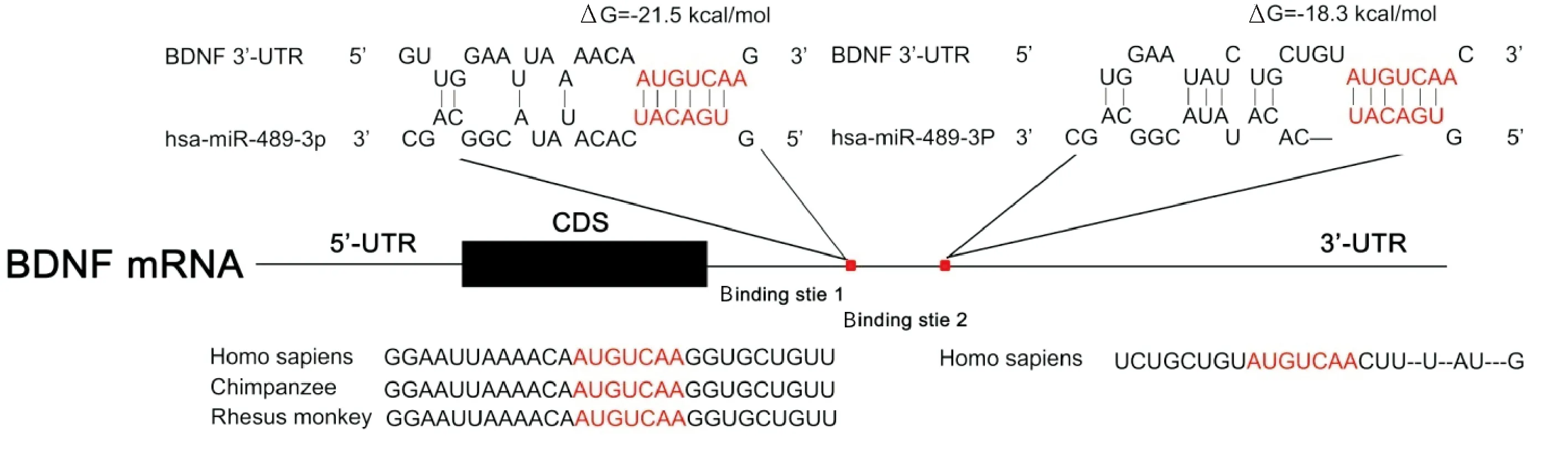
Figure 1.Schematic description of the hypothetical duplexes formed by the interactions between the binding site in the BDNF 3′-UTR and miR-489-3p. The miR-489-3p seed sequence and the seed sequence-binding sites in the BDNF 3′-UTR are indicated in red.
图1 生物信息学预测miR-489-3p靶向结合BDNF 3′-UTR
2 双萤光素酶报告基因实验验证miR-489-3p靶向结合BDNF的3′-UTR
体外转染增殖期PC12细胞24 h后,与对照组比较,转染BDNF 3′-UTR萤光素酶报告基因质粒和miR-489-3p mimic的PC12细胞萤光素酶活性显著降低(P<0.05);转染BDNF 3′-UTR萤光素酶报告基因质粒和miR-489-3p inhibitor的PC12细胞萤光素酶活性显著升高(P<0.01);转染BDNF 3′-UTR萤光素酶报告基因突变质粒和 miR-489-3p mimic或miR-489-3p inhibitor的PC12细胞萤光素酶活性的差异并无统计学显著性(P>0.05),见图2。
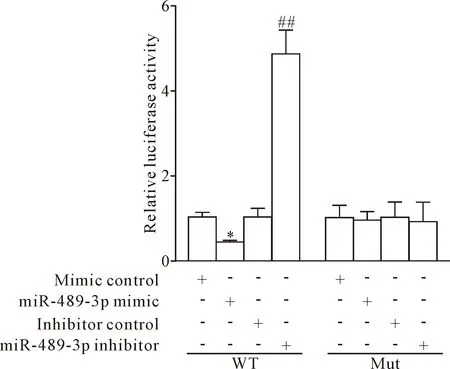
Figure 2.The relative luciferase activity in PC12 cells transfec-ted with wild-type (WT) or mutant (Mut) BDNF luciferase plasmid and with equal doses of mimic control, miR-489-3p mimic, inhibitor control or miR-489-3p inhibitor. Mean±SD.n=3.*P<0.05vsmimic control group;##P<0.01vsinhibitor control group.
图2 双萤光素酶报告基因实验检测PC12细胞萤光素酶活性的变化
3 miR-489-3p在转录后水平靶向调控BDNF表达
我们将人工合成的 miR-489-3p mimic和miR-489-3p inhibitor分别转染到PC12细胞,结果显示,转染miR-489-3p mimic显著提高PC12细胞的miR-489-3p水平(P<0.01),而转染miR-489-3p inhibitor显著降低了PC12细胞的miR-489-3p水平(P<0.01),见图3A。过表达或抑制miR-489-3p对BDNF的mRNA表达水平并未见显著影响(P>0.05),见图3B。与预期相似,当miR-489-3p过表达时,BDNF的蛋白表达水平显著下调(P<0.01),而转染miR-489-3p inhibitor使BDNF的蛋白表达水平上调(P<0.05),见图3C。
4 转染miR-489-3p mimics和anti-miR-489-3p inhibitor对PC12细胞增殖能力的影响
采用CCK-8法检测PC12细胞活力,结果显示,体外转染 miR-489-3p mimics的PC12细胞活力显著低于对照组(P<0.01),而转染anti-miR-489-3p inhibitor的PC12细胞活力则显著高于对照组(P<0.05),见图4。
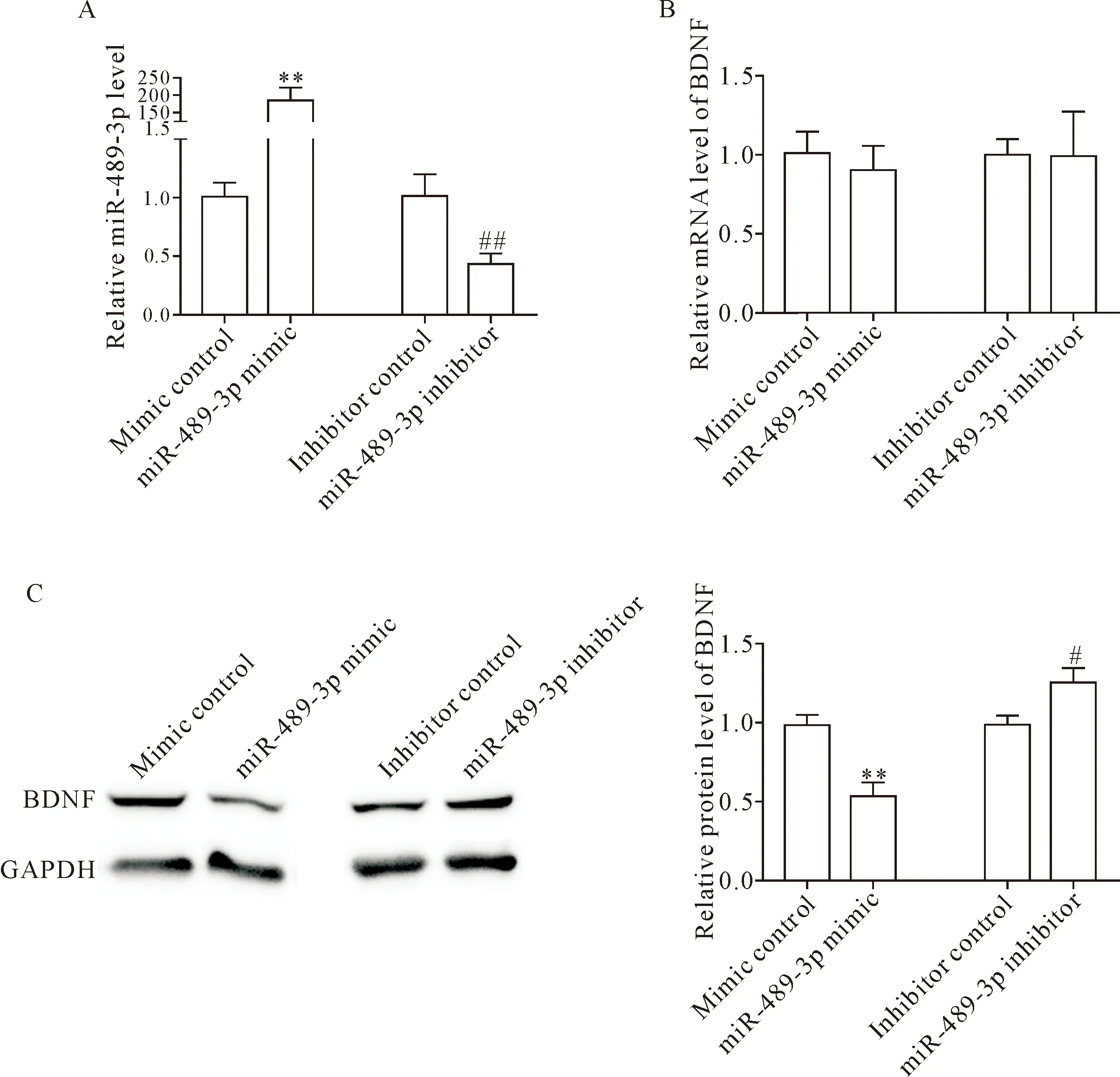
Figure 3.The levels of miR-489-3p (A), BDNF mRNA (B) and BDNF protein (C) in PC12 cells transfected with mimic control, miR-489-3p mimic, inhibitor control or miR-489-3p inhibitor. Mean±SD.n=3.**P<0.01vsmimic control group;#P<0.05,##P<0.01vsinhibitor control group.
图3 过表达或抑制miR-489-3p后PC12细胞miR-489-3p及BDNF的mRNA和蛋白表达的变化

Figure 4.The PC12 cell viability was measured at 12 h, 24 h, 36 h, 48 h and 60 h after transfection with equal doses of mimic control, miR-489-3p mimic, inhibitor control or miR-489-3p inhibitor. Mean±SD.n=3.**P<0.01vsmimic control group;#P<0.05vsinhibitor control group.
图4 过表达或抑制miR-489-3p表达对PC12细胞活力的影响
采用EdU实验检测PC12细胞的增殖能力,结果显示,体外转染miR-489-3p mimic的PC12细胞增殖能力显著低于对照组(P<0.01),而转染miR-489-3p inhibitor的PC12细胞增殖能力则显著高于对照组(P<0.05),见图5。

Figure 5.The proliferation of the PC12 cells transfected with equal doses of mimic control, miR-489-3p mimic, inhibitor control or miR-489-3p inhibitor was measured by EdU assay (×100). Mean±SD.n=3.**P<0.01vsmimic control group;#P<0.05vsinhibitor control group.
图5 过表达或抑制miR-489-3p的表达对PC12细胞增殖的影响
讨 论
BDNF与中枢神经系统的神经生存、分化和活动依赖性突触可塑性有关。研究表明在出生后的发育过程中,BDNF可调控某些特定脑区神经元的神经结构和脊柱形态[8],尤其引人注目的是纹状体、皮层和海马体之间的差异。通过条件性BDNF敲除小鼠来分析皮层和海马椎体神经元以及来自这些脑区的抑制性神经元和齿状回的兴奋性颗粒神经元的神经结构和树突形态,发现海马齿状回和皮质抑制性神经元和颗粒细胞的神经结构严重受损和树突的复杂性显著降低[9]。在神经系统中,BDNF是一个通过多种形式积极参加调节神经突触可塑性的调制器[10]。BDNF与传统的抗抑郁作用有关,抗抑郁药增加海马中BDNF的表达,而海马中BDNF的缺失会减弱抗抑郁的行为反应[11]。此外,脑室内或海马内注射BNDF导致快速、持续的抗抑郁作用[12]。移植转染了BDNF使之高表达的骨髓间充质干细胞显著促进脑梗死大鼠神经功能的恢复和突触素表达[13]。增加内侧前额叶皮质BDNF的表达选择性地减少乙醇依赖性小鼠的过量饮酒[14]。因此BDNF对神经发育和多种神经系统疾病发生的病理过程至关重要,探究BDNF的精准表达调控具有重要意义。
miRNAs是一种小型的、非编码的RNA,它能够靶向调控mRNA的翻译,从而对动植物的生长发育和病理生理过程发挥关键性的调节。在哺乳动物神经系统中,mRNA翻译的时空控制对神经发育和突触可塑性起着重要作用[15]。虽然哺乳动物的大脑中已经鉴定出来了许多miRNAs,但能够调控突触功能的特异性miRNAs,以及它们的靶mRNA仍然还有许多未知。miR-489-3p是中枢神经系统中含量丰富的一种miRNAs,提示其在中枢神经系统中有着极其重要的作用。因此,miRNA-489-3p也成为分子生物学和神经生物学备受关注的miRNA之一。Jiang等[7]研究报道,miR-489-3p抑制神经细胞增殖和促进神经细胞凋亡。
本项研究通过生物信息预测和luciferase实验,发现miR-489-3p可以靶向结合BDNF的3′-UTR。通过进一步的深入研究发现过表达或抑制miR-489-3p可靶向调控BDNF的蛋白表达,但对BDNF的mRNA表达并无显著影响。以上结果再次验证了miR-489-3p可以在转录后水平靶向调控BDNF的表达。过表达miR-489-3p显著抑制PC12细胞的增殖能力,而抑制miR-489-3p表达水平可以显著提高PC12细胞的增殖能力,提示miR-489-3p通过转录后水平靶向负性调控BNDF表达并抑制神经细胞增殖。
本研究为BDNF表达下调而引起的神经系统疾病提供了一种新的分子机制。但是miR-489-3p负性靶向调控BDNF的表达对神经系统具体功能的影响,有待今后通过不同的分子生物学方法进一步深入研究。
