活动性类风湿关节炎调节性T细胞程序性细胞死亡蛋白-1/程序性死亡配体1表达及与临床指标的相关性
2019-07-16武加标成菊兰许联红戚传平
武加标,任 敏,成菊兰,许联红,戚传平
类风湿关节炎(rheumatoid arthritis,RA)是病因未明的慢性滑膜炎为主的自身免疫性疾病,其特征是外周多关节、对称性、侵袭性炎症,导致关节肿痛从而失去活动能力,致使关节变形甚至残疾。尽管RA确切的发病机制仍有待阐明,但某些研究表明T细胞异常活化是RA免疫病理进程中的关键环节,CD4+T细胞起着特别重要的作用[1]。T细胞活化通过双信号模型介导发生,其中第二信号来自共刺激分子参与途径,而协同刺激分子作为参与激活T细胞活化的信号分子被广泛关注。程序性细胞死亡蛋白-1(programmed cell death-1, PD-1)是T细胞活化后晚期表达的与CD28同源的抑制性蛋白。PD-1与程序性细胞死亡蛋白配体-1(programmed death ligand 1, PD-L1)和程序性细胞死亡蛋白配体-2(programmed death ligand 2, PD-L2)相互作用,导致细胞因子分泌及其他效应功能受抑制[2]。异常表达的共刺激分子的功能与RA自身反应性T细胞的持续激活有关[3],研究发现敲除PD-1基因的小鼠不仅增加自发产生狼疮样症状,而且伴发自身免疫性肾小球肾炎,脾脏肿大,产生自身抗体等现象,证实PD-1在免疫应答中起负向调节功能[4]。已有报道活动性强直性脊柱炎外周血效应性T(effector T,Teff)细胞膜表面PD-L1的表达量显著低于健康对照组[5],而PD-1在RA患者CD4+CD25+T细胞和CD4+CD25-T细胞上的表达尚未见报道,尤其是活动期患者至今未有研究。因此,本研究应用流式术检测PD-1/PD-L1在RA患者调节性T细胞上的表达变化,并分析PD-1/PD-L1表达水平与临床指标的关系。
1 对象与方法
1.1 对象
纳入标准:选取2015年3月至2017年4月在江苏大学附属武进医风湿科就诊的RA患者,纳入患者符合1987年美国风湿病学会制定的RA分类标准,均排除并发感染、恶性肿瘤、、心脑血管疾病,且所有患者均按照疾病活动评分(Disease Activity Score 28,DAS28)评估病情,即DAS28=0.56*√(TJC28)+0.28*√(SJC28)+0.7*ln(ESR)* +0.014*GH。根据DAS28评分将患者进一步分为中低度活动组(2.6
1.2 方法
1.2.1 试剂和仪器:HU CD279(PD-1) PE MAB 100TST EH 12.1(100T)、HU CD274(PD-L1) PE MAB 100TST MIH 1(100T)、HU1(100T)均购于BD Biosciences公司。CD25和CD4流式抗体购自碧迪医疗器械(上海)有限公司,BD FACS CantoⅡ型流式细胞仪为美国BD公司产品。
1.2.2 标本采集:CD4 FITC MAB 100TST RPA-T4(100T)、HU C25 APC MAB 100TST M-A25 分别采集活动期RA患者和健康人全血2ml于肝素抗凝管中。
1.2.3 RA患者外周血T细胞表面PD-1与PD-L1水平检测:使用直接免疫荧光标记法标记细胞并进行流式细胞仪分析。取3只流式上样管,标记CON、S1和S2。S1管加入CD4 FITC/PD-1 PE/CD25 APC各5μl,S2管加入CD4 FITC/PDL-1 PE/CD25 APC各5 μl,CON管加入15 μl PBS;3支流式上样管中各加全血50 μl,混均。置室温,避光孵育15 min。加FACSLysing溶血素(1∶10稀释)1 ml,置室温,避光孵育15 min。300×g离心5 min,弃上清液。加2 ml PBS,300×g离心5 min,弃上清后加300 μl PBS,上机检测并分析结果。每管收集10 000个细胞,先在前向角散射光(FSC)-侧向散射光(SSC)散点图上圈定淋巴群细胞群,再固定CD4及CD25染色双阳性细胞。FLOWJO v10.3 进一步分析CD4+CD25+PD-1+和CD4+CD25-PD-L1+双阳性细胞,统计各组的表达率,并分析表达水平与实验室指标血沉(erythrocyte sedimentation rate,ESR)、类风湿因子(rheumatoid factor,RF)、C反应蛋白(C-reactive protein,CRP)、抗环瓜氨酸肽(anti-cyclic citrullinated peptide,ACPA)抗体的相关性。
1.3 统计学处理
2 结果
2.1 活动期RA患者组和健康对照组一般资料
62例RA患者中男9例,女53例;年龄32~81岁,平均年龄为(62.9±13.8)岁,平均病程(9.7±2.8)年,DAS28平均(4.2±0.1)分;RA组RF、CRP和抗ACPA抗体阳性率分别为90.3%、93.5%和77.4%。对照组平均年龄为(51.8±20.4)岁,2组具有可比性(P>0.05)。
2.2 PD-1在RA患者和健康对照组外周血CD4+CD25+和CD4+CD25-T细胞的表达
PD-1在高度活动组和中低度活动组RA患者CD4+CD25+T细胞的表达率分别为(2.27±0.56)%和(1.83±1.08)%,高于健康对照组的(1.42±0.49)%,差异有统计学意义(P<0.01)。 PD-1在高度活动组和中低度活动组的RA患者CD4+CD25-细胞的表达率分别为(10.06±4.53)%和(10.26±3.27)%,高于健康对照组的(8.70±2.21)%,差异无统计学意义(P>0.05)(表1)。
2.3 PD-L1在RA患者和健康对照组外周血CD4+CD25+和CD4+CD25-T细胞表达率比较
PD-L1在高度活动组和中低度活动组RA患者CD4+CD25+T细胞的表达率分别为(2.06±0.62)%和(1.83±0.63)%,高于健康对照组(0.80±0.43)%的表达率,两组差异有统计学意义(P<0.001)。PD-L1在高度活动组和中低度活动组RA患者CD4+CD25-T细胞的表达率分别为(4.27±1.92)%和(4.42±2.14)%,高于健康对照组(3.52±1.37)%,两组差异无统计学意义(P>0.05)(表2)。
2.4 RA患者 PD-1/PDL1表达水平与实验室检查和疾病活动性的相关性分析
PD-1在活动期RA患者CD4+CD25+T细胞表达水平与DAS28呈正相关(r=0.712,P<0.01)(图1)。PD-L1在CD4+CD25-T细胞表达水平与DAS28无相关性,PD-1、PD-L1在RA患者CD4+CD25+T细胞表达水平与抗CCP抗体、RF、CRP、ESR和血小板计数亦无相关性。
3 讨论
RA的免疫学发病机制主要是辅助性T细胞(T helper cells,Th)与调节性T细胞(regulatory T cells,Treg)间的比例失衡,提示RA因复杂的免疫耐受系统功能障碍所致,其中Th细胞被视为加速RA进展重要的辅助细胞[6]。PD-1/PD-L1通路作为负性调控参与免疫应答的调节,小鼠模型证明PD-1途径对于预防自身免疫过程至关重要[7],研究发现PD-1缺陷小鼠会发展为自身免疫性关节炎;同时,体外敲除PD-1基因胶原诱导性关节炎(collagen induced arthritis,CIA)的小鼠淋巴细胞,导致严重CIA的发展,产生异常增多的抗原诱导型Thl7细胞,表明PD-1参与调控T细胞的活化途径[8-9]。
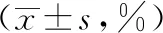
表1 PD-1在活动期RA患者和健康对照组外周血CD4+CD25+和CD4+CD25-T细胞的表达Table 1 PD-1 in RA condition activity group and healthy control group’s expression
q检验:与对照组比较,△P<0.01;与中低度活动组比较,*P<0.01
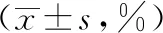
表2 PD-L1在RA患者和健康对照组外周血CD4+CD25+和CD4+CD25-T细胞表达Table 2 PD-L1 in RA condition activity group and healthy control group’s expression rate
q检验:与对照组比较,△P<0.001;与中低度活动组比较,*P>0.05
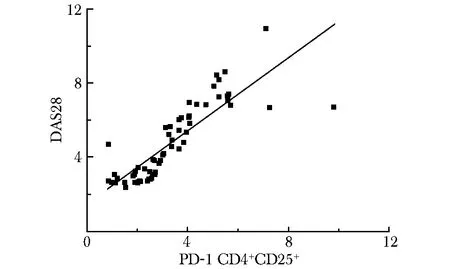
图 1 活动期RA患者CD4+CD25+T细胞PD-1表达水平与DAS28的相关性Fig 1 Correlation between the expression of PD-1 in CD4+CD25+T cells and DAS28 in patients with active RA
CD4+CD25+T细胞作为一群具有免疫抑制功能的Treg,炎症环境中的促炎因子能显著抑制过继的Treg细胞的免疫活性,可将其转化为致病T细胞[10]。本研究表明PD-1和PD-L1在活动组RA患者CD4+CD25+T细胞的表达较对照组和中低活动组均增加,这种微增加可能反映体内慢性炎症致自身抗原的持续刺激,从而使这群细胞处于持续活化状态,最终致使T细胞耗竭表达上调,可能提示PD-1参与活动性RA的发病进程。同样,作为调节性T细胞群,PD-L、PD-L1在活动期RA组CD4+CD25-T细胞群表达率也较其他2组高,其上调不同于RA患者PD-1+T细胞在滑液或滑膜组织的局部高表达[9,11],说明在细胞群表达不同反映PD-1和PD-L1表达的可塑性,而CD4+CD25+以及CD4+CD25-T细胞群的表达模式变化,提示PD-1/PD-L1协同表达在调节性T细胞上,进一步说明它们抑制T细胞的功能,使其在RA活动的疾病状态下最大限度调节转导信号,进而调控适应性免疫应答,保证机体平衡自身应答的调节。
已报道RA患者表达高水平可溶性PD-1(soluble programmed cell death 1,sPD-1),且与患者TNF-α水平增加相关[9,12-13]。提示sPD-1可代表RA免疫治疗的生物标志物或靶点[14]。国内报道PD-1在RA外周血PD-L1+中性粒细胞百分率高于健康人[15],而sPD-1常存在血清或体外培养液中,一般用ELISA和Western等方法证实,本研究用流式术检测PD-1/PD-L1表达是膜型且发现调节性T细胞群表达不同与报道存在差异,这种差异可能因患者不同年龄组、病程长短或炎性状态不同所致。本研究还发现部分高度活动组RA患者的CD4+CD25+细胞群PD-1水平高表达(相比对照组),进一步分析这种表达特殊性一方面因为RA作为缓解与活动交替“慢性炎症”疾病,CRP水平明显增高,提示T细胞活化调节机制需达到控制慢性炎症为目标;另一方面,PD-1表达水平可能会随炎症组织微环境状态的改变而变化。另外,研究表明,PD-1在诱导和维持免疫耐受方面具有双重作用[16],PD-1/PD-L1信号通路的传递具有双向性,会导致呈持续性表达。因此,针对部分患者需动态分析PD-1表达的变化。
DAS28是衡量RA病情活动的重要指标,本实验发现PD-1在活动期CD4+CD25+T表达水平与DAS28呈正相关,高表达患者DAS28评分高,伴随着关节压痛数和肿胀数增加。炎症指标高,提示机体炎症状态下PD-1可能在活动期RA起作用。而在活动期RA患者CD4+CD25-T细胞上PD-L1的表达率与DAS28无相关,而有报道PD-L1的抗体水平与RA患者的疾病活动性相关[17-18]。PD-1分子在维持外周耐受发挥重要作用,因而PD-1可作为负性调控分子参与自身免疫病的发病过程,已通过PD-1基因敲除小鼠得以证明[19]。而人类PD-1首先在全基因组关联中提出PD-1基因多态性与自身免疫性的发展[19]。因此,诸上证据有助于深入理解RA的发病机制,可利用抑制PD-1/PD-L1信号通路作为治疗RA的新途径。
综上,与对照组相比,PD-1/PD-L1在活动期RA患者CD4+CD25+T细胞的,表达上调,PD-1、PD-L1的表达水平与DAS28呈相关性,提示PD-1/PD-L1途径可能经调节性T细胞调控机制参与RA的发生。
志谢:感谢感染与免疫安徽省重点实验室李柏青教授对流式细胞术方面的指导及对本文的审阅修改
