慢性无菌性骨髓炎8例及文献复习
2019-07-16赵梦珠余可谊冷晓梅杨云娇张上珠彭琳一曾小峰
赵梦珠,余可谊,沈 敏,吴 迪,罗 艺,冷晓梅,张 昀,杨云娇,张上珠,彭琳一,曾小峰
慢性无菌性骨髓炎(chronic non-bacterial osteomyelitis, CNO),以往被称为慢性复发性多灶性骨髓炎(chronic recurrent multifocal osteomyelitis, CRMO),是一种罕见的多基因多因素自身炎症性骨病,属于自身炎症性疾病中一个新的分支[1]。发病率1/10 000,女性多于男性,平均发病年龄为10~12岁[1-3],也有成人发病的报道[4]。常见临床表现为反复发作的全身多处骨痛,不同部位骨骼受累率在不同文献报道中存在差异,但多以下肢骨最常见;皮肤、肠道等在内的多种器官及组织亦可受累,出现炎性肠病、暴发性痤疮、银屑病、坏疽性脓皮病等[5],可伴全身症状如发热、乏力等[1,5-6]。实验室检查缺乏特异性,可能与多种基因变异相关[1,7]。CNO属于除外性诊断,与感染、肿瘤及其他自身炎症性疾病鉴别非常重要而又十分困难。患者预后一般较好,但病情严重者或重要部位骨骼受累者可出现致残致畸[1,5-6]。国内医生对CNO认识不足,常有误诊或延迟诊断,出现不良后果。本文通过分析本院确诊的CNO患者的临床表现和基因表型,以提高临床医生对该病的认识,使患者早日获得适宜的诊断和治疗。
1 对象与方法
1.1 对象
2015年4月至2018年4月,北京协和医院(PUMCH)风湿免疫科成人自身炎症性疾病中心(PUMCH中心)共确诊8例CNO患者。CNO的诊断需符合[1-3,5-7]:(1)全身反复多处骨痛或影像学提示全身多处骨破坏伴骨硬化改变;(2)病程>6周;(3)除外肿瘤、感染、免疫缺陷病、单基因自身炎症性疾病等其他疾病。本研究未纳入滑膜炎-痤疮-脓疱病-骨肥厚-骨髓炎(synovitis, acne, pustulosis, hyperostosis and osteitis,SAPHO)综合征。
1.2 方法
收集8例患者的临床资料,包括性别、年龄、发病年龄、家族史、临床表现、影像学检查、病理检查以及治疗,并进行随访。每位患者均评估健康状况调查简表(short form-36,SF-36),得分越高,健康状况越好。加入医生整体评价(physician’s global assessment, PGA)、患者自评。所有患者均进行全基因外显子二代测序(患者及家属知情同意)。对国外报道的CNO病例系列进行文献复习[3,8-13],比较PUMCH中心与国外CNO队列[8]两组患者临床表型的差异。患者经过治疗后随访,临床症状缓解80%以上且炎症指标恢复正常者定义为完全缓解,临床症状缓解20%~80%为部分缓解。
1.3 统计学处理
采用SPSS软件24.0,数据采用平均值(标准差)或中位数(范围)描述。
2 结果
2.1 一般资料
PUMCH中心8例成人CNO患者男女比例1∶1,多为散发病例,仅1例有家族史(病例6的一个叔父有慢性下颌骨骨髓炎及重度痤疮)。发病中位年龄为20岁,其中最小发病年龄9岁,最大发病年龄64岁,幼年起病者2例(25%)。从发病到确诊的中位时间为33个月(3~242个月)。
2.2 临床表现
8例CNO患者最常见的临床症状为骨痛(8例,100%)和发热(7例,87.5%),均为中低热。病程较长者出现骨骼畸形(图1E、I)。半数(4例,50%)患者并发关节炎,1例(12.5%)伴掌跖脓疱病。其他临床表现包括乏力、体重下降、出汗、口腔溃疡、结膜炎等。SF36评分平均为58.4±9.6,其中躯体健康评分(physical component summary,PCS)平均为56.5±6.6,精神健康评分(metal component summary,MCS)平均为52.2±11.9,PGA 6.8±2.0,患者自评得分5.4±1.6。所有患者受累病灶均>1处,7例(87.5%)双侧病灶。8例患者共26处骨骼受累,常见部位为下颌骨、肋骨、脊柱、骨盆、股骨,发生率均为11.5%;其次为锁骨、桡骨和胫骨,发生率各为7.7%;鼻骨、颧骨、乳突、指骨受累相对较少,各占 3.8%。1例患者出现颅骨受累(表1)。
2.3 基因表型
8例患者均送检全基因外显子测序,3例患者发现PSTPIP1基因变异,其余CLCN7、COL1A1、ACAN基因变异各1例(表1)。以上6例基因变异均属于罕见突变(MAF小于0.02)。
2.4 影像学和病理表现
8例患者均行病变部位CT,阳性发现者7例,其中骨破坏并发骨硬化者4例(图1H),单纯骨破坏1例,骨硬化并发骨髓炎1例,单纯骨髓炎2例。6例患者行病变部位MRI,阳性发现者6例,均呈现骨髓炎症性改变(图1A、C、D、F)。其中1例患者CT未见异常,而MRI发现骨髓炎改变。8例患者骨扫描结果均阳性,病变部位表现为异常放射性浓聚(图1B)。8例患者均行骨活检,其中2例表现为骨坏死,2例骨纤维化改变,3例骨髓炎改变,2例骨髓炎并发纤维化改变。骨组织病原学检查均阴性。
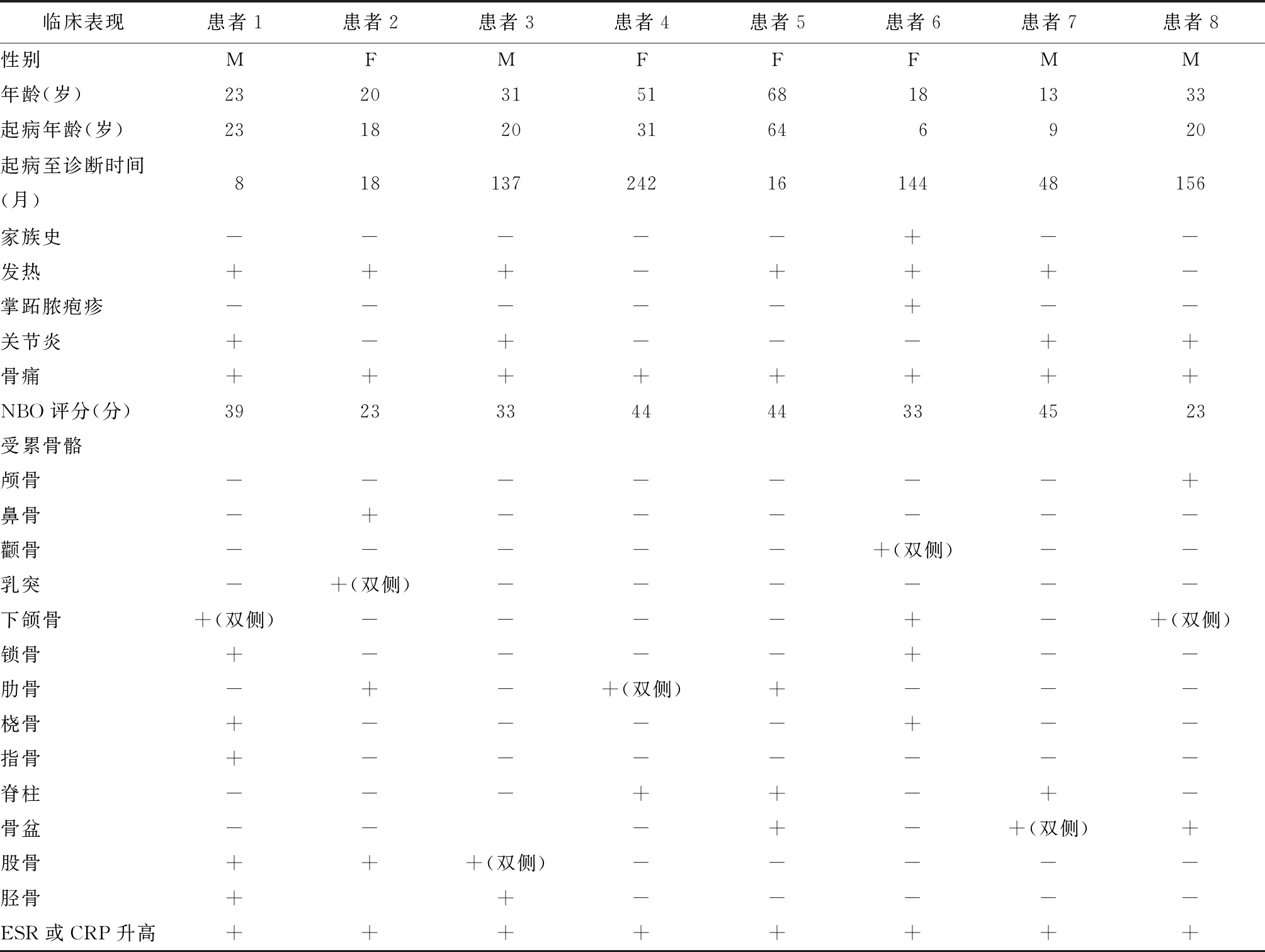
表1 PUMCH中心慢性无菌性骨髓炎患者临床表现Table 1 Clinical features of patients with chronic non-bacterial osteomyelitis in PUMCH
续表1
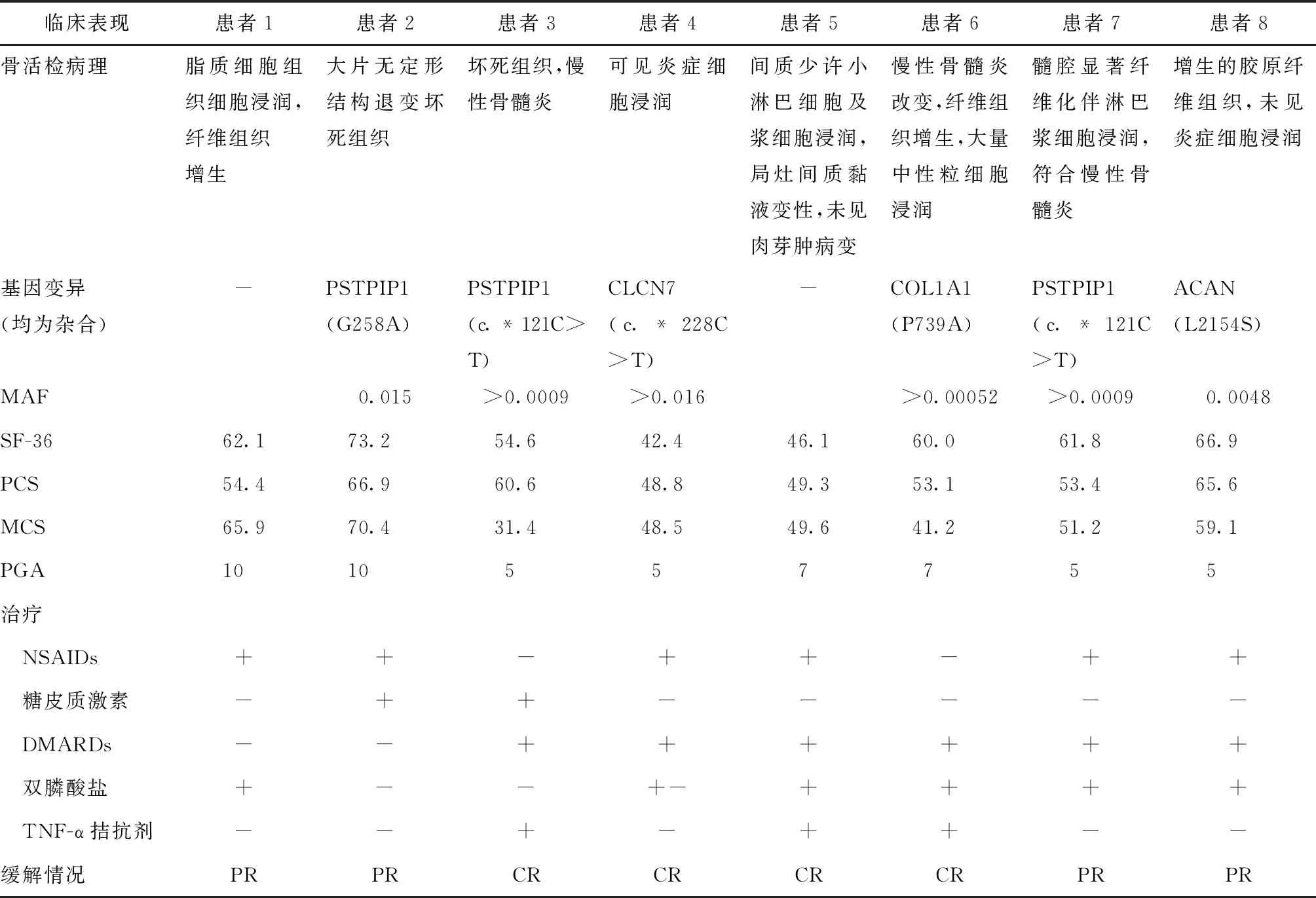
临床表现患者1患者2患者3患者4患者5患者6患者7患者8骨活检病理脂质细胞组织细胞浸润,纤维组织增生大片无定形结构退变坏死组织坏死组织,慢性骨髓炎可见炎症细胞浸润间质少许小淋巴细胞及浆细胞浸润,局灶间质黏液变性,未见肉芽肿病变慢性骨髓炎改变,纤维组织增生,大量中性粒细胞浸润髓腔显著纤维化伴淋巴浆细胞浸润,符合慢性骨髓炎增生的胶原纤维组织,未见炎症细胞浸润基因变异(均为杂合)-PSTPIP1(G258A)PSTPIP1(c.*121C>T)CLCN7(c.*228C>T)-COL1A1(P739A)PSTPIP1(c.*121C>T)ACAN(L2154S)MAF0.015>0.0009>0.016>0.00052>0.00090.0048SF-3662.173.254.642.446.160.061.866.9 PCS54.466.960.648.849.353.153.465.6 MCS65.970.431.448.549.641.251.259.1PGA1010557755治疗 NSAIDs++-++-++ 糖皮质激素-++----- DMARDs--++++++ 双膦酸盐+--+-++++ TNF-α拮抗剂--+-++--缓解情况PRPRCRCRCRCRPRPR
PUMCH:北京协和医院;NBO:非细菌性骨髓炎;MAF:最小等位基因频率;SF-36:健康状况调查简表;PCS:身体健康评分;MCS:精神健康评分;PGA:医生整体评价;NSAIDs:非甾类抗炎药;DMARDs:慢作用抗风湿药;TNF:肿瘤坏死因子;PR:部分缓解,指症状缓解20%至80%;CR:完全缓解,指症状缓解80%以上且炎症指标恢复正常;ND:无数据
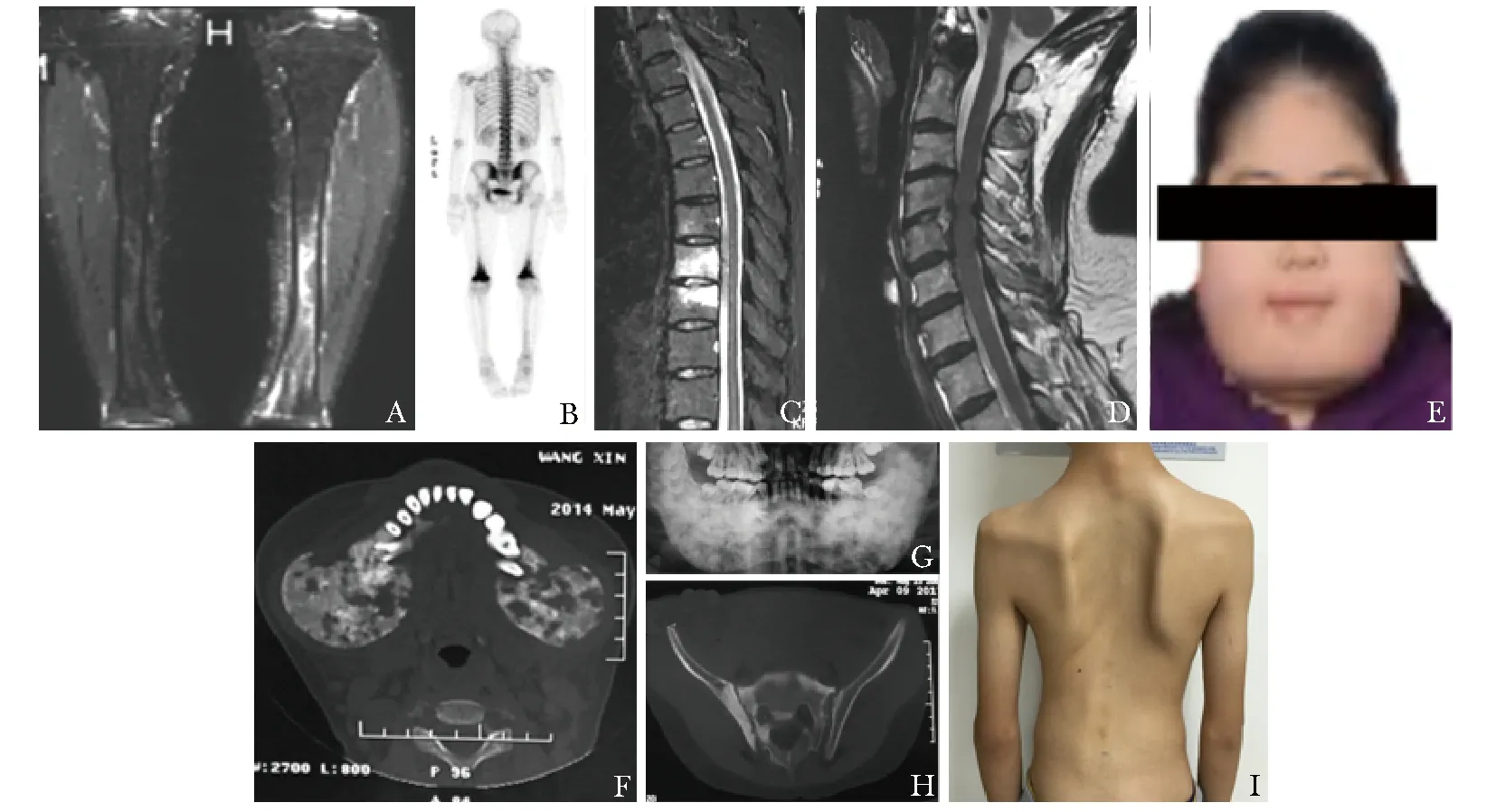
图 1 慢性无菌性骨髓炎患者体征和影像学改变
Fig 1 Physical signs and images of patients with chronic non-bacterial osteomyelitis
患者1 MRI提示左侧胫骨受累(A);患者3骨扫描提示双侧股骨受累(B);患者3 MRI提示胸椎(C)及颈椎(D)受累;患者6下颌骨畸形(E),CT(F)和X线(G)显示双侧下颌骨受累;患者7脊柱侧弯畸形(I),CT提示骶骨和髂骨受累(H)
2.5 治疗及预后
在初始治疗中,2例患者单用非甾类抗炎药(non-steroids anti-inflammatory drugs, NSAIDs),4例患者接受慢作用抗风湿药(disease-modifying antirheumatic Drugs,DMARDs)、双膦酸盐、生物制剂肿瘤坏死因子ɑ(tumor necrosis factor-ɑ,TNF-ɑ)拮抗剂及NSAIDs联合治疗。2例患者接受糖皮质激素治疗。在接受治疗后进行0.5~2年随访,其中2例单用NSAIDs者,病情部分缓解;4例接受联合治疗者,均获得完全缓解;2例接受糖皮质激素治疗者,1例部分缓解,1例无效。SF36评分为54.8±1.8,其中PCS为50.3±3.5,MCS平均为54.2±6.1,上述评分在治疗前后升高与降低并不一致,可能与样本量过少、部分患者失访等相关。治疗后PGA中位数为3(2~3),患者自评得分中位数为4(3~6),均较治疗前好转。
2.6 与国外比较
本组患者与Wipff 等报道[8]儿童CNO患者相比(表2),PUMCH中心发病人群不具备性别差异,从发病至确诊的时间更长(33个月vs.17.3个月),伴关节炎更多见(50%vs. 11%),但无伴炎性肠病患者。儿童CNO受累骨骼病灶大于10%的3个常见部位分别是骨盆(16%)、跟骨(14%)和锁骨(10%),而本组成人患者受累股骨病灶最常见的部位是骨盆、下颌骨、肋骨、脊柱和股骨(均为11.5%)。儿童CNO患者下肢骨受累比例高达47%,而本组患者仅占15.3%。跟骨在儿童CNO中受累比例约占14%,而本组患者中未见受累者。本组患者有鼻骨、颧骨、乳突及颅骨受累,而在Wipff等[8]报道中并未提及。
3 讨论
CNO通常好发于青少年,但亦有成人发病报道[4,14-15]。PUMCH中心确诊的8例患者中75%为成年起病,这与PUMCH中心主要接诊成人患者有关。本研究发现CNO从发病至确诊的中位数时间长达近3年,最长者达到20年,部分患者因延迟诊断、未获得适宜的治疗,出现骨骼变形、骨溶解等不良后果。分析延迟诊断的主要原因为临床医生对于该病认识不足,容易与感染、肿瘤等病因所致骨病相混淆。
MRI和骨扫描是诊断CNO的最有价值的影像学手段。X线和CT有一定价值,但在敏感性、准确性及发现病变范围等方面不如MRI和骨扫描。由于本研究是回顾性总结患者的临床资料,少部分患者由于各种原因仅进行了X线和CT检查,而未完善MRI和骨扫描,此为不足之处。但所有患者都经过骨活检最终确诊为慢性骨髓炎。骨活检早期表现为中性粒细胞浸润,后期可出现单核细胞、巨噬细胞、淋巴细胞和浆细胞等多种炎细胞浸润,晚期则出现溶骨性改变、骨硬化和骨纤维化。当患者出现不明原因反复多部位骨痛时,建议应积极完善MRI及骨扫描检查,病灶部位应行骨活检。
表2 PUMCH中心慢性无菌性骨髓炎患者临床表现与国外儿童慢性无菌性骨髓炎患者对比
Table 2 Comparison of clinical manifestations of chronic non-bacterial osteomyelitis between PUMCH and a foreign children reference center
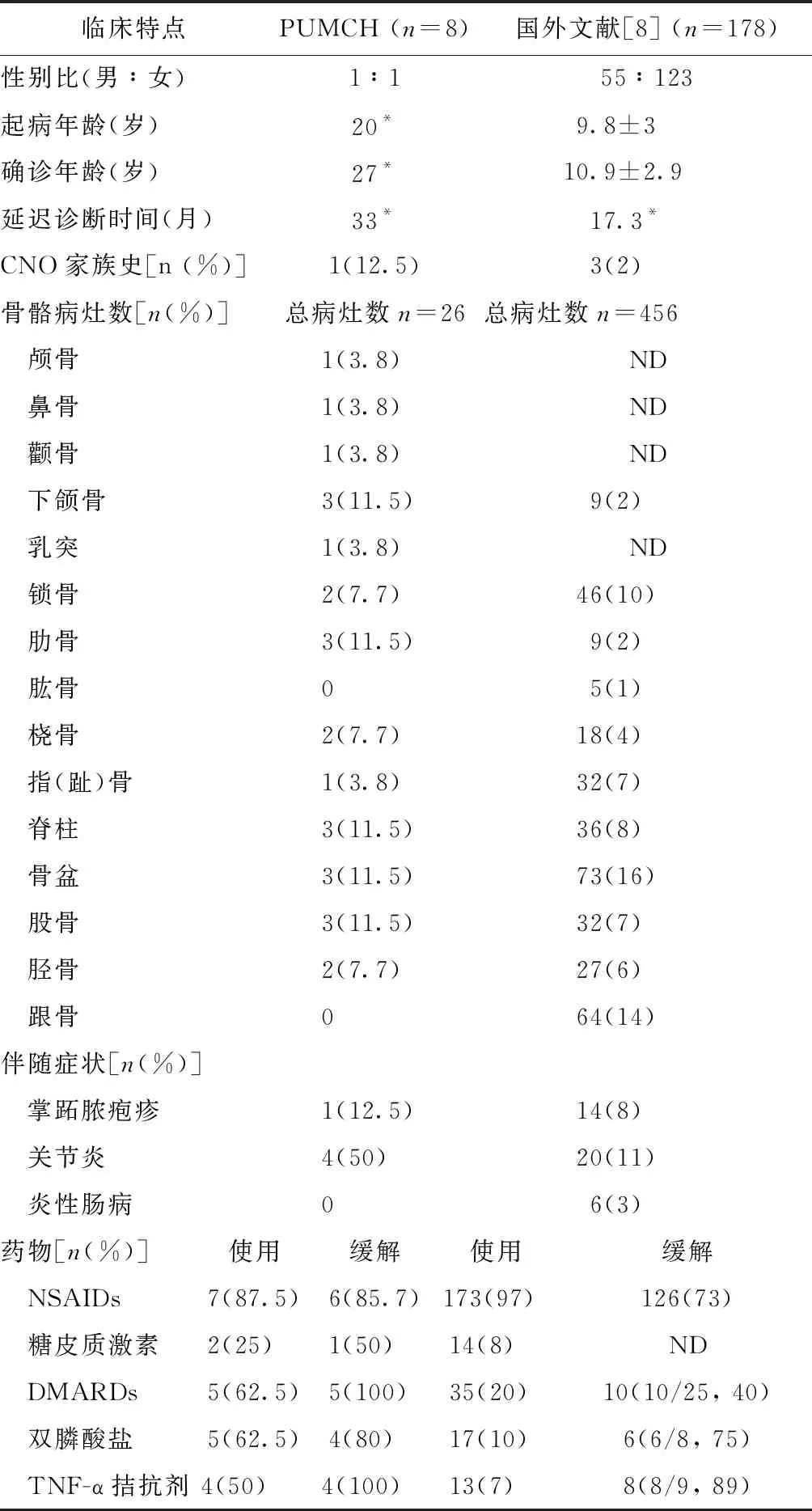
临床特点PUMCH (n=8)国外文献[8] (n=178)性别比(男∶女)1∶155∶123起病年龄(岁)20* 9.8±3确诊年龄(岁)27* 10.9±2.9延迟诊断时间(月)33* 17.3*CNO家族史[n (%)]1(12.5) 3(2)骨骼病灶数[n(%)]总病灶数n=26总病灶数n=456 颅骨1(3.8)ND 鼻骨1(3.8)ND 颧骨1(3.8)ND 下颌骨3(11.5)9(2) 乳突1(3.8)ND 锁骨2(7.7)46(10) 肋骨3(11.5)9(2) 肱骨0 5(1) 桡骨2(7.7)18(4) 指(趾)骨1(3.8)32(7) 脊柱3(11.5)36(8) 骨盆3(11.5)73(16) 股骨3(11.5)32(7) 胫骨2(7.7)27(6) 跟骨064(14)伴随症状[n(%)] 掌跖脓疱疹1(12.5)14(8) 关节炎4(50)20(11) 炎性肠病06(3)药物[n(%)] 使用 缓解 使用缓解 NSAIDs7(87.5)6(85.7)173(97)126(73) 糖皮质激素2(25)1(50)14(8)ND DMARDs5(62.5)5(100)35(20)10(10/25, 40) 双膦酸盐5(62.5)4(80)17(10)6(6/8, 75) TNF-α拮抗剂4(50)4(100)13(7)8(8/9, 89)
*中位数;ND:无数据
CNO属于除外性诊断,需要重点与肿瘤和感染鉴别。CNO易与朗格汉斯组织细胞增生症(Langerhans cell histiocytosis,LCH)混淆。LCH以骨骼、皮肤及中枢神经系统受累为主要表现。LCH的骨骼受累与CNO不同的是,常以中轴骨、颅骨受累多见,单灶病变常见,以溶骨性骨破坏为主,病理可见异常朗格汉斯组织细胞浸润,免疫组化CD1a和/或CD207阳性[16]。此外,LCH的皮肤受累表现为丘疹鳞状肉芽肿性病变、口腔及生殖器黏膜病变,而非CNO的掌跖脓疱病、银屑病样等表现。LCH还可以出现中枢神经系统受累,如共济失调、构音障碍和行为异常等,可出现垂体激素分泌紊乱,MRI表现为脑干、基底节和小脑特征性信号改变,由此也可以与CNO鉴别[16-18]。感染性骨髓炎在MRI及骨扫描亦可呈现骨髓水肿、骨髓炎改变,部分可能不具备感染典型的临床表现,实验室检查亦无特异性结果,此时重复骨活检及骨组织病原学检查可能有助于鉴别CNO与感染性骨髓炎[19]。本组所有患者均在完善骨活检病理和病原学检查,排除了肿瘤和感染后最终确诊CNO。
CNO与SAPHO综合征关系未明。SAPHO综合征临床表现与CNO类似,但骨骼受累以前胸壁(尤其是胸锁关节,约占65%~90%)、脊柱(尤其是胸椎、骶髂关节等,约占33%)为主,皮肤受累非常常见,包括掌跖脓疱疹、重度痤疮、银屑病等,仅有骨骼受累而无皮损者非常罕见[4]。SAPHO综合征的诊断推荐符合以下4项中的一项即可:关节炎伴重度痤疮;关节炎伴掌跖脓疱疹;肢体、脊柱或胸锁关节骨肥厚;以及CNO[20-21]。按照上述推荐标准,单纯CNO无论是否伴皮损都可以诊断SAPHO综合征,但是多数学者仍认为皮肤表现是SAPHO综合征非常重要的特征,如果将不伴皮损的单纯CNO诊断为SAPHO综合征,反而令诊断更加复杂化和容易混淆,成人起病的CNO应当在诊断上与SAPHO综合征区别开[4]。因此,笔者认为成人起病的CNO并伴特征性皮损的这一组特殊类型属于SAPHO综合征。而本组患者中成人起病者均没有皮肤损害,仅有一例伴掌跖脓疱疹的患者是幼年起病,因此考虑本组患者均诊断为CNO为宜。
目前尚未发现散发CNO任何明确相关的致病基因突变。本研究发现了罕见PSTPIP1、CLCN7、ACAN、COL1A1基因变异。PSTPIP1基因位于15号染色体,其编码蛋白磷酸化障碍可引起炎性小体活化增强,IL-1和IL-18等释放增加[22]。目前已证实,PSTPIP1是一种常染色体显性遗传性单基因自身炎症性骨病——化脓性无菌性关节炎-坏疽性脓皮病-痤疮(pyogenic arthritis, pyoderma gangrenosum, and acne, PAPA)综合征的致病基因[23]。但本研究中3例患者均不能诊断PAPA综合征。近年来,有动物研究发现PSTPIP2变异可能与CNO发病相关[7,24]。因此推测PSTPIP1变异在本组3例患者的发病中可能有一定意义。CLCN7编码破骨细胞膜上的氯通道,CLCN7基因突变可引起破骨细胞功能缺陷,骨骼无机基质溶解障碍,与常染色体显性或隐性遗传性骨硬化病及Ⅱ型常染色体显性骨质疏松症都密切相关[25-26]。COL1A1基因突变与成骨不全相关[27],ACAN基因突变则与骨骺发育不良及身材矮小关系密切[28]。但上述基因变异与CNO的关系尚不明确。
