miR-145抑制NF-κB p65表达促进ROS产生诱导卵巢癌细胞凋亡的机制
2019-07-04刘玙平冯秋霞王翠娜王运霞
刘玙平 冯秋霞 王翠娜 王运霞
(1河南卫生干部学院妇产科,河南 郑州 450007;2河南省人口和计划生育科学技术研究院妇产科;3河南省人民医院妇产科)
卵巢癌是常见的妇科恶性肿瘤,其死亡率和发病率分别居妇科恶性肿瘤第1位和第3位〔1〕。由于卵巢癌发病隐匿,早期症状不明显,超过70%的患者就诊时已属晚期,难以治愈,5年存活率仅40%〔2,3〕。手术治疗、放疗、化疗是卵巢癌的主要治疗方式,但其存在的各种毒副作用严重影响其治疗效果;生物治疗、分子靶向治疗、免疫治疗等治疗方法也给中晚期卵巢癌患者的治疗提供了更多选择〔4,5〕。微小RNA(miRNA)广泛存在于真核生物中,能调控多种下游靶基因参与细胞分化、细胞增殖、胚胎发育等生物过程〔6〕。miRNA失调可促进或抑制多种癌症,其在恶性肿瘤领域的研究受到了广泛关注〔7〕。研究〔8,9〕表明,miR-148在肝癌、胃癌、乳腺癌等多种肿瘤组织中异常表达,并调节癌细胞凋亡、分化、代谢等过程;而miR-145已被证实在卵巢癌组织及血清中呈低表达〔10〕。为研究miR-145对卵巢癌细胞凋亡的影响及作用机制,本文检测了过表达miR-145后卵巢癌细胞凋亡率及其相关因子水平,以期为卵巢癌的早期诊断及治疗提供理论基础。
1 材料与方法
1.1一般资料 选取2016年3月至2018年5月就诊于河南省人民医院并经病理科确诊为卵巢癌的患者共46例,年龄31~79岁。收集所有患者经手术切除的卵巢癌组织及相应的癌旁组织(距离病灶≥2 cm)并立即存放于液氮,带回后储存于-80℃冰箱备用;所有患者术前未进行放疗、化疗等其他治疗并签署知情同意书,本实验经医学伦理委员会审批同意。
1.2材料 OVCAR3细胞(批号:HTB-161)购自ATCC;胎牛血清(批号:SH41288)、RPMI1640培养液(批号:SH30807)购自美国Gibco-BRL公司;兔抗人Bax多克隆抗体(批号:22160002)购自上海煊翎生物科技有限公司;兔抗人Bcl-2多克隆抗体(批号:PAB19877)、兔抗人含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3 多克隆抗体(批号:ABP52935)、兔抗人核因子(NF)-κB p65多克隆抗体(批号:ABP51955)购自武汉艾美捷科技有限公司;兔抗人β-actin多克隆抗体(批号:XFC1655)购自上海信帆生物科技有限公司;NF-κB抑制剂(PDTC,批号:S1809)、肿瘤坏死因子(TNF)-α(批号:P5318)、总超氧化物歧化酶(SOD)活性检测试剂盒(批号:S0101)、脂质氧化产物丙二醛(MDA)检测试剂盒(批号:S0131)、活性氧(ROS)检测试剂盒(批号:S0033)购自上海碧云天生物科技有限公司;Trizol试剂(批号:15596)、二喹啉甲酸(BCA)试剂盒(批号:PC0020)、聚偏氟乙烯(PVDF)膜(批号:BSP0161)、RIPA裂解液(批号:R0020)、双荧光素酶报告基因检测试剂盒(批号:D0010)、电化学发光(ECL)液(批号:PE0030)购自北京Solarbio公司;Lipofectamine 2000转染试剂(批号:11668027)购自美国Invitrogen公司;TaKaRa反转录试剂盒(批号:RR047A)、TaKaRa实时荧光定量试剂盒(批号:RR820A)购自宝生物工程(大连)有限公司;膜联蛋白(Annexin)V-FITC凋亡检测试剂盒(批号:170207)购自美国Coulter公司;酶标仪购自Thermo公司;细胞培养箱购自美国Thermo公司;NanoDrop微量核酸测定仪购自上海创萌生物科技有限公司;流式细胞仪购自美国BD公司。
1.3细胞培养与分组 使用含10 %胎牛血清的RPMI1640培养基于37℃、5% CO2饱和湿度条件下培养OVCAR3细胞。待细胞生长至融合度约50%时,将细胞分组,按照LipofectamineTM2000转染试剂说明书进行转染。分别转染模拟物(mimic)对照(control)、miR-145 mimics、抑制剂(inhibitor)control、miR-145 inhibitor至OVCAR3细胞并依次标记为miR-con组、miR-145组、anti-miR-con组、anti-miR-145组。将OVCAR3细胞重悬并调整细胞悬液浓度为1×106个/ml,接种至96孔板,设置ddH2O组(未添加PDTC)和PDTC组(含终浓度100 μmol/L的PDTC),继续培养12 h;转染miR-145 mimics的细胞使用含终浓度为10 mg/L TNF-α继续培养12 h并标记为miR-145+ TNF-α组。
1.4RT-qPCR 取适量卵巢癌及癌旁组织,miR-con组和miR-145组细胞,充分研磨,加入Trizol试剂提取总RNA。使用NanoDrop微量核酸测定仪和凝胶电泳系统检测RNA浓度和质量,分别使用TaKaRa反转录试剂盒和荧光定量试剂盒将RNA反转录为cDNA并配制反应体系。以β-actin为内参进行PCR扩增,每个样品重复3次。β-actin引物:上游:5′-TGGATCAGCAAGCAGGAGTA-3′,下游:5′-TCGGCCACATTGTGAACTTT-3′;miR-145引物:上游:5′-ACACTCCAGCTGGGGTCCAGTTTTCCCAGGA-3′,下游:5′-TGGTGTCGTGGACTCG-3′;miR-145相对表达量计算采用F=2-△△Ct法。
1.5Western印迹 收集对数生长期的miR-con组、miR-145组、anti-miR-con组和anti-miR-145组细胞,加入含蛋白酶抑制剂的RIPA裂解液于冰上裂解,4℃,8 459.1 r/min离心20 min,取上清。取适量蛋白样品进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),电泳结束后将蛋白样品电转至PVDF膜上,5 %脱脂奶粉TBST液室温封闭1 h;分别加入兔抗人Bax多克隆抗体(1∶5 000)、兔抗人Bcl-2多克隆抗体(1∶1 000)、兔抗人Caspase-3多克隆抗体(1∶500)、兔抗人p65多克隆抗体(1:1 000)、兔抗人β-actin多克隆抗体(1∶1 000),4℃孵育过夜;洗膜后加入辣根过氧化物酶(HRP)标记的二抗室温孵育2 h;TBST洗膜,ECL试剂盒显示条带。以β-actin为内参,实验重复3次。
1.6双荧光素酶报告基因实验 收集OVCAR3细胞,按照LipofectamineTM2000转染试剂说明书将p65 3′-UTR野生型(Wt)质粒载体(含p65 3′-UTR片段)或突变型(Mut)质粒载体(不含p65 3′-UTR片段)分别与mimic control和miR-145 mimics共转染,常规培养24 h。裂解后4℃,8 459.1 r/min离心10 min收集上清液,检测细胞中荧光素酶活性。相对荧光强度=萤火虫荧光强度/海肾荧光强度。
1.7ROS、MDA、SOD水平检测 转染后的miR-con组、miR-145组、ddH2O组、PDTC组和miR-145+ TNF-α组细胞去除上层培养液,以无血清培养液稀释双氢-乙酰乙酸二氯荧光黄(DCFH-DA)加入使其终浓度为10 μmol/L,加入到各组细胞中,室温避光孵育30 min,磷酸盐缓冲液(PBS)洗涤以去除未进入细胞的DCFH-DA。使用酶标仪在激发波长488 nm和发射波长525 nm下检测细胞二氯荧光黄(DCF)荧光强度,反映ROS生成水平。
各组细胞于冰上裂解,离心收集上清液,BCA试剂盒测定蛋白浓度。加入0.2 ml MDA检测工作液,混匀,沸水浴15 min,冷却至室温后酶标仪检测450 nm处吸光度,计算MDA含量;蛋白上清液中加入酶工作液,37 ℃孵育30 min,酶标仪检测450 nm处吸光度,计算SOD活力。
1.8细胞凋亡检测 取转染后的miR-con组、miR-145组、ddH2O组、PDTC组和miR-145+TNF-α组细胞,胰酶消化后4℃、1 337.5 r/min离心收集。按照Annexin V-FITC/碘化丙啶(PI)细胞凋亡检测试剂盒说明书分别加入5 μl Annexin V-FITC和10 μl PI,轻轻混匀,室温避光孵育15 min,使用流式细胞仪检测细胞凋亡。
1.9统计学分析 使用SPSS22.0 进行t检验、单因素方差分析。
2 结 果
2.1miR-145在卵巢癌组织中低表达 miR-145在卵巢癌组织中表达水平明显低于癌旁组织(0.34±0.16 vs 1.00±0.23,P<0.05)。
2.2过表达miR-145诱导OVCAR3细胞凋亡 与miR-con组比较,miR-145组细胞上清液中ROS和MDA水平显著升高(P<0.05),SOD水平显著降低(P<0.05);miR-145组细胞凋亡率明显增加(P<0.05),Bax蛋白表达显著上调,Bcl-2蛋白表达显著下调,Bcl-2/Bax比值明显降低(P<0.05),Caspase-3蛋白表达显著上调(P<0.05)。见图1、表1。
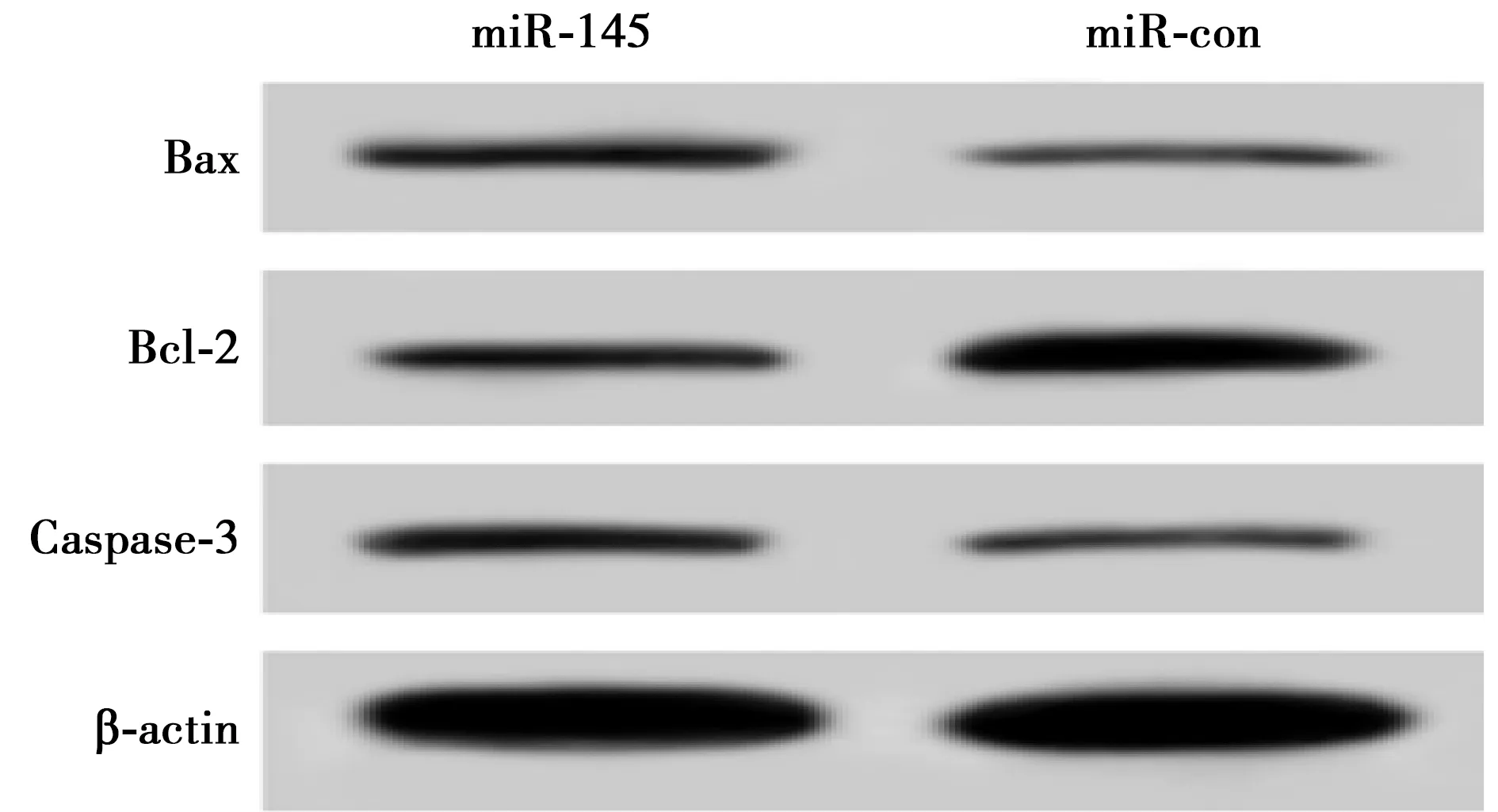
图1 过表达miR-145对OVCAR3细胞中Bax、Bcl-2、Caspase-3蛋白表达的影响

表1 OVCAR3细胞中miR-145高表达对细胞凋亡的影响
2.3miR-145靶向调控p65蛋白表达 通过Targetscan在线预测发现,p65 3′-UTR上存在miR-145的结合位点(图2),表明p65可能是miR-145的潜在靶基因;miR-145组p65 3′-UTR Wt质粒共转染后荧光素酶活性明显低于miR-con组(P<0.05),而与p65 3′-UTR Mut粒共转染后荧光素酶活性无明显变化(P>0.05),见表2;miR-con组、miR-145组、anti-miR-con组、anti-miR-145组p65蛋白表达分别为:(0.99±0.03)、(0.46±0.04)、(1.03±0.05)、(1.54±0.06)。在OVCAR3细胞中过表达miR-145,p65蛋白表达下调(P<0.05),抑制miR-145则p65蛋白表达显著上调(P<0.05)。见图3。

图2 miR-145与p65互补序列

表2 双荧光素酶报告基因实验
2.4抑制NF-κB信号通路促进ROS产生并诱导OVCAR3细胞凋亡 对比ddH2O组,PDTC组细胞上清液中ROS和MDA水平显著升高(P<0.05),SOD水平显著降低(P<0.05);细胞凋亡率显著增大(P<0.05)。见表3。

1~4:miR-con组、miR-145组、anti-miR-con组、anti-miR-145组图3 各组细胞中p65蛋白表达

表3 NF-κB信号通路抑制剂对卵巢癌ROS产生和细胞凋亡的影响
2.5miR-145下调NF-κB p65产生ROS诱导OVCAR3细胞凋亡 过表达miR-145上调OVCAR3细胞上清液中ROS和MDA水平(P<0.05),并显著降低SOD水平(P<0.05),细胞凋亡率显著增加(P<0.05);miR-145+TNF-α组细胞上清液中ROS和MDA水平及细胞凋亡率较miR-145组显著降低(P<0.05),SOD水平较miR-145组显著升高(P<0.05)。见表4。

表4 NF-κB激活剂对卵巢癌细胞ROS和凋亡的影响
与miR-con组相比:1)P<0.05;与miR-145组相比:2)P<0.05
3 讨 论
miRNA是内源性非编码RNA,是转录后水平基因表达的关键调节分子,其调节方式主要通过与靶mRNA 3′-UTR特异性结合〔11〕。miRNA与多种疾病的发生发展密切相关,多种miRNA可作为癌症诊断的标志物,通过多种途径调节肿瘤转移、血管生成并改善患者预后〔12,13〕。其中,miR-145在食管鳞状细胞癌、三阴性乳腺癌等肿瘤组织中呈低表达,并且能够通过调节细胞周期、NF-κB信号传导途径抑制癌细胞增殖、迁移和侵袭,诱导细胞凋亡,发挥肿瘤抑制作用〔14,15〕。而Zhang等〔16〕分析发现:多种miRNA分子在卵巢癌组织中异常表达,其中miR-145在卵巢癌组织中表达下调。本研究结果与上述结论〔16〕一致。NF-κB主要分布在细胞质中,能够与B细胞免疫球蛋白κ亲链基因增强子特异性结合,由p50、p52、p65、cRel、RelB 5种蛋白组成,是介导肿瘤和炎症发生的主要内在途径〔17〕。NF-κB是具有多向性调节作用的转录因子,其活化后减少癌细胞凋亡相关蛋白表达并诱导产生抗凋亡蛋白,从而抑制肿瘤细胞凋亡〔18〕。p65是分布和作用范围广泛的NF-κB因子之一,有研究〔19〕表明:沉默NF-κB p65 可上调Bax蛋白表达并抑制Bcl-2蛋白表达,从而调节细胞凋亡。Caspase-3是执行细胞凋亡的主要酶类,激活Caspase-3可诱导细胞凋亡;并通过p65调节NF-κB活性〔20,21〕。通过干扰p65可激活Caspase-3,从而诱导细胞凋亡〔22〕。ROS水平过高可导致蛋白变性、细胞膜脂质过氧化及DNA损伤;MDA由细胞膜中不饱和脂肪酸与氧自由基发生脂质过氧化生成;SOD是生物体内天然抗氧化酶;细胞内ROS水平失衡可激活细胞凋亡途径,诱导细胞凋亡〔23,24〕。
综上所述,在卵巢癌组织中,miR-145表达下调,过表达miR-145可通过上调ROS水平并抑制NF-κB p65蛋白表达从而诱导卵巢癌细胞凋亡。这一研究结果为卵巢癌的早期诊断及临床治疗提供理论基础,有可能为卵巢癌的治疗提供新靶点。
