胰腺癌hENT1蛋白表达与吉西他滨化疗疗效及预后的相关性
2019-05-07张怡杨晓丹王晓光吴斌倪全法宋政炜费建国
张怡 杨晓丹 王晓光 吴斌 倪全法 宋政炜 费建国
1嘉兴市中医院病理科,嘉兴 314000;2嘉兴学院附属第二医院肝胆外科,嘉兴 314000
胰腺癌的特点为发现晚、恶性程度高、预后差及治疗困难,80%以上患者确诊时已经发生广泛转移[1]。因此在综合治疗胰腺癌的方案中化疗的作用不可替代,是晚期胰腺癌唯一有效的方法。吉西他滨是目前胰腺癌化疗中的临床一线方案,但吉西他滨原发与继发性耐药限制了其临床疗效。近年来体外细胞学研究证实,吉西他滨主要通过人平衡型核苷酸转运体1 (human balanced nucleotide transporter 1,hENT1)途径进入癌细胞[2],胰腺癌细胞hENT1 表达水平与吉西他滨对胰腺癌的疗效呈正相关[3-4]。本研究采用免疫组织化学法检测胰腺癌组织hENTl水平,分析胰腺癌hENT1蛋白表达与吉西他滨化疗疗效、不良反应及预后的相关性。
资料与方法
一、临床资料
收集2013年6月至2016年1月间嘉兴市第二医院肝胆胰外科及嘉兴市中医院肝胆胰外科收治并经病理确诊的胰腺癌患者83例,其中男性49例,女性34例,年龄48~86岁,平均68岁。记录患者的性别、年龄、临床症状及肿瘤原发部位、肿瘤大小、TNM分期、CA19-9水平、CEA水平、有无肝脏转移。所有患者影像学检查可见测量或可评价病灶,既往未接受过全身放化疗、生物治疗及其他特殊治疗,化疗前所有患者血常规、肝肾功能及心肺功能基本正常。本研究经嘉兴市第二医院伦理委员会批准,患者及家属均签署知情同意书。
二、化疗方案及临床评价
83例患者均采用临床一线化疗方案:吉西他滨1 200 mg/m2,1次/周,连用7周,休1周后改为连用3周休1周,4周为1个疗程,重复疗程直到患者出现病情进展或不可耐受的不良反应时终止[5],患者均完成2个疗程以上化疗。每2个周期化疗结束复查CT或磁共振成像,参照实体瘤的疗效评价标准(RECIST 1.1)评价疗效,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。其中有效为CR+PR+SD的例数,耐药为PD的例数。患者出院后通过门诊或电话进行随访,记录患者的生存状态和死亡时间,总生存期定义为疾病确诊之日起至末次随访或死亡日期,无进展生存期(progression-free survival,PFS)定义为患者确诊之日起至第1次发生肿瘤进展或死亡时间,无进展生存率为无进展生存患者所占百分比。随访截止期为2016年3月31日。不良反应评价参照美国国家癌症中心制定的标准(CTCAE3.0)分为Ⅰ~Ⅳ级。
三、癌组织hENT1蛋白表达检测
取内镜超声下细针穿刺胰腺癌患者活检的组织,采用常规免疫组织化学染色法检测hENT1蛋白表达。兔抗人hENT1一抗及羊抗兔二抗均购于Abcam公司,抗体稀释比例为1∶200。DAB显色试剂盒及免疫组化全自动染色仪均购于Leica公司。以PBS代替一抗作为阴性对照。由两位病理科主任医师采用双盲法读片,每张病理切片随机选取5个高倍镜视野(200倍),以胞膜出现棕黄色颗粒为染色阳性,并依据阳性细胞百分率及染色程度进行评分。阳性细胞百分率评分:阴性为0分,阳性细胞≤10%为1分,11%~25%为2分,26%~50%为3分,>50%为4分;染色强度评分:无色为0分,淡黄色为1分,黄或棕黄色为2分,褐或棕褐色为3分。两评分相加作为总评分,≤2分为阴性,3~4分为弱阳性,5~6分为阳性,≥7分为强阳性。阴性及弱阳性归为低表达组,阳性及强阳性归为高表达组。
四、统计学处理
结 果
一、影响吉西他滨化疗疗效的因素
83例胰腺癌组织中37例(44.6%)hENT1高表达,46例(55.4%)低表达(图1)。吉西他滨化疗疗效与患者的性别、年龄、临床症状及肿瘤原发部位、肿瘤大小、TNM分期、CA19-9水平、CEA水平、有无肝脏转移均无相关性,但高表达组的吉西他滨耐药率达78.1%,低表达组为50.0%,差异有统计学意义(表1)。
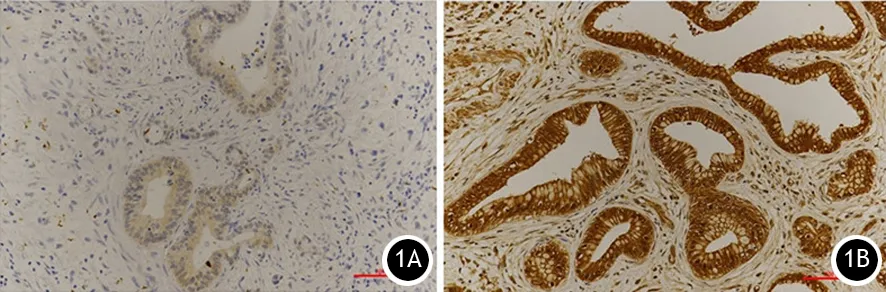
图1 胰腺癌组织hENTl蛋白高表达(1A)和低表达(1B)(免疫组化 ×200)
二、胰腺癌组织hENT1蛋白表达与化疗不良反应的关系
所有患者均能耐受吉西他滨化疗不良反应,无化疗相关性死亡。主要的不良反应表现为消化道反应、骨髓抑制与流感样症状,且多为Ⅰ~Ⅱ级,仅低表达组有4例Ⅲ~Ⅳ级白细胞减少,1例Ⅲ~Ⅳ级血小板减少。低表达组患者白细胞及血小板减少发生率显著高于高表达组,差异有统计学意义,而两组间其他不良反应的发生率差异均无统计学意义(表2)。
三、胰腺癌组织中hENT1蛋白表达与患者生存期的关系
随访2~23个月,平均随访10.9个月,无1例失访。低表达组、高表达患者的中位生存期分别为11、15个月(图2A),1年PFS分别为19.4%、50.0%(图2B),低表达组显著低于高表达组,差异均有统计学意义(P值分别为0.000,0.045)。
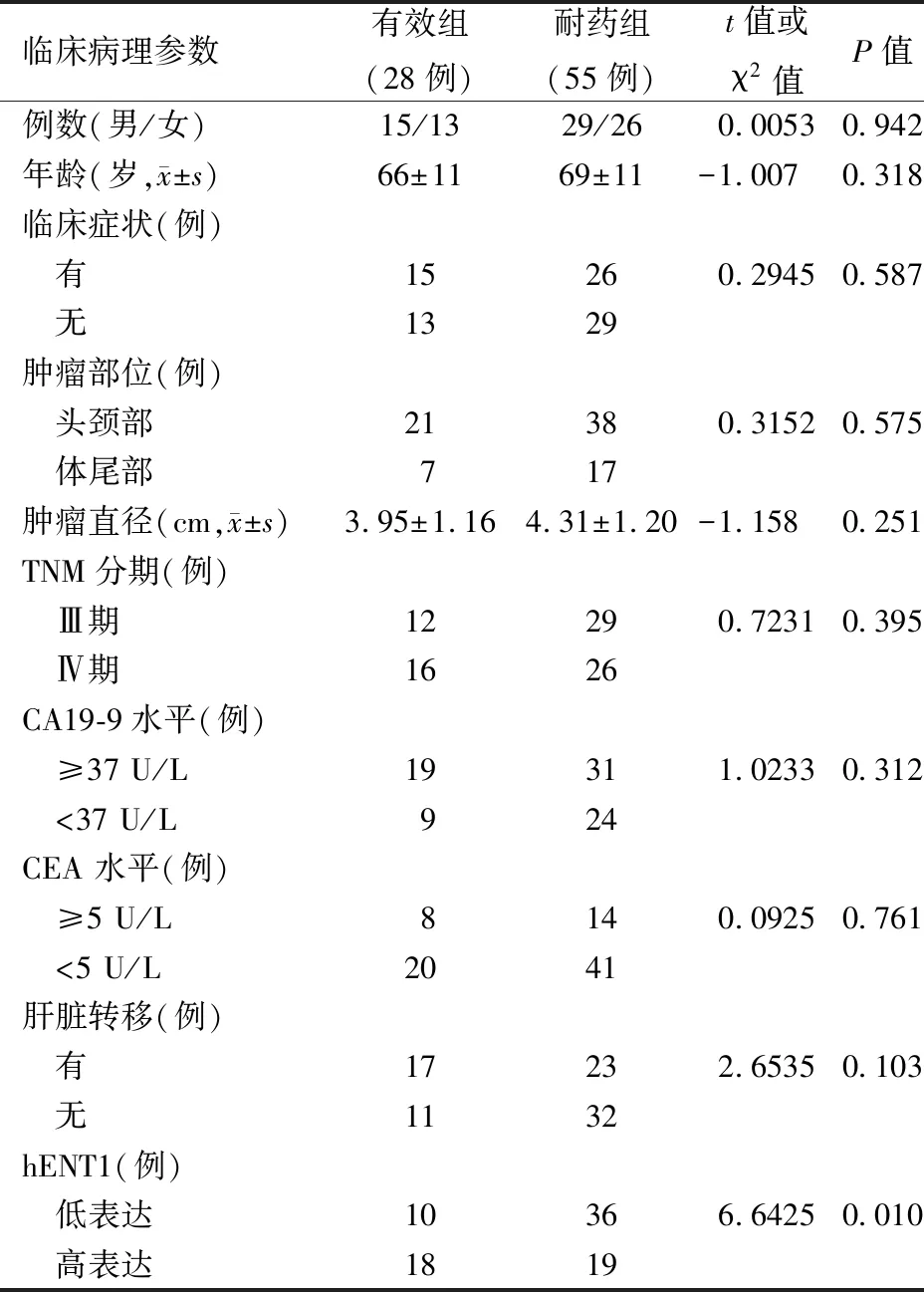
表1 吉西他滨化疗疗效与胰腺癌临床病理参数的关系
表2胰腺癌组织hENT1蛋白表达与化疗不良反应的关系[例(%)]
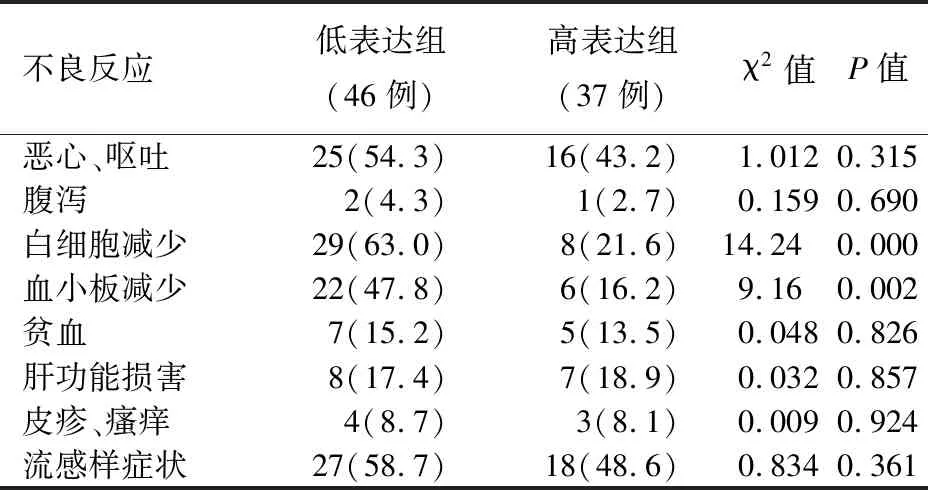
不良反应低表达组(46例)高表达组(37例)χ2值P值恶心、呕吐25(54.3)16(43.2)1.0120.315腹泻2(4.3)1(2.7)0.1590.690白细胞减少29(63.0)8(21.6)14.240.000血小板减少22(47.8)6(16.2)9.160.002贫血7(15.2)5(13.5)0.0480.826肝功能损害8(17.4)7(18.9)0.0320.857皮疹、瘙痒4(8.7)3(8.1)0.0090.924流感样症状27(58.7)18(48.6)0.8340.361
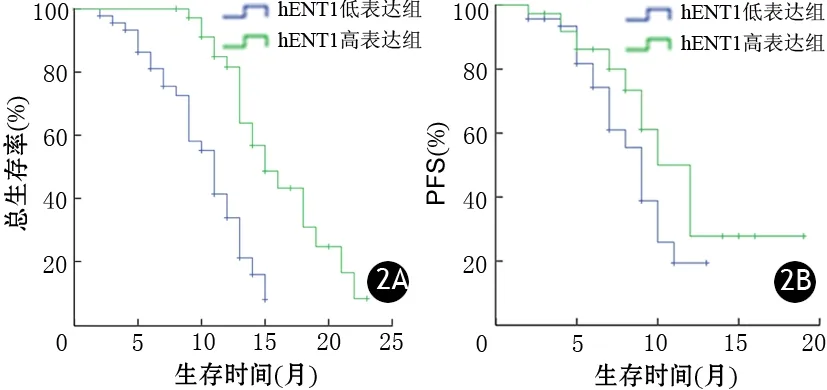
图2 胰腺癌hENTl高表达组与低表达组患者的中位生存期(2A)及1年PFS(2B)
讨 论
胰腺癌是恶性程度极高的消化道肿瘤,近年来其发病率、病死率呈逐年增高趋势,占全部恶性肿瘤死亡率的7%,位居恶性肿瘤死亡率第4位[6]。目前手术是唯一可能治愈的方法,但适合根治性手术治疗的患者不到10%[7],中位生存期仅为15个月,5年生存率只有5%左右[8],因此化疗在胰腺癌综合治疗中发挥着重要的作用,尤其对晚期胰腺癌是唯一有效的治疗方法。迄今为止吉西他滨为胰腺癌临床化疗药物中的一线药物,国内外多项Meta分析指出吉西他滨为基础的化疗方案可有效提高晚期胰腺癌患者的PFS及总生存期[9-11],而吉西他滨化疗产生的不良反应使该治疗方式的临床获益受到了大大的影响。
吉西他滨系胞嘧啶核苷衍生物,跨膜转运有赖于特定的核苷转运蛋白,而hENTl是目前发现的在人体内转运吉西他滨的主要蛋白[2]。国外部分研究结果提示外周血hENT1高表达与吉西他滨化疗提高胰腺癌患者的无瘤生存期及总生存期密切相关,而hENT1低表达则预示着吉西他滨化疗效果不佳[3-4]。本研究结果显示,胰腺癌组织hENT1蛋白低表达患者的化疗耐药率明显高于高表达组,两组患者均可以耐受吉西他滨化疗不良反应,无化疗相关性死亡,但hENT1蛋白低表达组患者白细胞、血小板减少发生率显著高于hENT1蛋白高表达组,中位生存期和无进展生存期显著短于高表达组,差异均有统计学意义,证实了hENT1低表达可以降低吉西他滨对胰腺癌患者的疗效及预后。已知hENTl由位于6p21.2-p21.1上SLC29A1基因编码[12],本研究团队前期研究发现胰腺癌患者SLC29A1基因1228位点T→A突变型胰腺癌患者的吉西他滨化疗不良反应发生率高,疗效差[13],推测hENT1蛋白表达降低减少了血液中的吉西他滨转运入胰腺癌细胞,降低了吉西他滨化疗疗效。
利益冲突所有作者均声明不存在利益冲突
