丁苯酞对溴化乙锭诱导的脱髓鞘大鼠胼胝体Bcl-2和Bax表达的影响
2019-04-18韦雷黄琪曾春梅吴月娟董乐吴原
韦雷 黄琪 曾春梅 吴月娟 董乐 吴原
作者单位:530021 广西医科大学第一附属医院神经内科
丁苯酞(Dl-3-n-butylphthalide,NBP)是从芹菜籽中分离出的一种有效成分,其化学名是消旋-3-正丁基苯酞,是我国第3个拥有自主知识产权的药物,目前主要应用于缺血性脑卒中的治疗。大量研究证实NBP可阻断缺血性脑卒中所致脑损伤的多个病理环节[1-2],可有效改善线粒体功能,通过对线粒体介导的凋亡途径影响细胞的状态[3-5]。作者团队前期研究发现,NBP可通过抗凋亡途径保护神经髓鞘的完整性[6],但具体疗效及机制仍不明确。本研究通过观察NBP对溴化乙锭(ehidium bromide,EB)诱导的脱髓鞘大鼠胼胝体B细胞淋巴瘤/白血病-2基因(B-cell lymphoma/leukemia 2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 asociated X potein,Bax)表达的影响,旨在初步探讨NBP对中枢神经系统脱髓鞘疾病的保护作用及其可能机制,为NBP的临床应用提供依据。
1 材料和方法
1.1实验动物成年健康雄性SD大鼠18只,9~10周龄,体重220~250 g,由广西医科大学动物实验中心提供。所有大鼠在SPF级动物房内饲养,室温控制在22~25 ℃,自然光照,自由进食和饮水。将大鼠随机分为模型组、治疗组、对照组,每组6只。
1.2主要试剂及仪器EB购自Sigma-Aldrich公司,NBP注射液(规格:25 mg:5 mL)购自石药集团恩必普药业有限公司,Luxol blue solution染色液购自北京索莱宝科技有限公司,Bcl-2、Bax多克隆抗体购自Abcam公司,免疫组化试剂盒购自北京中杉金桥生物技术有限公司,脑立体定位仪购自深圳瑞沃德生命科技有限公司,10 μL微型进样器购自上海高鸽工贸有限公司。
1.3方法
1.3.1脱髓鞘大鼠模型制备:腹腔注射10 %(质量浓度)水合氯醛麻醉大鼠后固定于脑立体定位仪上,采用10 μL微型进样器以0.05 μL/min速度给予模型组及治疗组大鼠注射5 μL 0.05%(质量浓度)EB至右侧侧脑室(AP:-1.0 mm;ML:+2.0 mm;DV:+3.5 mm)[7],对照组大鼠以同样方法注入等体积生理盐水。第2天起治疗组于每天上午10时按体质量30 mg/(kg·d)腹腔注射NBP注射液,共10 d。模型组、对照组腹腔以同法注射等量生理盐水。
1.3.2取材及石蜡切片制备:大鼠经腹腔注射10%(质量浓度)水合氯醛麻醉,打开胸腔暴露心脏,灌注针经左心室达升主动脉处固定,剪开左心耳,快速灌注生理盐水,待左心耳流出液体变清亮后改用 4%(质量浓度)多聚甲醛灌注,当大鼠肝脏及四肢变硬后完成灌注。将大鼠断头取脑置于4%(质量浓度) 多聚甲醛进行后固定。常规石蜡包埋,沿侧脑室注射进针部位附近进行5 μm连续冠状位切片备用。
1.3.3HE染色:取石蜡切片常规脱蜡、水洗;苏木素染色5 min后水洗,1%(体积分数)盐酸酒精分化5 s,返蓝10 min,伊红染色1 min后水洗;常规脱水、透明、封片;在光学显微镜(10×20放大倍数)下观察胼胝体形态学改变并采集图片 。
1.3.4LFB髓鞘染色:取石蜡切片进行常规脱蜡、水洗;95%(体积分数)乙醇漂洗;加入Luxol blue solution染色液,室温过夜;加入95%(体积分数)乙醇洗去多余染色液,蒸馏水冲洗;加入Luxol分化液分色15 s;加入70%(体积分数)乙醇分色30 s至灰白质清晰,蒸馏水冲洗;伊红染色1 min后水洗;常规脱水、透明、封片;在光学显微镜(10×20放大倍数)下观察胼胝体脱髓鞘程度并采集图片。取每张切片脱髓鞘最明显的视野,运用IPP软件计算髓鞘脱失率,并取平均值表示。髓鞘脱失率(%)=髓鞘脱失面积/该视野下胼胝体面积×100%。
1.3.5Bcl-2和Bax表达水平检测:采用免疫组化法进行检测。取石蜡切片进行常规脱蜡、水洗;入0.01 mol/L(pH 6.0)枸橼酸钠抗原修复液,高压修复10 min后自然冷却,用PBS液漂洗3次;加入3%(质量分数)H2O215 min,PBS液漂洗3次;室温下血清封闭30 min;滴加一抗(Bcl-2浓度为1∶120,Bax浓度为1∶240)孵育,放入4 ℃冰箱过夜,室温复温1 h,用PBS液漂洗3次;滴加生物素标记IgG二抗及辣根酶标记链霉卵白素工作液各30 min,PBS液漂洗3次;滴加DAB显色剂,通过光学显微镜观察显色程度,达到最佳显色程度后置于双蒸水内终止显色反应,用PBS液漂洗3次;苏木素染色5 min后水洗,1%(体积分数)盐酸酒精分化5 s,返蓝10 min;常规脱水、透明、封片;在光学显微镜(×400放大倍数)下观察Bcl-2及Bax在胼胝体的表达情况并采集图片。选择5个具有代表性的视野,运用IPP软件分别标记阳性细胞(胞浆黄染为阳性细胞)及阴性细胞,计算每个视野阳性细胞表达率(阳性细胞数/总细胞数×100%),取平均值表示Bcl-2和Bax表达水平。
1.4统计学处理采用SPSS 23.0软件进行统计分析,对数据进行正态性和方差齐性检验,符合正态性分布的计量资料以均数±标准差表示,多组均数组间比较采用单因素方差分析( ANOVA) ,两两比较采用LSD-t检验。取α=0.05。
2 结果
2.1髓鞘损伤及脱失情况HE染色结果显示,对照组大鼠胼胝体完整,形态均匀一致;模型组胼胝体结构不清、完整性遭破坏,可见大量空泡形成;治疗组空泡较少(图1)。LFB髓鞘染色结果显示,对照组胼胝体完整,形态均匀一致,而模型组胼胝体可见大片区域髓鞘未被蓝染,提示髓鞘脱失改变,治疗组与模型组相比,髓鞘脱失率明显减小(图2、表1)。
2.2脑胼胝体Bcl-2和Bax表达结果见表1、图3~4。免疫组化染色结果显示各组大鼠脑胼胝体细胞排列均较为规则,与模型组相比,治疗组Bcl-2阳性细胞表达率明显升高,而Bax阳性细胞表达率明显降低。

注:A:模型组;B:治疗组;C:对照组;箭头所示为胼胝体结构不清、空泡形成 图1 各组大鼠脑胼胝体HE染色结果(比例尺=50 μm)
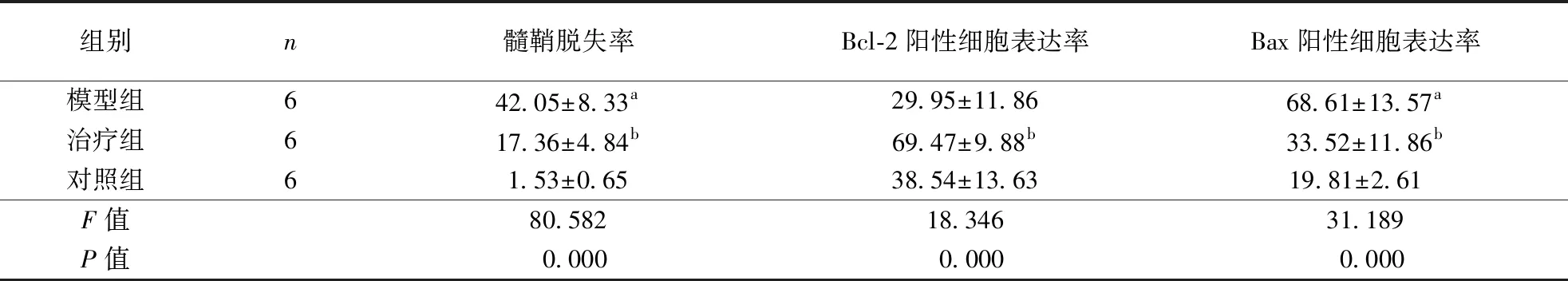
表1 各组大鼠髓鞘脱失率及脑组织Bcl-2和Bax阳性表达率比较(x±s,%)
注:与对照组相比,aP<0.01;与模型组相比,bP<0.01;Bcl-2:B淋巴细胞2基因,图3同;Bax:Bcl-2相关X蛋白,图4同

注:A:模型组;B:治疗组;C:对照组 图3 各组大鼠脑组织Bcl-2阳性细胞表达(免疫组化,比例尺=20μm)
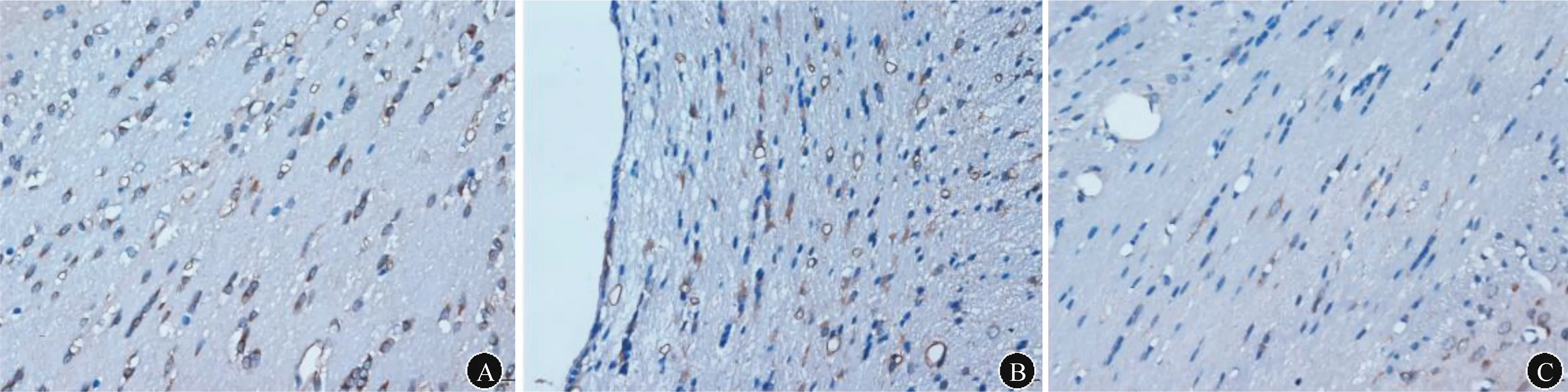
注:A:模型组;B:治疗组;C:对照组 图4 各组大鼠脑组织Bax阳性细胞表达水平(免疫组化,比例尺=20 μm)
3 讨论
中枢神经系统脱髓鞘疾病是一组以脑和脊髓髓鞘破坏或脱失为主要特征的疾病。近年来,细胞凋亡特别是少突胶质细胞凋亡在脱髓鞘病变中的作用越来越受到重视。有研究结果显示,近1/3的多发性硬化患者中,其病理改变与早期细胞凋亡有关[8]。Caprariello等[9]通过诱导少突胶质细胞凋亡建立了多发性硬化病理模型。目前已知多种药物和化学制剂导致的中毒性脱髓鞘损害也与细胞凋亡相关[10]。随着检测技术的发展,细胞凋亡可能将在更多的中枢神经系统脱髓鞘疾病中被发现。
在细胞凋亡过程中,Bcl-2基因家族起着至关重要的作用。Bcl-2家族可以大致分为两类:一类具有抗凋亡作用,主要包括Bcl-2和Bcl-xl等;另一类则具有促凋亡作用,主要包括Bax、Bak、Bim等,目前最重要及最受关注的是Bcl-2和Bax[11]。在线粒体介导的细胞凋亡途径中,线粒体外膜透化致使细胞色素C(CytC)释放到细胞质是启动凋亡级联反应的关键步骤[12]。而Bcl-2与Bax蛋白能通过调控线粒体膜对CytC的通透性来影响细胞的状态,二者的比值变化决定细胞的凋亡与生存:当各种凋亡信号引起Bax高表达时,Bax蛋白形成同源二聚体,增加线粒体膜通透性,促进线粒体中的CytC释放至细胞质,与凋亡蛋白酶活化因子1(Apaf-1)结合形成多聚体,再进一步与凋亡起始分子Caspase-9结合形成凋亡复合体,凋亡复合体激活Caspase-9,从而激活下游的凋亡执行分子Caspase-3等诱导细胞凋亡的级联反应进而造成细胞凋亡;而Bcl-2高表达时,Bax蛋白与Bcl-2蛋白形成异源二聚体,通过降低线粒体膜通透性,抑制CytC的释放从而抑制细胞凋亡[13]。
研究发现,NBP具有改善脑组织微循环及能量代谢、清除氧自由基、抑制细胞内钙超载、抑制血小板及血栓形成、抗炎等多种药理作用,对缺血性脑卒中具有较好的治疗效果[1-2]。此外,NBP还能通过多种途径改善线粒体功能,并通过对线粒体介导的凋亡途径进行调控从而抑制神经元细胞的凋亡[3-5]。因此,针对上述中枢神经系统脱髓鞘疾病中有关细胞凋亡的机制,作者研究团队推测NBP可能通过抗凋亡途径发挥保护髓鞘的作用,并由前期研究得以初步验证[6]。
胼胝体为两侧大脑半球之间的联络纤维所构成的脑白质。本研究通过采用EB侧脑室注射的方法诱导大鼠胼胝体产生脱髓鞘改变,进而探讨腹腔注射NBP对中枢神经系统脑白质髓鞘的保护作用,结果显示,与模型组相比,治疗组Bcl-2蛋白表达明显增多,而Bax蛋白表达明显减少,表明NBP可能通过上调Bcl-2、下调Bax表达抑制细胞凋亡进而对脑白质产生保护作用,从而减少髓鞘的脱失。由此作者认为,NBP可能对中枢神经系统脱髓鞘疾病具有疗效,其机制可能与调节细胞凋亡有关,这将为NBP的临床应用提供新的选择及理论依据。关于NBP在脱髓鞘模型中作用于何种神经细胞以及如何调控凋亡途径仍需进一步研究。
