siRNA沉默染色质解旋酶DNA结合蛋白1对卵巢癌HO-8910PM细胞增殖、侵袭、迁移的影响
2019-03-19李善华
李善华 张 薇
卵巢癌为妇科常见恶性肿瘤,发病率居妇科肿瘤中第三位,死亡率居第一位,给患者身体健康造成严重威胁[1]。该病起病隐匿,早期缺乏明显临床症状,易出现转移,患者5年内生存率不足40%[2]。探究卵巢癌的发病机制对于该病的靶向治疗具有十分积极的意义。卵巢癌的侵袭和转移涉及多因素、多基因共同参与,染色质解旋酶DNA结合蛋白-1(Chromodomain Helicase/ATP DNA Binding Protein 1-Like Gene,CHD1L)在多种肿瘤中如肝癌、结直肠癌、膀胱癌中均呈高表达[3-5],且与癌细胞的增殖、侵袭和迁移有关,然而其在卵巢癌发生发展中的具体作用目前尚不明确。本研究通过将siRNA干扰CHD1L转染至卵巢癌细胞,观察其对卵巢癌细胞增殖、侵袭和迁移的影响并分析其可能的作用机制,以期为卵巢癌的靶向治疗提供一定的理论基础。
1 材料与方法
1.1 实验细胞
高转移卵巢癌细胞株HO-8910PM购于中科院上海细胞生物研究所,在含有5%CO2、37℃细胞培养箱内常规培养,每隔3天进行传代培养一次,细胞培养3代后消化细胞,PBS溶液清洗,离心后保留下层细胞,备后续研究。
1.2 试剂与药品
胎牛血清(Fetal Bovine Serum,FBS)、胰蛋白酶购于杭州四季青有限公司;青霉素、链霉素购于美国Gibco公司;siRNA-CHD1L质粒购于上海吉玛公司;Lipofectamine 2000转染试剂购于美国Invitrogen公司;RNA反转录试剂盒购于美国Thermo公司;qRT-PCR检测试剂盒购于日本Takara公司;BCA蛋白浓度测定试剂盒、DMEM培养基购自于碧云天公司;DMSO购于美国Sigma公司;辣根过氧化物酶(Horse Radish Peroxidase,HRP)山羊抗兔IgG二抗购自于美国Amresco公司;TRIzol试剂、NF-κB、MMP-2、MMP-9一抗购自于美国R&D公司;结晶紫染液购自于北京中杉金桥生物技术有限公司;倒置显微镜购于Olympus公司;酶标仪购于美国Thermo Fisher Scientific公司;流式细胞仪购于美国Becton,Dickinson 公司;凝胶图像分析仪购于英国Alpha公司。Transwell小室购自北京优尼康生物科技有限公司(24孔,孔径3μm);PCR扩增仪购自美国ABI公司。
1.3 实验方法
1.3.1小干扰RNA(Small Interference RNA,siRNA)的合成:从GenBank中获取人CHD1L基因序列,根据siRNA设计原则,设计靶向CHD1L的siRNA序列,同时设定阴性对照(si-NC)序列,见表1。
微循环学 杂志2019年第29卷第1期基础与实验 ▶
1.3.2细胞转染:收集对数生长期HO-8910PM细胞,用0.25%胰酶溶液消化后制备单细胞悬浮液,将细胞密度调整为1×106个/孔接种于六孔板,添加细胞培养液充分混匀后,放置在5%CO2、37℃饱和湿度培养箱中过夜培养,待细胞融合度达到80%-90%时,更换无FBS培养液培养1h,参照 Lipofectamine 2000试剂盒转染,将si-NC组、si-CHD1L质粒分别转染至HO-8910PM细胞培养,命名为si-NC、si-CHD1L组,同时设定以未转染质粒的细胞作为空白对照组(对照组),每组均设定6个重复孔,转染后添加无FBS培养基培养6—8h,随后更换为含FBS培养基,继续培养48h,收集细胞,进行后续检测。
1.3.3实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)检测细胞CHD1L mRNA表达:用TRIzol法提取转染后细胞总RNA,测定浓度以及纯度后,根据RNA反转录试剂盒将RNA反转录成cDNA,CHD1L上游引物:5’-TTG GTG GTG AAT ATG AAA GG-3’,下游引物:5’-TAA GAG TCG TTG GCG AGT-3’;GAPDH:上游引物:5’-GCA CCG TCA AGG CTG AGA AC-3’,下游引物:5’-ATG GTG GTG AAG ACG CCA GT-3’;反应体系:TaqDNA 聚合酶1μl,上、下游引物各2μl,cDNA 1μl,缓冲液10μl,10mM dNTP 1μl,ddH2O 33μl;反应条件:预变性:95℃ 5min,变性:95℃ 30s,延伸:62℃ 15s,共35个循环,每个样本均设定3个重复。反应结束后利用2-△△Ct法对数据进行统计,以GAPDH为内参分析CHD1L mRNA相对表达量。
1.3.4CCK-8法检测细胞增殖情况:分别收集转染后细胞,将细胞浓度调整为1×104个/ml接种细胞培养板,培养24,36,48,72h后每孔内添加CCK-8试剂,继续培养2h后,收集细胞,添加150μl DMSO溶液混匀后静置5min,酶标仪检测450nm波长下各组细胞吸光度值(OD),计算si-CHD1L对细胞生长的抑制。细胞增殖抑制率(%)=(1-实验组OD/Control组OD)×100%。每个浓度设置6个复孔。
1.3.5划痕实验检测细胞迁移能力:收集细胞,将细胞浓度调整为1×104个细胞在细胞培养皿中,将细胞放置37℃、5%CO2培养箱中过夜培养后更换新鲜培养基,移液枪枪头蘸取细胞培养液在培养基表面划长约2cm的痕迹,培养48h后置于显微镜下观察细胞迁移变化。
1.3.6Transwell小室系统检测细胞迁移、侵袭:采用Transwell小室测定细胞迁移和侵袭,收集细胞后密度调整为1×105个/ml,上室中加入不含FBS的培养基并接种细胞,同时将含FBS的培养基添加至下室。37℃孵育24h后,去除在膜表面残留细胞,无水甲醇室温固定30min,添加0.1%结晶紫染液对膜染色,置于显微镜下统计细胞迁移数量。进行侵袭实验时,用Matrigel预涂上室风干,其余步骤同迁移实验。
1.3.7蛋白免疫印迹(Western Blot,WB)检测相关蛋白表达:收集转染后细胞消化后添加RIPA细胞裂解液冰上放置30min,离心后收集上清,采用蛋白提取试剂盒提取细胞总蛋白,BCA法检测蛋白浓度,蛋白上样量统一为20μg,SDS-PAGE电泳结束后,将蛋白凝胶转移至PDVF膜上,4℃中行转膜反应,脱脂牛奶封闭后加入MMP-2、MMP-9、NF-κB一抗稀释液(1∶500),4℃孵育过夜添加二抗稀释液,37℃孵育2h,ECL曝光显影后,以β-actin表达作为内参蛋白,置于凝胶成像系统中评估蛋白表达水平。以目的蛋白与β-actin蛋白条带灰度比值代表该指标的相对表达量。
1.4 统计学处理
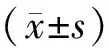
2 结 果
2.1 siRNA沉默CHD1L后CHD1L mRNA表达
各组CHD1L mRNA表达水平差异有统计学意义(F=37.281,P<0.05)。与对照组和si-NC组比较,si-CHD1L组细胞CHD1L mRNA表达降低,差异均有统计学意义(q均>10.344,P<0.05)。
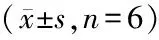
表2 HO-8910PM细胞中CHD1L mRNA表达
2.2 siRNA沉默CHD1L对HO-8910PM细胞增殖能力的影响
各组各时点HO-8910PM细胞增殖抑制率差异有统计学意义(P<0.05)。与对照组相比,si-NC组各时间点细胞增殖抑制率无明显变化(q均<0.085,P>0.05),si-CHD1L组细胞增殖抑制率较对照组和si-NC组均升高,差异均有统计学意义(q均>25.920,P<0.05)。

表3 siRNA沉默CHD1L对细胞增殖抑制率的影响
2.3 siRNA沉默CHD1L对HO-8910PM细胞迁移能力的影响
划痕实验显示,培养48h后,各组细胞划痕间距差异有统计学意义(P<0.05)。与对照组相比,si-NC组HO-8910PM细胞迁移能力无显著变化,差异无统计学意义(q=1.125,P>0.05),si-CHD1L组HO-8910PM细胞迁移能力较对照组和si-NC组均降低,差异具有统计学意义(q均>13.680,P<0.05),见图1、表4。

图1 划痕实验检测HO-8910PM细胞迁移能力
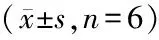
表4 各组HO-8910PM细胞间划痕间距的比较
2.4 siRNA沉默CHD1L对HO-8910PM细胞迁移、侵袭数量的影响
各组细胞迁移、侵袭细胞数量差异有统计学意义(P<0.05)。与对照组相比,si-NC组HO-8910PM细胞迁移、侵袭数量无显著变化,差异无统计学意义(q均<1.260,P>0.05),si-CHD1L组HO-8910PM细胞迁移、侵袭数量降低,差异具有统计学意义(q均>8.410,P<0.05)。
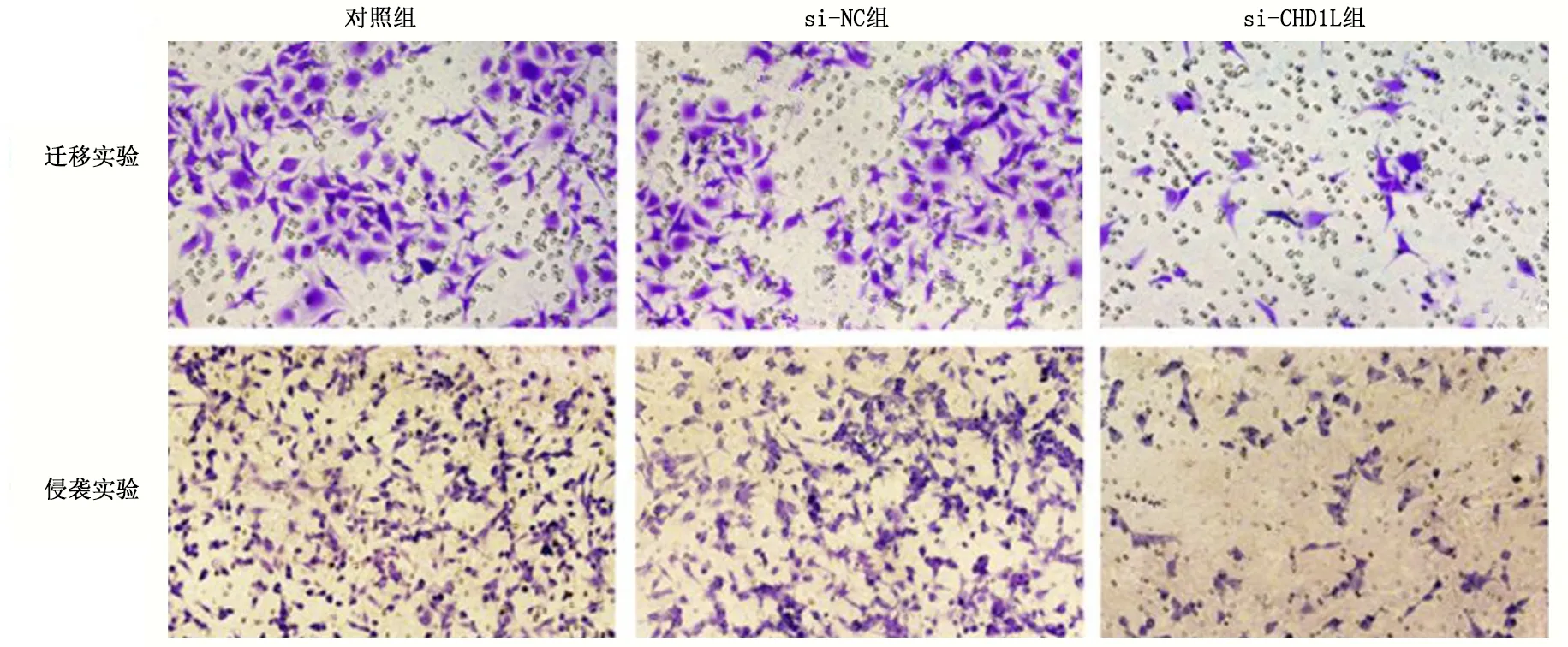
图2 Transwell小室检测HO-8910PM细胞迁移、侵袭能力

表5 各组HO-8910PM细胞迁移、侵袭能力比较个,n=6)
2.5 siRNA沉默CHD1L对HO-8910PM细胞NF-κB、MMP-2、MMP-9蛋白表达的影响
各组NF-κB、MMP-2、MMP-9蛋白表达水平差异有统计学意义(P<0.05)。与对照组相比,si-NC组NF-κB、MMP-2、MMP-9蛋白表达无显著变化,差异无统计学意义(q均<1.200,P>0.05),si-CHD1L组NF-κB、MMP-2、MMP-9蛋白表达降低,差异具有统计学意义(q均>12.450,P<0.05)。
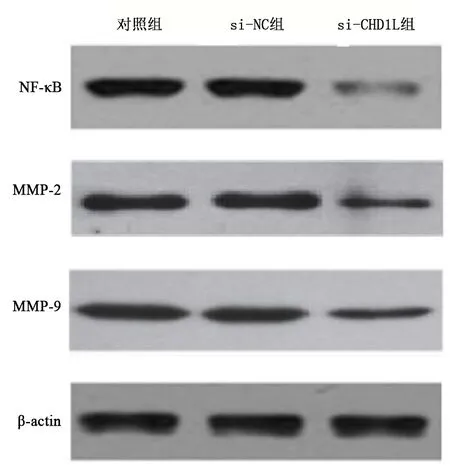
图3 WB检测NF-κB、MMP-2、MMP-9蛋白表达
表6 各组NF-κB、MMP-2、MMP-9蛋白表达水平比较
3 讨 论
卵巢癌患者易发生局部侵袭、淋巴结转移,使侵润组织和已发生转移的肿瘤组织难以完全清除,进而影响手术治疗效果[6]。虽然近年来卵巢癌手术治疗已取得较大完善和进步,但卵巢癌仍是威胁妇女生命健康的恶性肿瘤之一。流行病学研究显示,卵巢癌患者的5年存活率不足40%[7]。肿瘤侵袭、转移为一个多步骤、多阶段、多基因参与的复杂的生物过程,探讨卵巢癌侵袭、转移基因对阐明卵巢癌侵袭、转移的发生机制以及寻找治疗靶标具有十分重要的意义。
CHD1L位于人染色体1q21区,属于SNF2类家族,在转录、蛋白-DNA结合等方面发挥十分重要的调控作用。CHD1L为SNF2-类亚家族成员中唯一一个致癌基因[8]。Chen等[9]研究显示CHD1L长期高水平表达能够促进肿瘤细胞增殖,加速恶性肿瘤的形成。Hu等[10]研究发现CHD1L与肿瘤细胞的侵袭及转移密切相关,通过激活细胞肌动蛋白丝的形成,加速细胞上皮间质转化进程,进而促进肿瘤细胞的侵袭、迁移。Su 等[11]研究发现CHD1L蛋白在胃癌患者组织中高表达,其表达水平与远处转移呈显著正相关,且高表达者预后较差。乳腺癌患者CHD1L呈高表达,其表达与淋巴结转移密切相关,且可激活m TOR/MMP通路提高细胞的侵袭、迁移能力[12]。在小鼠的体内实验发现,抑制CHD1L表达后,肿瘤的侵袭和转移能力明显降低,小鼠生存期明显延长[13]。Ji 等在肝细胞癌中发现,过表达CHD1L可影响小鼠肝细胞癌进展,如可促进细胞增殖、粘附、迁移等[14]。本研究显示siRNA干扰CHD1L后HO-8910PM细胞增殖、侵袭、迁移能力均明显降低,提示CHD1L可能为调控卵巢癌细胞转移的重要因子。
NF-κB属于重要核转录因子,在未受到外界刺激情况下,其与抑制物结合以未激活状态存于细胞质内,在细胞受到外界刺激、损伤后,抑制物发生磷酸化且降解后,使NF-κB转移至细胞核中,调控细胞因子、黏附、趋化因子转录,进而参与肿瘤细胞的增殖、迁侵袭、转移过程[15,16]。研究显示NF-κB在卵巢癌的发生、发展中发挥重要作用。辛伐他汀可通过抑制NF-κB通路降低人高转移卵巢癌HO-8910PM细胞迁移、侵袭[17]。川楝素可通过抑制人卵巢癌细胞NF-κB和上皮型钙黏蛋白的表达,影响细胞侵袭和迁移能力[18]。本研究发现,siRNA沉默CHD1L后可明显降低NF-κB蛋白表达,提示CHD1L抑制后可能通过调控NF-κB表达,抑制卵巢癌细胞增殖、侵袭和迁移能力。
MMP能够降解细胞外基质,在癌细胞的侵袭和转移过程中发挥着重要作用。范从红等人研究表明,上调卵巢癌细胞中MMP-2的表达水平可提高卵巢癌细胞的侵袭、迁移能力[19]。氯化尼替丁通过ERK信号通路抑制MMP-2/9的产生,抑制卵巢癌细胞的迁移和侵袭,表明MMP-2/9与卵巢癌细胞的侵袭和转移密切相关[20]。本研究发现,siRNA沉默CHD1L后细胞中MMP-2、MMP-9蛋白的表达水平明显降低,提示沉默CHD1L后可能通过降低MMP-2、MMP-9的表达水平抑制卵巢癌细胞增殖、迁移和侵袭。
综上所述,siRNA沉默CHD1L后显著抑制卵巢癌HO-8910PM细胞增殖、侵袭、迁移增殖,可能是通过抑制NF-κB,下调MMP-2、MMP-9相关蛋白发挥作用。然而NF-κB作为转录调控的关键因子,涉及到多种蛋白表达调控,其过程十分复杂,具体的作用机制尚需深入研究。