蛋白磷酸酯酶2A通过MAPK信号通路抑制宫颈癌细胞侵袭*
2019-03-19郑红云申复进童永清王海博
郑红云 申复进 童永清 王海博 李 艳,#
蛋白磷酸酶2A(Protein Phosphatase 2A,PP2A)是真核牛物体内主要的Ser/Thr蛋白磷酸酶,能使蛋白质脱磷酸,在细胞代谢、分化、增殖、凋亡及细胞转化等生理过程中具有重要的调节作用[1]。人类许多肿瘤中PP2A相关亚基的活性显著下调[2],而抑制PP2A亚基活性则可明显促进肿瘤细胞的迁移和侵袭。研究报道抑制PP2A活性可通过抑制Wnt信号途径显著促进人类结直肠癌的远处转移[3],而c-MYC激活PP2A活性则可明显抑制乳腺癌的发生[4]。在哺乳动物体内,PP2A是最重要的丝氨酸/苏氨酸蛋白磷酸酯酶,可广泛调节细胞的各种信号途径[5]。MAPK信号途径广泛地调控一系列细胞活动,包括增殖、分化发育、迁移、凋亡等[6]。在MAPK家族中,研究最广泛三条转导通路:细胞外信号调节激酶(ERK1/2)、c-Jun氨基末端激酶(JNK)和丝裂原活化蛋白激酶p38MAPK信号转导途径[7],而PP2A可参与调节MAPK信号途径。
本课题前期结果表明PP2A在宫颈癌患者的血清学和肿瘤组织水平显著下调[7,8],提示PP2A可能参与了宫颈癌的发生发展。本研究拟在细胞学水平进一步研究PP2A影响宫颈癌细胞侵袭的可能机制。
1 材料与方法
1.1 细胞、质粒、试剂和仪器
1.1.1Hela细胞来源及培养:Hela细胞系购自武汉大学细胞库。采用RPMI 1640细胞培养基[加10%胎牛血清(FBS)和100单位的青链霉素],置于37℃、5% CO2培养箱培养。细胞2-3天换液一次,当细胞丰度达到80%左右时,弃旧的培养基,0.25%胰酶消化细胞5min,去掉胰酶,再加入新鲜的完全培养基,吸管吹打细胞,混匀,传代,进行后续实验。
1.1.2质粒:野生型PP2AC (wtPP2Ac)和干扰PP2Ac(siPP2A)质粒均由华中科技大学同济医学院神经系统重大疾病重点实验室提供[9]。
1.1.3主要试剂和仪器:进口胎牛血清(FBS)购自Gbico公司;DMEM、OPTI-MEM与Lipofectamine 2000均从Invitrogen公司购买;RPMI 1640 购自HyClone公司;氨苄青霉素和卡那霉素从TaKaRa Biotechllology公司购买;冈田酸(Okdaic Acid,OA)、D-erythro-Sphingosine(DES)购自CalBiochem公司。CO2培养箱(Heal force,hf151uv,上海力康);倒置显微镜(Olympus,日本);高压蒸气灭菌器(Hirayama,日本);台式高速离心机(Sigma公司);恒温水溶箱(武汉科技仪器厂);普通倒置荧光显微镜(Olympus,日本);双光子共聚焦显微镜(LSM510 Carl Zeiss,德国)。
1.2 细胞分组及处理
1.2.1药物干扰实验:共分为3组,对照组(常规方法培养的Hela细胞,n=6)、DES组(细胞培养液中加入10mM PP2A激动剂DES,n=6)和OA组(细胞培养液中加入10mM PP2A抑制剂OA,n=6)。
1.2.2质粒转染实验:共分为3组,对照组(DsRed组,n=6)、wtPP2A组(n=6)和siPP2A组(n=6),每组转染相应质粒DNA 0.8μg,具体操作如下:50μl的 Opti-MEM 培养基中加入质粒DNA 0.8μg;另一50μl Opti-MEM 培养基中加入 2μl Lipofectamine 2000 转染试剂,超净台内静置 5min 后将两者混合混匀,超净台内室温孵育25min; 将 100μl DNA与脂质体复合物直接加入培养孔,迅速置于37℃培养。
1.3 观察指标和方法
1.3.1细胞迁移率:利用小室穿孔实验观察PP2A对Hela细胞迁移能力的影响。在小室下层加入含10% FBS的DMEM/F12(作为趋化剂),小室上层是含1% FBS的DMEM/F12,将药物干预实验各组细胞种植于小室上层,细胞在趋化剂的作用下从上层往下层迁移,发生迁移的细胞粘附在膜的下层,6h后固定照相分析结果,细胞迁移率=小室膜下层细胞数/(小室膜上层细胞数+小室膜下层细胞数)×100%。
1.3.2细胞侵袭率:采用小室穿孔实验检测细胞侵袭率。事先将小室的半透明聚碳酯膜用PDL包被,小室放在一个24孔板内紫外照射,然后放置37℃培养箱备用。将质粒转染实验各组细胞转染相关质粒48h后经胰酶消化,重悬于含血清1%FBS的DMEM/F12中(0.5ml 的DMEM/F12中细胞为5×104个)加入小室上层。在紫外照射灭菌过夜的小室的小孔下层中加入0.75ml含10%FBS的RPMI 1640,将孔径为8μm的半透明聚碳酯膜覆盖;载有小室的12孔板在培养箱中放置6h后取出,将膜置于4% PFA中固定15min后,因质粒带有荧光,在激光共聚焦显微镜上观察膜上在孔中的细胞总数,拍照并计数;用棉签将上层未发生侵袭的细胞刮去,观察膜下层未发生侵袭的细胞,共聚焦显微镜拍照并计数膜上层和膜下层的细胞,膜上层细胞加上膜下层细胞为细胞总数,细胞侵袭率=膜下层细胞/(膜上层细胞+膜下层细胞)×100%。
经过治疗后,观察组有20例有效,临床治疗有效率是95.24%,对照组有14例有效,临床治疗有效率是66.67%,对两组的一般性资料对比不存在统计学差异性(P<0.05)。
1.3.3相关蛋白检测:采用蛋白免疫印迹实验(Western Blot)检测MAPK家族中JNK、p38、ERK及其相应的磷酸化水平以及基质金属酶9(MMP-9)水平。药物干扰实验各组细胞经药物处理48h后分离细胞,蛋白提取后BCA试剂盒测定进行蛋白定量。样品加入相应体积溴酚蓝(终浓度0.2%)和β-ME (终浓度10%),在振荡器上振荡20s,置水浴锅中水浴煮沸5—10min,煮沸后可以适当低速短暂离心以防蛋白挂在EP管壁上。用微量加样器取样品加入各个泳道,加样体积视不同组蛋白含量而定,以保证各组加样蛋白总量一致。加样后先用恒流(10mA/胶)电泳,待溴酚蓝指示剂电泳至浓缩胶(4%)与分离胶(10%)交界处成以线状时,改为恒压(100V)电泳至溴酚蓝到凝胶底部。然后将蛋白质从SDS-PAGE凝胶转移至NC或PVDF膜(提前用甲醇浸泡)上,275mA转移1h。孵育抗体及显色:蛋白转移印迹到NC或PVDF膜上,印迹有蛋白的NC或PVDF膜在室温下以5%脱脂牛奶封闭1h,与相应一抗在4℃孵育过夜,TBS-Tween 20 缓冲液洗膜3次,每次10min,与带辣根过氧化物酶的二抗在室温孵育1h,TBS-T缓冲液洗膜3次,每次10min,最后信号用ECL系统进行化学发光法检测。以β-actin为内参照,目的蛋白与β-actin蛋白条带灰度比值为该蛋白的相对表达量。
1.4 统计学处理
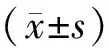
2 结 果
2.1 PP2A对体外药物干扰实验组Hela细胞迁移的影响
如图1所示,药物干预实验各组Hela细胞迁移率的差异有统计学意义(F=382.11,P<0.01)。与对照组比较,DES组Hela细胞迁移率明显降低(24.17%±1.47% vs 14.58%±1.12%,t=12.72,P<0.01),OA组Hela细胞迁移率明显明显增加(24.17%±1.47% vs 37.75%±1.73%,t=-14.67,P<0.01)。

注:与对照组比较,*P<0.01
2.2 PP2A对体外质粒转染实验组Hela细胞侵袭的影响
如图2所示,质粒转染实验各组Hela细胞侵袭率的差异有统计学意义(F=165.82,P<0.01)。与DsRed组比较,wtPP2A组细胞侵袭率明显降低(23.89%±0.95% vs 12.33%±0.82%,t=17.22,P<0.01),siPP2A组Hela细胞侵袭率明显明显增加(23.89%±0.95% vs 44.50%±5.10%,t=-9.40,P<0.01)。
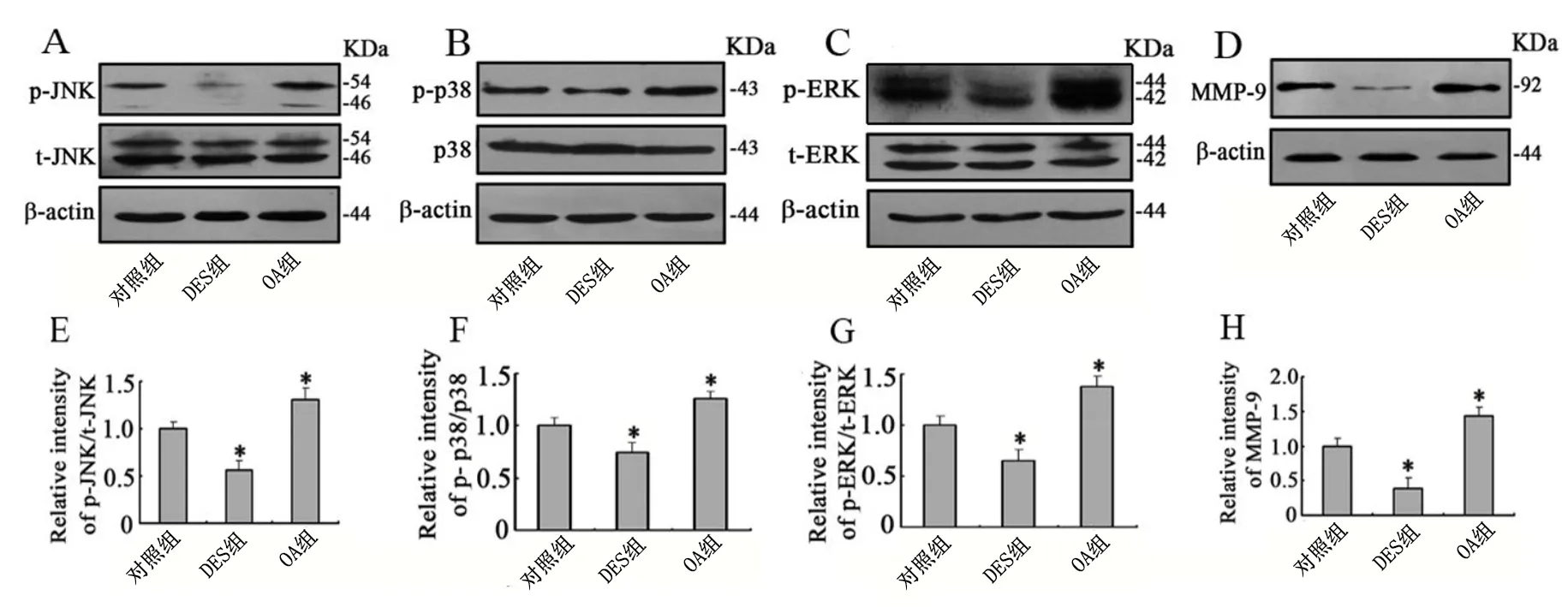
2.3 体外药物干扰实验组Hela细胞JNK、p38、ERK蛋白及其相应的磷酸化水平以及MMP-9蛋白质水平比较
对照组、DES组和OA组各种蛋白总蛋白水平差异无统计学意义(F均<1.00,P>0.05),而磷酸化水平及MMP-9蛋白质水平差异均有统计学意义(F均>610.02,P<0.01)。与对照组比较,DES组p-JNK (图3A, E)、p-p38(图3B, F)和p-ERK水平(图3C, G)以及MMP-9水平(图3D, H)均明显下调(t均>24.20 ,P<0.01),而OA组p-JNK (图3A, E)、p-p38(图3B, F)和p-ERK水平(图3C, G)及MMP-9水平(图3D, H)均明显升高(t均>10.08,P<0.01)。

注:与DsRed组比较,*P<0.01
注:与对照组比较,*P<0.01
3 讨 论
肿瘤转移是恶性肿瘤最重要的生物学特征。肿瘤细胞转移能力的高低与肿瘤细胞的运动性、粘连性和侵袭性以及新生血管的生成等诸多因素均密切相关。许多高度转移能力的恶性肿瘤细胞都具有很强的迁移和侵袭能力。因而,肿瘤细胞迁移和侵袭是肿瘤转移的前提,肿瘤细胞迁移突破基底膜是该过程的主要标志。
研究指出多种蛋白磷酸激酶在肿瘤的迁移和侵袭中起作用。随着分子诊断与个体化医疗研究的飞速发展,多种以激酶作为作用靶点的靶向药物己经开始研发,有些甚至已经作为肿瘤靶向治疗的一线用药正式投入临床使用[9]。目前研究结果表明许多激酶参与了肿瘤细胞的迁移和侵袭。如成簇黏附激酶(FAK)[10]、Src[11]、Crk[12]、磷脂酰肌醇(-3)激酶(PI3K)、丝裂原活化蛋白激酶MAPKs[13]及蛋白酪氨酸磷酸酶SHP-2[14]等均调节了细胞的迁移过程。丝裂原活化蛋白激酶激酶4(MAP2K4) 通过提高MMP-2表达促进人类前列腺癌细胞的迁移和侵袭[15]. GABRP可激活细胞外信号调节激酶1/2 (ERK1/2)刺激乳腺癌细胞的迁移[16]. 进一步研究报道,MAPK和PI3K/Akt 信号途径亦参与了卵巢癌的细胞迁移过程[17].随着药物研究的不断深入,研究者们发现激酶涉及的基因种类繁多,却无法在一个基因层面解决问题,于是寻找真正起决定作用的药物靶点显得尤为紧迫。虽然大量蛋白磷酸激酶参与了细胞迁移过程,但蛋白磷酸酯酶的作用仍然是保持细胞动态循环过程的关键分子。
PP2A是最重要的丝氨酸/苏氨酸蛋白磷酸酯酶,PP2A可调节细胞的增殖与分化。PP2A由结构亚单位A(65kD)、调节亚单位B(50-130kD)和催化亚单位C(36 kD)构成的异三聚体。实验发现,在小鼠的肺癌细胞(LLC)和人的鳞状细胞癌细胞(HNSCC)中,当用PP2A 激活剂提高PP2A活性时,细胞穿越基底膜的能力下降,而用PP2A抑制剂抑制PP2A 活性时,细胞穿越基底膜的能力增强。在人类许多的肿瘤中,PP2A相关亚基的活性显著下调,而抑制PP2A亚基活性则可明显促进肿瘤细胞的迁移和侵袭。与此同时,研究也相继报道了磷酸酶和树脂同源酯酶 (PTEN)[18], Src同源2的蛋白酪氨酸磷酸酶-2[19], 蛋白酪氨酸酯酶α[20]也被报道参与了细胞的迁移,但蛋白磷酸酯酶PP2A参与肿瘤细胞的迁移和侵袭的研究相对较少。抑制PP2A可通过抑制Wnt/β-catenin 信号途径起抑制胰腺癌细胞的生长和迁移,而激活PP2A则可通过调节金属蛋白酶2和9起促进肝癌细胞的迁移和侵袭[21]。
有文献报道EphB3通过PP2A/RACK1/Akt信号途径抑制非小细胞肺癌的迁移[22]。虽然以上大量细胞学水平的研究已经表明,抑制PP2A可促进细胞的迁移和侵袭,但是PP2A对肿瘤细胞迁移和侵袭影响的机制研究并不清楚。本研究将选取过去从未报道的宫颈癌为研究对象,从血清和细胞水平共同探讨PP2A在宫颈癌细胞迁移和侵袭中的作用及其可能机制。
本课题研究结果显示激活PP2A活性可明显抑制宫颈癌细胞侵袭,而抑制PP2A活性则显著促进了肿瘤细胞的侵袭。进一步研究其作用的可能机制意义重大。本课题组前期研究发现宫颈癌病人的血清中PP2A水平明显下调,宫颈癌组织无论是mRNA还是蛋白质水平均显著下调,这提示PP2A水平下调可能参与宫颈癌细胞的侵袭。进一步在宫颈癌细胞水平,我们通过药物和基因手段分别调节PP2A活性,采用小室穿孔实验发现激活PP2A可明显抑制宫颈癌细胞的侵袭,而抑制其活性后则明显促进细胞侵袭。该研究结果表明PP2A在宫颈癌的侵袭过程中发挥重要作用。该研究结果提示PP2A可能是一个良好的抗肿瘤因子。
MAPK家族在不同细胞的迁移中发挥重要的作用,如ERK1/2促进成纤维细胞、癌症细胞、大鼠胶质细胞的迁移。在人的星形胶质细胞中,抑制ERK1/2的磷酸化可延缓细胞的迁移。激活p38MAPK也可促进很多细胞如平滑肌细胞[23]、主动脉内皮细胞[24]、角膜上皮细胞[25]等的迁移。在肿瘤侵袭和转移过程中,细胞外基质的降解是肿瘤侵蚀正常组织和开始转移的重要途径。细胞外基质的降解主要依靠蛋白水解酶,这些蛋白水解酶主要分为4类,其中基质金属蛋白酶(Matrix Metalloproteinases, MMPs)是其中较为重要的一类。MMP-9是MMPs家族中的重要一员。大量研究表明,MMP-9在多种恶性肿瘤中呈过度表达,降解破坏细胞外基质中最主要的组份IV型、V型胶原和明胶。本课题的研究结果发现PP2A可同时通过去磷酸化p-JNK, p-p38和p-ERKMAPK和下调金属蛋白酶MMP-9起抑制宫颈癌肿瘤细胞的作用,这与以上的相关研究报道观点一致。
综上,本研究表明PP2A可能为宫颈癌的良好抗肿瘤因子。抑制PP2A可显著抑制宫颈癌细胞的侵袭,从而延缓宫颈癌的发展。该研究将为宫颈癌的发生发展提供新的分子机制,同时也为临床宫颈癌的个体化医疗提供新的药物靶点。
