听神经病患者噪声下言语测听临床应用与分析
2019-03-04兰兰李清溪谢林怡熊芬韩冰王秋菊
兰兰 李清溪,2 谢林怡 熊芬韩冰 王秋菊*
1解放军总医院耳鼻咽喉头颈外科解放军耳鼻咽喉研究所(北京100853)2南方医科大学深圳医院耳鼻咽喉科听力中心(深圳518100)
听神经病/听神经失同步化(auditory neuropa⁃thy/auditory desynchronization,AN/AD),又称听神经谱系障碍(auditory neuropathy spectrum disorder,ANSD),是一种耳声发射和耳蜗微音电位正常而听性脑干诱发电位缺失或严重异常的听功能障碍[1]。其中,听神经病患者最显著的临床特征之一是纯音听阈与言语识别程度不相符,即患者所描述的言语感知困难,往往大于其听力损失的程度,且在嘈杂环境中此问题更为严重。本研究重点关注具有言语能力的AN患者,目的是评估AN患者在噪声下言语测听中言语识别能力,以期辅助AN及其相关疾病的诊断和评估,并为噪声下言语测听广泛应用于临床提供参考依据。
1 资料与方法
1.1 研究对象
1.1.1 AN组:10例在门诊确诊为听神经病患者,平均年龄24岁,男8例,女2例。临床特征详细信息请见表1,其中低频上升型听力13耳,平坦型1耳,山型和谷型6耳。本实验AN纳入标准[2-4]:①听力损失程度为轻度至重度感音神经性聋,多数以低频听力下降为主;②言语识别分数(Speech Recogni⁃tion Scores,SRS)与纯音听力不成比例下降,特别是在噪声环境中语言理解困难;③镫骨肌声反射不能引出或反射阈升高;④听性脑干反应(Auditory Brain Response,ABR)不能引出或者重度异常;⑤耳声发射(Otoacoustic Emissions,OAE)或耳蜗微音电位(Cochlear Microphonics,CM)正常或轻度改变;⑥影像学检查CT扫描或MRI未见异常。
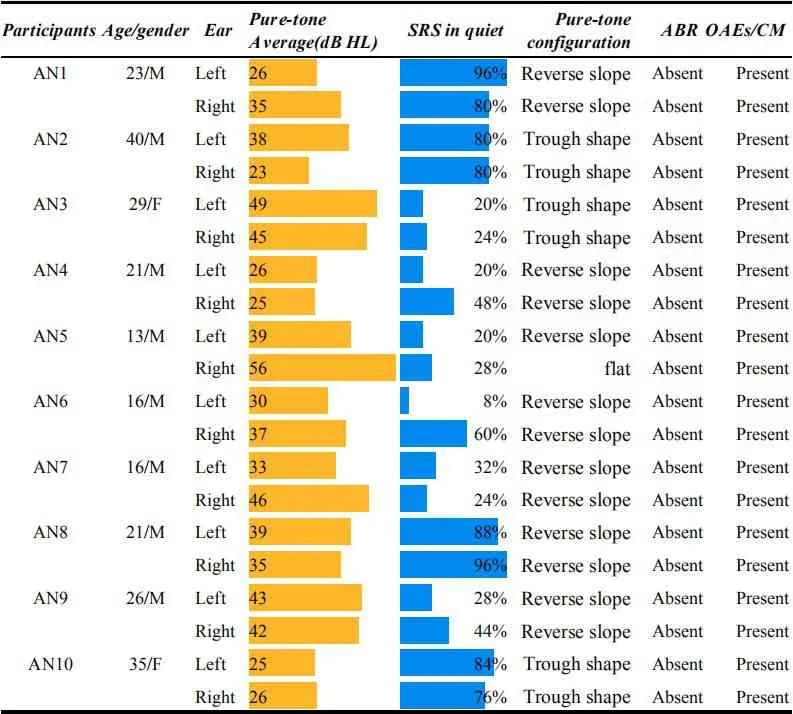
表1 AN患者听力学检查结果Table 1 The audiological test findings in individuals withAN
1.1.2 感音神经性听力损失(sensorineural hearing loss,SNHL)组:11例在门诊诊断为单侧或双侧感音神经性聋患者,男9例,女2例,共16耳,平均年龄47岁(年龄范围36~58岁)。受试者排除蜗后病变和占位性病变。
1.1.3 听神经瘤组:11例听神经瘤(单侧)患者,男3例,女8例,共11耳,平均年龄53岁(年龄范围32~68岁)。临床诊断主要为单侧耳鸣、听力下降、面部麻木,部分伴有眩晕、走路不稳等。所有患者均以增强头颅MRI进行确诊[5,6]。
1.1.4 听力正常组(normal hearing,NH):NH组10例,男1例,女9例。平均年龄(年龄范围20~22岁)。所有受试者均完成纯音测听、声导抗、言语测听检测,无耳科或神经科相关疾病,双耳0.125~8kHz各频率阈值均小于25dBHL。
1.2 测试材料与方法
测试在符合国家标准的隔声室内进行,纯音测试及言语测试应用校准后丹麦耳听美Conera听力计Otosuite(版本号4.82)联结计算机输出言语声,受试者佩戴头戴式耳机TDH-39、B71骨导振动器。言语识别测试材料采用由解放军总医院郗昕编制的《普通话言语测听—单音节识别测试》[7]词表,随机选择16张词表,每张25个字计算言语识别得分百分比(Speech Rcognition Scores,SRS)。测试词表内置在计算机Otosuite软件中,双通道提供同侧言语噪声,根据WHO 1997年听力损失分级法,采用500Hz、1kHz、2kHz、4kHz四个语频计算平均听 阈 (PourToneAverage,PTA),根 据 GB/T 17696-1999言语测试国家标准[8]测试,对侧掩蔽依据GB/T 7341.2-1998D第13章。言语测听包括两个部分:安静环境下言语测试,言语测试声输出强度选择PTA水平、PTA上10dB、20dB、30dB;噪声环境下言语测试强度为PTA上30dB,信噪比(Sig⁃nal-to-Noise Ratio,SNR)分别为−0、−5、−10、−15 dB SNR四个强度。测试前对受试者讲解规则,并鼓励患者对未听清的内容进行猜测予以反馈。
1.3 统计学方法
使用SPSS20.0软件进行数据统计学分析。采用单因素方差分析各组平均听阈及各频率之间的差异,非正态分布或方差不齐时采用非参数检验;判断言语识别率是否受组别和SNR的影响;采用配对T检验分析安静环境下与各SNR的言语识别率之间的差异性;四组数据符合正态分布,采用T检验及Pearson相关系数分析各组言语识别率与纯音听阈的相关性。
2 结果
2.1 四组受试者各频率纯音听阈与平均听阈情况
各受试组的听力学特征基本一致,AN患者听力多表现为低频下降型,听神经瘤及感音神经性耳聋患者多表现为高频下降型。图1A显示了各组受试者各频率的纯音听阈均值图,除外NH组,统计学分析500Hz、1000Hz AN组听力程度略差于SNHL及听神经瘤组,存在统计学差异,(χ2=14.572、15.247,P<0.05);2kHz和 4kHz(χ2=2.954、2.746,P>0.05)无统计学差异,四组平均听阈范围(见图1B),除外NH组,其他三组阈值差异不显著(χ2=6.105,P=0.05)。

图1 受试组纯音听阈均值曲线图与PTA对比图Fig.1 Pure tone hearing threshold for each frequency of the test groups
2.2 四组受试者在不同环境下言语识别能力比较
图2 四组受试者对比结果:将SNR和组别在不同环境下作为单个因素对SRS进行分析,结果显示组别和SNR的不同对SRS的影响存在显著性差异(Z=-7.894/-9.274/-11.588,**P<0.01)。四组受试组在噪声下的SRS趋势均伴随SNR的增加而升高。
图2各组自身对照结果:①NH组在安静环境下言语识别率与SNR为0、5dB的环境中的SRS之间均存在显著性差异(Z=-3.819,**P<0.01),与SNR10、15dB下的言语识别率无显著性差异(P>0.05)。在四种SNR下,NH组的言语识别率仍能波动在84~100%,进一步说明实验所设置的四组SNR对NH组影响程度较小;②SNHL组在安静环境下言语识别率与SNR为0、5、10dB下的SRS之间均存在统计学意义(F=27.377,**P<0.01)。由于入组受试者听力损失程度集中在轻至中度,在安静以及噪声环境中言语识别能力相对较好;③听神经瘤组在安静环境下言语识别率与SNR为0、5、10dB下的言语识别率之间均存在显著性差异(F=7.166,**P<0.01),与SNR15dB下的言语识别率无显著性差异(F=7.166,P>0.05)。④AN组在安静环境下SRS由8~96%程度不等,随着SNR的升高,言语识别率逐渐升高,且波动范围大,在噪声环境中言语识别率波动幅度大于其余三组。AN组在安静环境下言语识别率均好于SNR为0、5、10dB言语识别率,其差异有统计学意义(Z=-3.539;Z=-3.042,**P<0.01),与SNR15dB的SRS无统计学差异(Z=-1.984;=-0.924,P>0.05)。综其上述结果,SNR为10dB时,除外NH组,其他三组对比安静环境SRS均有显著性差异,表现为AN组<听神经瘤组<SNHL组<NH组。
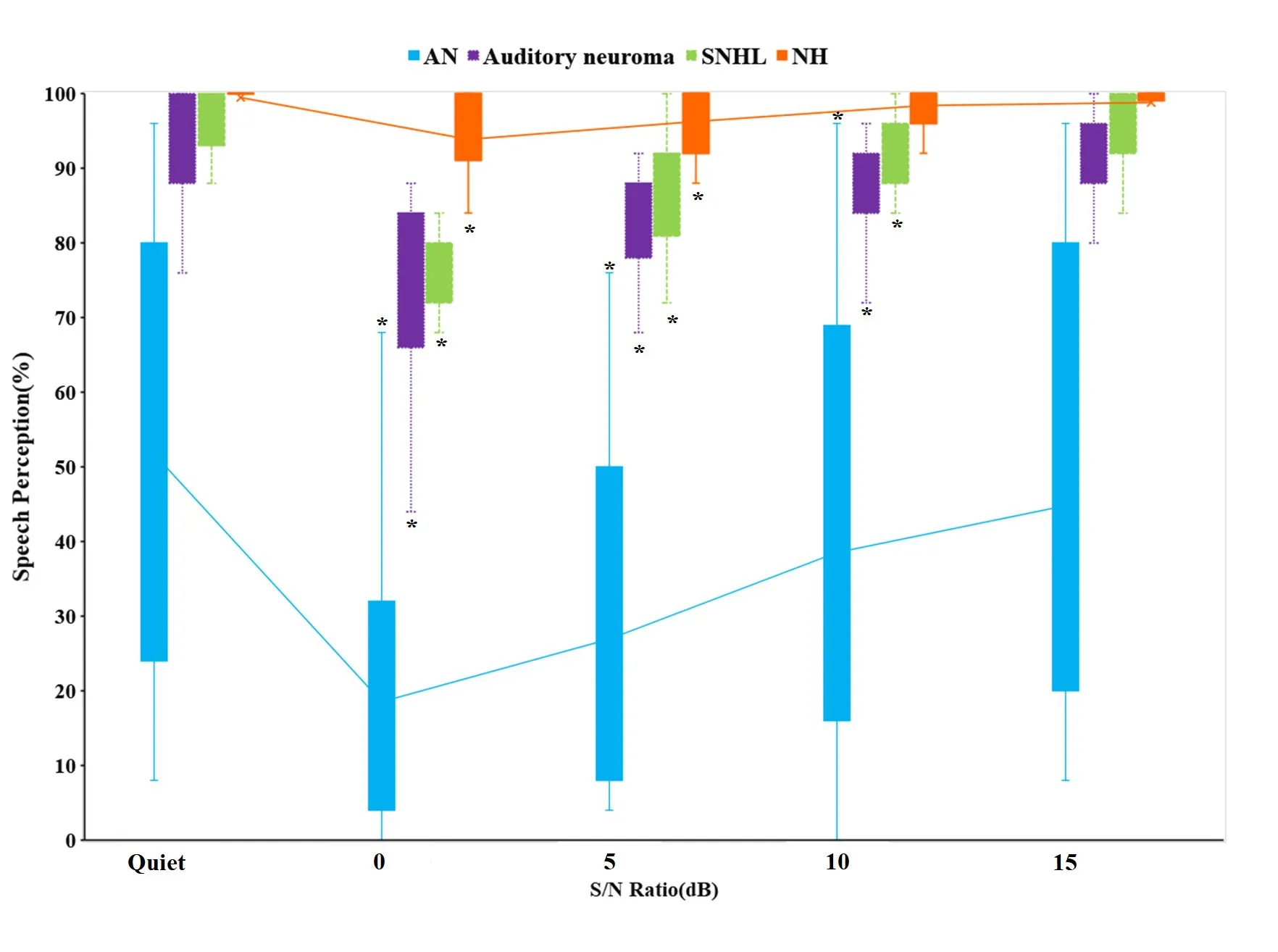
图2 受试组在不同环境中的言语识别能力Fig.2 Speech recognition ability of test groups in different environment
2.3 具有相似平均听阈和听力曲线AN患者的言语识别差异
由于AN患者言语识别率波动范围大,我们又将AN组具有近似SRS的患耳分成二组图3B(共7耳,3耳Control-1组和4耳Control-2),发现这7耳的平均听阈及听力曲线近乎重合,且各频率阈值水平接近。再进一步观察图3A安静与噪声环境下的SRS数据离散,呈现二级分化的状态。

图3 A.听神经病患者不同环境下言语识别率变化情况;B.二组AN患者纯音听阈波动范围Fig.3 A.Changes of speech recognition rate of AN patients in different environment;B.Pure tone threshold fluctuation range of two groups of AN patients
2.4 四组受试者言语识别率与纯音听阈的相关性分析
四组受试组安静环境下的言语识别率与纯音听阈之间的相关性进行分析:结果显示在安静情况(图4)四组受试者数据呈正态分布,T检验结果显示言语识别率与纯音听阈之间P<0.05,言语识别率与纯音听阈之间显著相关,进一步行Pearson相关系数分析:AN组的言语识别率与纯音听阈有无相关性(R2=0.07),听神经瘤组言语识别率与纯音听阈呈负的强相关(R2=0.628),SNHL与纯音听阈呈弱负相关(R2=0.30),正常听力组言语识别率与纯音听阈弱负相关(R2=0.335),且听神经病与纯音听阈的相关性差于其他三组。在噪声环境中(图5),AN组随着SNR的升高,言语识别率也随之升高,且SNR分别为0、5、10、15dB四个强度噪声下SRS与纯音听阈均无相关性,但AN组受试者具有个体间差异大的特点。

图4 受试组在安静环境下言语识别率与纯音听阈的相关性Fig.4 The correlation between speech recognition rate and pure tone threshold of test groups in quiet environment
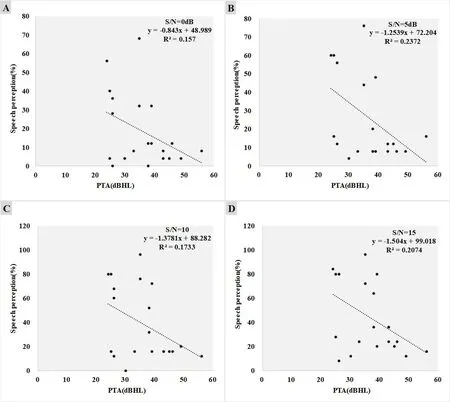
图5 听神经病在不同环境下言语识别率与纯音听阈相关性Fig.5 The correlation between speech recognition rate and pure tone threshold under different environment
2.5 AN组安静环境不同强度下SRS情况
AN患者在安静环境下,AN患者SRS随着刺激声强度的升高,言语识别率随之升高。图6言语P-I曲线显示AN患者在PTA水平与PTA上10、20、30dB四个言语声强度下SRS的集中趋势与离散趋势,应用Kruskal-Wallis检验,所得到的SRS组间无显著差异(χ2=2.864,P>0.05),伴随刺激声增高,由中位数可见PTA+10>PTA+20>PTA+30>PTA四组数据的中位数出现“回跌”现象。

图6 AN组安静环境下言语识别率P-I曲线Fig.6 The P-I curve of speech recognition rate in quiet environment
2.6 以安静环境50%SRS分界对比AN患者不同SNR下变化趋势
由于AN患者不同个体间SRS变化程度较大,我们以安静环境PTA+30dB为言语测试强度,以安静环境下SRS 50%分界,用-0、-5、-10、-15dBSNR进行分组比较,由于各组数据非正态分布,利用秩和检验对各组SRS分析,统计结果显示(Z=-2.92;-3.24;-3.84;-3.74,P<0.01),各组间有显著性差异。由(图7)四分位数间距图可以观察到AN患者在噪声环境下SRS的离散趋势,>50%SRS组数据离散程度明显比<50%SRS组大,在信噪比为0的数据中>50%SRS组,言语识别波动范围可从0-70%,其他各组与其类似,最大与最小值明显比<50%SRS的间距动态范围更宽)。
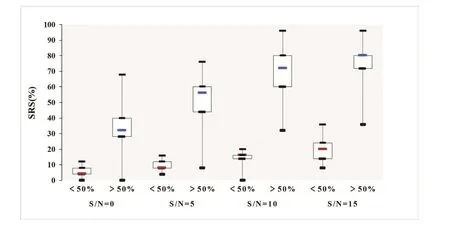
图7 二组AN患者在不同信噪比中言语识别率的变化趋势Fig.7 Trend of SRS in Two Groups of AN Patients with Different SNR
3 讨论
言语专家认为[9]受试者的言语识别能力是评价其听功能的金标准,人类听觉最重要的意义是接收和理解言语,如果只能选择一种测试来评价听觉功能,那就一定是言语测听[10]。但临床中噪声下言语测听并未成为如纯音测听一样的常规检查,此项目多应用于佩戴助听器和人工耳蜗术后效果的评估。由于AN患者在噪声环境下理解言语更为困难,故噪声下言语测试能更全面评估AN患者的言语交流能力。既往研究[11]发现AN患者听力阈值的确与言语识别能力关系不密切,因此我们的干预决策[12]应更多地关注患者在各种环境下的沟通能力。
3.1 言语识别与听力损失的关系
既往研究发现,AN患者在群体水平上最大言语识别率与阈值有一定相关性,即听力阈值越大,言语识别率百分比数值越小,且当听神经病患者听力损失在同一水平时,其最大言语识别率程度与听力曲线类型相关[11]。本研究所用对照组包括NH、听神经瘤和SNHL三组,除外AN组,听神经瘤组和SNHL组均以平坦或高频下降为主,AN组主要为低频上升型曲线,曲线不同可对言语结果产生偏差,故本文对四组的言语频率进行差异性分析,图1A可观察到不同组别的听力曲线类型及听力损失程度,由图1B可以观察到除外NH组其他三组平均听阈差异不显著(P=0.05)。本文SNHL组和听神经瘤组部分患者为单侧听力损失,我们在测试过程中进行规范掩蔽[13,14],避免数据偏倚及健侧的影响。我们研究发现AN患者在安静和噪声环境下言语识别率具有明显差异性,部分AN患者在安静环境下言语识别能力较好,甚至与NH组言语识别水平相同,但当进入噪声环境中,部分安静环境中言语识别能力较好的AN患者SRS大幅下降,由图7我们可以看到>50%组离散程度极大,而安静环境中言语识别能力较差的AN患者,言语识别率下降幅度小,与前期研究结果一致[15]。由于言语测听的过程包括刺激、反应和计量三个内容,听觉中枢通路耳蜗核、下丘、内侧膝状体及听皮质任何环节部位病变,都会影响患者对言语声的理解,我们透过听力曲线图(图3A-B)也可了解到具有相似听力曲线及听阈水平的AN患者,其言语识别能力相差较远,个体差异极大,且噪声下的言语识别率与听力损失没有相关性(图5),我们很难如SNHL患者可以透过纯音听阈与SRS进行相互推算,无规律可循反而是AN患者的疾病特点。
3.2 言语识别下降与时域处理障碍
AN患者在噪声环境下言语识别能力较差,如图2所示,NH组波动范围小,AN与其他三组比较,SRS较差且波动大,听神经瘤次之。由于AN在时间分辨测量和噪声中语音感知之间存在显著相关性,根据之前国内外研究表明[16,17],噪声下言语识别与时域精细结构处理能力有关,提出了精细结构感知障碍可能是AN患者噪声下言语识别较差的原因。时域问题会对语言理解产生一定的影响,但并不一定会完全影响言语识别率的变化,也可能由于频域或相位的问题[18]。Hemanth等[19]发现安静和噪声环境下深带调制短语识别在SNHL组中显著优于AN组。SNHL主要病变部位大多始于耳蜗外毛细胞,而AN患者可能合并内毛细胞或与内毛细胞所连接的多个纤维发生病变,从而导致AN患者对言语的各个方面处理和提取能力下降;而听神经瘤患者言语识别能力下降受多方面因素影响,主要为肿瘤局部机械压迫听神经纤维,引起听神经变性、听觉电活动传导阻滞、内耳化学成分改变形成损伤,最终导致听神经同步化障碍[20],虽然病因明显与AN不同,但听神经瘤患者会表现出类似听神经病的临床特点,在本研究中平均听阈(图1B)相仿的情况下,听神经瘤组噪声下言语略优于AN患者。由图2紫色四分位数间距图可观察到,听神经瘤患者自身安静与噪声下SRS也有显著差异,这也是将其纳入对照组的原因。由于AN在时间分辨的测量和噪声中语音感知之间存在显着的相关性,有效处理语音信号的包络和精细结构线索的能力受损,可能是AN在噪声中语音感知期间面临极端困难的原因。
另有,AN患者在安静环境中,由图6我们可以看到随着声刺激强度的升高,AN组可能由于数据样本少变异大,安静环境下不同刺激声水平组间虽无显著差异,但言语识别率中位数值会出现“回跌”现象,与既往文献报道的结果相一致[21,22]。这种识别率与强度的非线性关系,证明AN患者强度编码机制基本未受损,耳蜗传导通路仍具有复杂的时间、空间和频率分辨编码的功能。Narne[23]等观察15例AN患者,根据他们在安静中的言语识别分数,将AN患者分为表现优秀和不佳者,发现优秀者噪音中SRS降低较少,信号的包络可显著改善表现优秀者在噪声中的言语识别分数。Liberman[24]通过实验发现由于内毛细胞能够与多个听神经纤维相连接传递信息,这种结构的形成对言语的时间整合和相位等起到重要的作用。通过AN患者在安静和噪声环境下较其他三组差异性显著的结果,也可推测内毛细胞到内毛细胞以上部位出现病变的可能。
再有,Moser[25,26]等人研究发现内毛细胞具有多个功能不同的活动区,能够与不同的听神经纤维相连接,随着活动区的活动,听神经纤维间能够自主频率的变化,说明内毛细胞也具有位置编码的能力。噪声会扭曲时间精细结构并消除包络线索[27],在听力受损时,AN患者无法处理被噪声掩蔽的精细结构时间线索,而正常听力者能够通过提取精细结构线索来跟随语音。Narne研究认为[28]在安静环境中言语识别能力较好的AN患者,能够获得较好的包络信息,但不能获得精细结构线索,有效处理语音信号的包络和精细结构线索的能力下降,也可能是AN在噪声中语音感知面临极端困难的原因之一。
3.3 言语识别下降与听神经、内毛细胞传入神经突触病变
伴随临床听力学的发展和不同AN表型资料的分析积累[3],已经能够区分的病变部位是在内毛细胞还是内毛细胞之后的听觉传导通路病变,Starr[29]根据AN病变的病理基础,提出将AN分为Ⅰ型(突触前型)和Ⅱ型(突触后型)的理论,但是目前却没有很好的方法来确定内毛细胞及其与螺旋神经节神经元之间的突触病变。有研究提示[30],与内毛细胞发生突触联系的I型传人神经纤维可根据自发性放电率(spontaneous rate,SR)的不同进行分类,高S R纤维和低S R纤维。在安静环境下听觉信息的传人主要依赖高SR的听神经纤维;在嘈杂环境下,听觉信息的传人主要依赖低SR听神经纤维。故自发性放电率低的听神经纤维受损也可能是AN患者言语识别下降的原因之一。本文中AN患者在安静与噪声两种环境下SRS与纯音听阈相关性差(图5),且个体差异大,但总体随着平均听阈的升高,言语识别率下降,该结果与文献报道一致[18,31],但仍有部分AN患者与SNHL和NH组相仿,即言语识别能力相对较好,如图3呈现的二极分化的情况。出现该现象推断与AN患者发病部位不同有关,Rance[32,33]认为言语识别能力较好的患者病变部位较低,局限于内毛细胞或是内毛细胞与螺旋神经节突触结合等部位,受损方式与SNHL患者相似,从而出现相同的言语识别率下降特点,而安静环境下言语识别率较差的AN患者,其传入神经通路可能已受到损伤,造成功能缺陷,无法有效的传递信息。
近来耳蜗内毛细胞和I型传入听神经纤维之间突触(ribbon synapse)的损伤备受关注,这种内毛细胞和听神经纤维末梢之间突触的病理改变会导致与之相连的听神经纤维无法兴奋[34],该结构是一些重要遗传性听功能障碍的主要致病因素[35,36],耳蜗内毛细胞传人神经突触病变在声音信号的编码过程中起着十分关键的作用[37,38],人类遗传、生理学及动物模型最新研究表明[39],该结构主要因遗传改变而影响突触囊泡内谷氨酸在突触前膜的释放、Ca2+内流或突触囊泡的泡吐作用导致内毛细胞带状突触功能破坏,进而引起听力损失,被称为“听突触病(auditory synaptopathy)”。耳蜗内毛细胞突触病变可以独立发生和存在,其发育并不依赖于毛细胞和听神经等结构,而且其异常往往导致典型的听神经病特点[40]。任何发生在该结构的病变都会对听功能以及噪声下言语识别能力造成不同程度的影响,包括隐性听力损失、噪声暴露后听力下降以及与年龄相关的听力损失都与之密切相关。
总而言之,听觉感知是一个复杂的过程[41],由于实际聆听环境存在各种噪声,因而噪声环境下的言语识别能力评估能够更真实客观地反映实际聆听效果。AN患者噪声下SRS结果与AN患者主诉“听得见,但听不懂”的现象更加贴合,临床开展噪声下言语识别测试时间大约为10~20分钟,可选择-10dB的SNR进行测试。目前临床常规使用噪声下言语测试进行评估的医院远未普及,但它却是听力学评估项目中的重要组成部分,且对分析AN病理机制及定位病变部位、疾病干预和治疗决策有较好的参考价值和临床意义。本研究将继续加大样本对AN患者言语识别水平进行跟踪随访,进一步从基因学、影像学、代谢等多层面剖析AN个体间差异的本质。
致谢:在此衷心感谢李兴启教授对本文的悉心指导和帮助!
