左耳肿物多次切除术后复发5月余
2019-03-04申卫东任丽丽戴朴杨仕明
申卫东 任丽丽 戴朴 杨仕明
解放军总医院耳鼻咽喉-头颈外科
【简要病史】
患者李女士,75岁,汉族,山东人,以“左侧中耳炎、胆脂瘤多次手术后耳痛、流脓5月余”之主诉入院。
患者自幼左耳反复流脓,滴药后可缓解,不伴明显听力下降、耳痛等。6年前感冒后再次出现左耳流脓,并伴有耳痛、头痛、听力下降,自服“消炎药”后症状缓解。2年前再次出现上述症状,且症状加重,在当地医院按“中耳炎”行“乳突根治术”(2009.5),术后病理报告为“中耳胆脂瘤”,术后左耳痛、头痛消失。术后1月复查发现“外耳道内大量胆脂瘤上皮团块样物”,再次出现左耳痛、头痛,经局部滴药、换药等保守治疗无效,再次在当地医院行“乳突修理术”(2009.11),术后病理报告“慢性炎症伴肉芽组织,胆脂瘤形成”,术后症状暂时缓解,但换药过程中再次出现耳痛、头痛、患耳持续流脓。1年前以“慢性中耳炎伴胆脂瘤”之诊断收治我院,行“颞骨次全切除、迷路切除术(左)”(2010.3.18,第三次手术),术后病理报告“(乳突)慢性炎细胞浸润及多灶异物肉芽肿性炎反应”。术后10余天患者再次出现左耳痛、头痛;术后40余天发现外耳道、耳后沟切口处有肉芽样软组织生长,患者左耳痛、头痛逐渐加重,术后3月余出现声嘶、张口受限,门诊以“颞部、颅底异常角化症术后复发伴感染”之诊断收入院。就诊时患者精神状态、体力较差,伴体重明显下降。专科检查:左耳道口可见粉红色肿物,左耳廓后沟可见前次手术的疤痕。右耳鼓膜紧张部穿孔,鼓室腔未见异常分泌物。音叉检查(C256Hz):WT,偏左侧;RT:L(-),R(+)。左侧角膜反射稍弱;左侧面部触痛明显;双侧颞肌、咀嚼肌无明显萎缩。双侧额纹存在。闭眼时无露白,鼓腮无漏气;左侧软腭下垂,抬举差,咽反射存在,伸舌偏向左侧,左侧舌肌萎缩,声音嘶哑,饮水时有呛咳;左侧转头、耸肩力量稍差。
【初步诊断】
颞部、颅底异常角化症术后复发伴感染
【影像学及其他检查的解读】
本例患者的术前外观像、耳镜、术前病理学及影像学资料如图1-1所示:局部检查和影像学检查可见左侧颞骨的病变范围广泛,病变占据整个患侧颞骨,并侵及外耳道、颞部皮肤、腮腺、枕骨基底。

图1 -1 外观像、内窥镜、病理学及影像学检查。1-1a.外观像显示左侧耳后疤痕、窦道伴局部充血;1-1b.耳镜照片显示左侧外耳道顶后壁粉红色肿物,局部破溃;1-1c.院前病理学检查提示“过度角化”;1-1d.颞骨轴位显示左侧呈颞骨切除术后改变,颞骨区充满软组织影致局部膨隆;1-1e.轴位核磁显示左侧颞部占位,侵及枕骨基底部;1-1f.冠状位强化核磁显示左侧颞部肿物,侵及腮腺、皮下组织、皮肤,不均匀强化。
【诊断与鉴别诊断】
文献报道的颞骨原发性恶性肿瘤病种庞杂,上皮来源的恶性肿瘤包括鳞癌、基底细胞癌、疣状癌和黑素瘤,腺癌包括耵聍腺癌、腺样囊性癌、乳头状囊腺癌、粘液表皮样癌等,而起源于中胚叶的肿瘤包括横纹肌肉瘤、纤维肉瘤、血管肉瘤、骨肉瘤、软骨肉瘤、纤维组织细胞瘤、浆细胞瘤等。本例病人在病史上有如下特点:(1)老年女性,75岁;(2)多年的中耳炎病史;(3)反复颞骨-中耳手术史;(4)多次术后病理报告为“炎症”、“胆脂瘤”;(5)术后不干耳、反复流脓、局部症状加重并出现耳痛、头痛,近期出现多组脑神经受损。
根据术后易复发,病变发展迅速,病理学组成主要为大量不成熟的角化物,本例患者应该与下列疾病相鉴别:
1、颞骨炎性肌纤维母细胞瘤(Inflammatory Myofibroblastic Tumor of the Temporal Bone,IMT):曾被称为炎性假瘤(inflammatory pseudotumor),WHO软组织肿瘤国际组织学分类专家组已经将炎性肌纤维母细胞瘤定义为“由分化的肌纤维母细胞性梭形细胞组成的,常伴大量浆细胞和(或)淋巴细胞的一种肿瘤”,该病是一种特殊的软组织肿瘤,病因未明,在组织学上显示良性特征,但临床上可以表现为侵袭性的病变。IMT少见且病因不明,男女发病均等。该病可以发生于人体的多个部位,但上呼吸道是好发部位,发生在喉、气管、咽及鼻咽部占肺外病变的11%,头颈部其它部位的比例不到5%,涉及颞骨的罕见。该病易于局部复发,但罕见转移。约50%的IMT存在位于2号染色体上的ALK基因的重排。颞骨炎性肌纤维母细胞瘤骨质破坏常见,常常扩展到颅底并出现多个脑神经受损,面神经麻痹多见。这些表现都与本例患者的表现相似,确诊有赖于组织学检查。治疗主要依靠局部切除和激素治疗。
2、外耳道(颞骨)恶性肿瘤(Malignant Neo⁃plasm of External Auditory Canal/Temporal Bone):病理学上多为鳞状细胞癌,有明显的细胞异型性。临床上耳内常有血性分泌物及肉芽,触之易出血,生长较为迅速。
3、中耳胆脂瘤(Cholesteatoma of Middle Ear):胆脂瘤指中耳-乳突腔内鳞状上皮和角化物的堆积。临床上表现为间断流脓和听力下降,延误治疗时可以出现各种严重的并发症。本病曾反复按“胆脂瘤”接受手术,术后病理学检查也符合“胆脂瘤”的诊断,但此次就诊患者症状严重,且伴有脑神经损伤,需要排除是否出现“胆脂瘤型中耳炎”的并发症;另外,鉴于胆脂瘤可以导致颞骨鳞癌(详见讨论),不能排除“恶性变”的可能。
4、坏死性外耳道炎(Malignant otitis externa,MOE)/颅底骨髓炎(Skull Base Osteomyelitis):恶性外耳道炎是颅底和外耳道侵袭性的细菌性感染。病变侵及颅底及邻近的软组织,并且常常引起进行性的肌骨炎。糖尿病是恶性外耳道炎的最主要的危险因素,90%的恶性外耳道炎的病人都是糖尿病。高龄也是恶性外耳道炎的危险因素,恶性外耳道炎病人的平均年龄为67岁。儿童患病者罕见。非糖尿病病人也可以得恶性外耳道炎,通常有免疫受损。面神经麻痹:1/3的老年患者会有面瘫,通常发生在起病2月后。其它脑神经病变通常出现在面瘫之后,并且是预后不良的征兆。IX、X、XI、XII比V、VI脑神经更容易受侵犯。外耳道通常充血、肿胀,并且总是伴有流脓。可以有耳周触痛和牵拉耳廓时出现耳痛。触痛通常出现在颞下窝外侧。患侧出现明显的耳聋症状。革兰氏染色阴性的需氧绿脓杆菌几乎是引起所有病例的原因。
在有效抗生素如喹诺酮类出现后,单独使用抗生素可以治愈大部分恶性外耳道炎病例,但至少需要6周的抗生素治疗。目前手术的作用仅限在局部浅表的清创术,扩大的手术清创不再推荐,而且有些作者认为颞骨手术是恶性外耳道炎的禁忌症,因为手术本身为感染扩散打开了新的通路。
本例有中耳手术的病史,之后出现持续耳漏、严重的耳痛伴脑神经损害,且为老年人,外耳道可见肉芽组织,与坏死性外耳道炎的临床特征相似,但诊断“坏死性外耳道炎”需要排除外耳道/颞骨恶性肿瘤。
【治疗】(手术)
根据病情发展和影像学检查,为明确诊断、清除病变,再次行颞骨次全切除、颞骨颅底巨大肿物切除、乙状窦结扎术(左,2010-9-2,第四次手术),术中见(图1-2):肿物呈囊性,包囊内充满大量的白色豆腐渣样物质,肿物向前侵犯咽鼓管、颈内动脉管周围骨质,向下侵犯鼓室、外耳道底部和颅底的肌肉以及腮腺组织,向后侵犯后颅窝脑膜,向内侵犯颈静脉球内侧、内听道以及枕骨大孔外侧。包囊较韧,与周围组织界限清楚,易于剥离。肿瘤切除后内听道开放,并出现脑脊液漏。颞肌填塞内听道底,人工皮覆盖术腔。术后无脑脊液漏、感染等严重并发症,伤口如期愈合,耳痛、头痛消失。
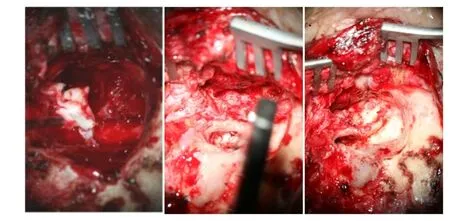
图1 -2本次手术术中所见。a-c:术腔内可见大量豆渣样胆脂瘤,侵及咽鼓管、颈内动脉管、颅底、腮腺组织、后颅窝脑膜、颈静脉球内侧、内听道以及枕骨大孔外侧(详见手术过程描述)
术中冰冻病理提示:大量的角化过度和角化不全。
术后补充病理报告:(左侧中耳、乳突、颈静脉孔区)鳞状上皮呈乳头状增生伴角化过度、角化不全及角化不良,部分区域基底层细胞增生活跃,核分裂相易见,上皮下纤维组织增生伴慢性炎细胞浸润及异物肉芽肿性炎症反应,结合病史疾病发展过程,考虑高分化鳞状细胞癌。
【最后诊断】
颞骨高分化鳞癌(左,继发于胆脂瘤,T4N0M0)(Pittsburgh 2000 Staging System)
【预后和随访】
患者术后9天出院。术后3周开始门诊换药。术后2月干耳后在当地(山东临沂)开始接受放疗。
放疗过程中出现耳部破溃、渗液、张口受限、进食困难,后终止放疗;患者术后半年死于进食困难、营养不良和恶病质(2014.7.19日最后一次电话随访)。
【该病例的诊疗上的经验、教训与启示】
反复的炎症和中耳胆脂瘤可以引起颞骨鳞癌(详见文献总结),本例患者的病理标本上可以同时见到慢性炎细胞浸润、上皮角化不全、角化过度、角化不良、基底层细胞增生活跃、核分裂相易见等不同的病理学征象,可以看出病变从慢性炎症、癌前病变到异常增生的系列病理学改变和渐进发展的过程,提示慢性炎症、胆脂瘤在本例患者癌变中的作用。
当长期患有慢性中耳炎病人出现持续的耳漏尤其是血性分泌物、耳痛,或者脑神经受伤的表现时,应该想到恶性变的可能。此时,通过活检或术中快速病理学检查明确诊断,避免反复不彻底的手术切除。
根据本例及其它病例的经验,活检时取材部位应该避开炎症、坏死区域,而在病变的深部、肿瘤与正常组织交界处取材,才有可能得到阳性的结果。
【相关知识及文献总结】
中耳恶性肿瘤少见,占到头颈恶性肿瘤的比例不到0.2%[1],其发病率大约是5-6/1,000,000,其诊断、治疗及普遍接受的临床分期尚未建立。颞骨最常见的原发性恶性肿瘤是鳞状细胞癌(Squamous Cell Carcinoma,SCC),因此大部分处理和治疗颞骨恶性肿瘤的经验都是基于外耳道鳞癌或中耳癌。由于颞骨解剖的复杂性使肿瘤的扩散难以预测,加之特异性的临床表现出现较晚和诊断的延误,加剧了颞骨恶性肿瘤外科处理的难度[2]。
颞骨鳞癌的起源不明,可能的病因包括射线暴露、慢性中耳炎、胆脂瘤及颞骨的慢性肌骨炎等[3]。有报道提示慢性中耳炎是引起颞骨鳞癌的原因,但也有文献不支持这种联系[4]。
继发于胆脂瘤的鳞癌(Cholesteatoma triggering squamous cell carcinoma)鲜有报道(Rothschild,2009)[5],导致颞骨鳞癌的分子机制包括细胞增殖率的提高和c-myc、血管形成、肿瘤坏死因子及基质金属蛋白等的激活。Watabe-Rudolph等通过比较鳞癌和胆脂瘤组织中的端粒酶活性和端粒的长度的差异,提出了端粒酶活性与细胞凋亡可能与胆脂瘤向颞骨鳞癌的转化有关。与鳞癌组织相比,胆脂瘤组织的端粒酶活性(telomerase activation)的缺乏与显著增高的细胞凋亡比例(high rates of apopto⁃sis)相伴随,据此推测胆脂瘤组织中端粒酶的缺乏通过诱导凋亡限制了胆脂瘤的生长;反之,端粒酶活性的缺乏允许鳞状细胞癌中肿瘤细胞的无限增殖和发展[6]。
颞骨鳞癌好发于老年人,高发年龄在50-69岁。颞骨恶性肿瘤最常见的临床表现包括长期的耳漏和听力减退,随着病情的发展,会出现耳痛和耳部出血。因为症状缺乏特异性,常常被当作中耳炎治疗而未引起重视。当正规治疗后血性分泌物还持续存在,就应该高度怀疑恶性肿瘤的可能。脑神经受累(尤其是面神经)和张口受限是肿瘤进展的结果,鼓岬或面神经受侵犯是预后不良的标志。局部浸润是颞骨鳞癌的主要转移方式,Moody报道的32例患者中,有2.5%发生局部转移,未发现远处转移[7];而Testa报道的44例患者中局部转移的比例为22.7%,远处转移的比例为2.3%[8]。
目前唯一被接受的颞骨恶性肿瘤的TNM分期是由匹兹堡大学的Arriaga及其同事提出的(表1),但是该系统是基于外耳道恶性肿瘤,而非原发于中耳的肿瘤[9]。
考虑到临床上很难估计肿瘤的真实范围和切除多大才算彻底,颞骨恶性肿瘤的手术处理仍然存在争议。单独的放疗大多数情况下无效,尤其是对长期生存。但研究显示术后放疗能够提高生存率。如果术后准备进行放疗,术中要填塞乳突腔、封闭外耳道,以避免放疗引起放射性的骨坏死。目前公认的观点是如果患者能够耐受手术,就应该先进行手术治疗。
文献报道早期肿瘤的长期生存率可以达到80~100%。经过手术和放疗,晚期患者的3年生存率在50~80%之间。病变广泛者,预后很差,即使经过积极的治疗,2年的生存率只有0%-40%。切缘阳性、淋巴结受侵和发生远处转移都是预后不良的标志。局部复发和远处转移是治疗失败的表现,发生这种情况时患者的生存率很低,大部分患者死于2年内。
【问 题】(单选或多选题)
1、最常见的外耳道恶性肿瘤是( )
A.鳞癌;
B.耵聍腺癌;
C.腺样囊性癌;
D.粘液表皮样癌;
E.横纹肌肉瘤。
2、颞骨鳞癌的可能病因是:( )
A.射线暴露;
B.慢性中耳炎;
C.胆脂瘤;
D.颞骨的慢性肌骨炎。
3、颞骨鳞癌公认的治疗方法是什么:( )
A.术前放疗+手术切除;
B.放疗;
C.化疗;
D.手术+术后放疗。
4、颞骨鳞癌的前哨淋巴结是:( )
A.耳后淋巴结;
B.颈深上淋巴结;

表1 -1.恶性外耳道肿瘤的匹兹堡大学分期体系(Pittsburgh 2000 Staging System)
C.腮腺淋巴结;
D.咽后淋巴结。
5、外耳道鳞癌常见的症状包括:( )
A.耳痛;
B.耳漏;
C.听力减退;
D.CN V,IX,I,XI脑神经受累;
E.眩晕。
6、外耳道鳞癌侵犯腮腺的途径有哪些?( )
A.Santorini裂;
B.Huschke孔;
C.面神经;
D.茎乳孔。
7、有关颞骨肿瘤取材部位的正确描述是()
A.切除可疑肉芽组织送检;
B.清理坏死组织,在深部取材;
C.反复活检没有阳性发现而临床高度怀疑时应该手术探查;
D.在病变的深部、肿瘤与正常组织交界处取材。
【文献及进一步阅读】
1 Kuhel WI,Hume CR,Selesnick SH.Cancer of the external auditory canal and temporal bone.Otolaryngol Clin North Am 1996;29:827–52.
2 Moffat DA,Wagstaff SA.Squamous cell carcinoma of the temporal bone.Curr Opin Otolaryngol Head Neck Surg 2003;11:107-11.
3 Golding-Wood DG,Quiney RE,Cheesman AD.Carcinoma of the ear:retrospective analysis of 61 patients.J Laryngol Otol 1989;103:653-6.
4 Michaels L,Wells M.Squamous cell carcinoma of the middle ear.Clin OtolaryngolAllied Sci 1980;5:235-48.
5 Rothschild S.et al.Cholesteatoma triggering squamous cell carcinoma:case report and literature review of a rare tumor.American Journal of Otolaryngology–Head and Neck Medicine and Surgery2009;30(4):256–260.
6 Watabe-Rudolph M,Rudolph KL,Averbeck T,et al.Telomerase activity,telomere length,and apoptosis:a comparison between acquired cholesteatoma and squamous cell carcinoma.Otol Neurotol 2002;23:793-8.
7 Moody SA,Hirsch BE,Myers EN.Squamous cell carcinoma of the external auditory canal:an evaluation of a staging system.Am J Otol 2000;21:582–8.
8 Testa JRG,et al.Prognostic factors in carcinoma of the external auditory canal.Arch Otolaryngol Head Neck Surg 1997;123:720-4.
9 Arriaga M,Curtin H,Takahashi H,Hirsch BE,Kamerer DB.Staging proposal for external auditory meatus carcinoma based on preoperative clinical examination and computed tomography findings.Ann Otol Rhinol Laryngol.1990 Sep;99(9 Pt 1):714-21.
