听神经病患者听力转归与病程的相关性研究
2019-03-04冰丹王洪阳谢林怡关静兰兰韩冰王大勇王秋菊
冰丹 王洪阳 谢林怡 关静 兰兰 韩冰王大勇 王秋菊*
1解放军总医院耳鼻咽喉头颈外科解放军耳鼻咽喉研究所(北京100853)
2华中科技大学同济医学院附属同济医院耳鼻咽喉头颈外科(武汉430030)
听神经病(Auditory Neuropathy,AN)是一种特殊的听觉信息传导、处理障碍性疾病,患者主要表现为听到声音却无法完全理解或分辨声音的含义,这是因为声音信息虽然可以通过外中耳正常传递至内耳(听得到),但听觉上行传导通路中的内耳毛细胞、神经突触、听神经纤维、螺旋神经元甚或更高级听觉中枢功能异常,导致时域信息失同步化,不能被中枢正确感知理解(听不清、听不懂)。从新生儿到成年期均可发病[1-4],以婴幼儿和青少年受累更为常见。
AN的诊断一方面基于患者“听得见而听不懂”的主诉,但更重要的是听力学证据,包括听性脑干反应诱发电位(Auditory Brainstem Response,ABR)、耳声发射(Otoacoustic Emission,OAE)、耳蜗微音电位(Cochlear Microphonics,CM)、纯音听阈、声导抗和安静或噪声环境下的语音感知等。如能可靠地测得纯音听力图,典型AN患者常表现为低频下降型曲线。但实际上,各种类型听力图、各种程度听力损失,都可能出现。随着病程的延长,听阈是否长期稳定还是出现改善抑或恶化?这方面的报道较少,结果也存在较大差异[5]。本研究旨在阐明AN患者纯音听阈随病程变化的关联性,以帮助临床AN患者预后的咨询与评估。
1 研究对象与方法
1.1 研究对象
本研究对1995年7月至2017年12月之间连续就诊于解放军总医院耳鼻咽喉头颈外科的听神经病患者进行回顾性分析。听神经病患者的纳入标准如下:1)OAE和/或耳蜗微音电位(CM)正常或轻度改变;2)ABR未引出或严重异常。如患者有如下情况将予以排除:1)缺乏纯音听阈检测结果;2)影像学检查颞骨CT扫描或颅脑MRI显示中、内耳结构畸形或桥小脑角占位性病变;3)温度敏感型AN。
1.2 听力图分型及听力严重程度分级
在隔声屏蔽室内采用GB/T 16296-1996方法进行纯音听阈检测。测听仪器为美国GSI-61(Version 2.80),头戴式耳机型号为TDH-39,骨导震动器B71。
听力图分为五种类型:上升型(250-500Hz平均听阈较4-8kHz高20dB),下降型(4-8kHz平均听阈较250-500Hz高20dB),平坦型(全频范围听阈相近,平均听阈不超过80dB HL),全聋型(全频范围听阈相近,平均听阈超过80dB HL)和不规则类型(不符合上述四种类型的其他听力图)。听力损失程度分为:轻度(25-40dB HL)、中度(41-60dB HL)、重度(61-80dB HL)和极重度(81dB HL及以上)。
1.3 随访
对每一位听神经病患者均进行建档随访,包括定期电话随访(一年一次)和不定期门诊复诊随访[6]。根据初次检测和末次随访获取的听力学结果,分为恶化型(一耳至少三个频率听力下降>10dB)、改善型(一耳至少三个频率听力上升>10dB)和保持型(一耳听力波动>10dB的频率≤2个)。恶化型者又根据随访期内是否有听力改善阶段分为波动恶化型和典型恶化型。
1.4 统计分析
纯音听阈与发病年龄及病程的相关性由线性回归模型评估并进行曲线拟合。所有P值均为双尾,当P<0.05时表明有显著统计学意义。所有统计分析均使用易侕软件(www.empowerstats.com,X&Ysolutions,inc.Boston MA)与R软件(http://www.R-project.org)进行。
2 结果
本研究中共有389名AN患者符合纳排标准,性别差异不显著,男性占50.9%(198/389)。起病年龄0-40岁,平均年龄12.6±7.3岁,从图1可看出起病年龄有两个高峰,一为3岁以内,一为青春期前后。92.5%(360/389)为双侧AN,29例单侧AN中有15例对侧听力正常,其余14例为对侧感音神经性听力损失。共有749耳纳入统计分析。初次测得的听力图包含各种类型,以上升型最多,占50.6%(379/749),其次为不规则型(占24.3%,182/749)和全聋型(占10.9%,82/749),平坦型占8.8%(66/749),下降型仅为4.8%(36/749),尚有0.5%(4耳)为正常听力。轻度及以下听力损失占39.3%(294耳),中度听损占32.7%(245耳),重度听损占13.9%(104耳),极重度占14.2%(106耳)。
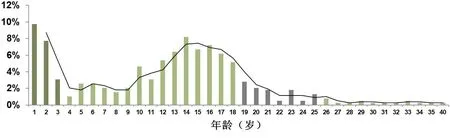
图1 听神经病患者年龄分布Fig.1 Age distribution of auditory neuropathy patients
有随访的纯音听阈结果者,共有94例,随访期从2月-20年不等,随访期小于1年者6例,1-2年者14例。恶化型者平均随访期6.3±4.8年,占56.0%(51/94),保持型者平均随访期4.1±4.4年,占23.1%(23/94),改善型者平均随访期5.5±4.6年,占20.9%(20/94)。如仅纳入随访两年以上的AN患者,恶化型者比例上升至60.8%(45/74),保持型和改善型比例分别下降至21.6%(16/74)和17.6%(13/74),呈现出随着随访时间延长,听力恶化比例增高的趋势。图2、3、4、5分别呈现的是典型恶化型、波动恶化型、改善型和保持型患者的随访听力图变化情况。

图2 典型恶化型AN患者随访期间听力图变化Fig.2 The audiogram changes during follow-up in typical deteriorating type ofAN patients
图2 显示的是编号为AN86患者随访12年过程中的听力逐渐恶化的表现。双耳初次检测时双耳听阈基本对称,为平坦型听力损失,低频处损失较高频区略严重。2年后高频听力回升,中低频保持原状,成为典型上升型听力曲线;随访到第10年时,各频率听力均有所下降,左侧变化幅度相对明显;时隔一年之后,右耳全频听力剧降成全聋型,左耳与前一年持平;至最近一次随访(第12年),双耳均未再有进一步变化。灰色柱表示初次检测与末次随访之间的听阈改变呈恶化状态。
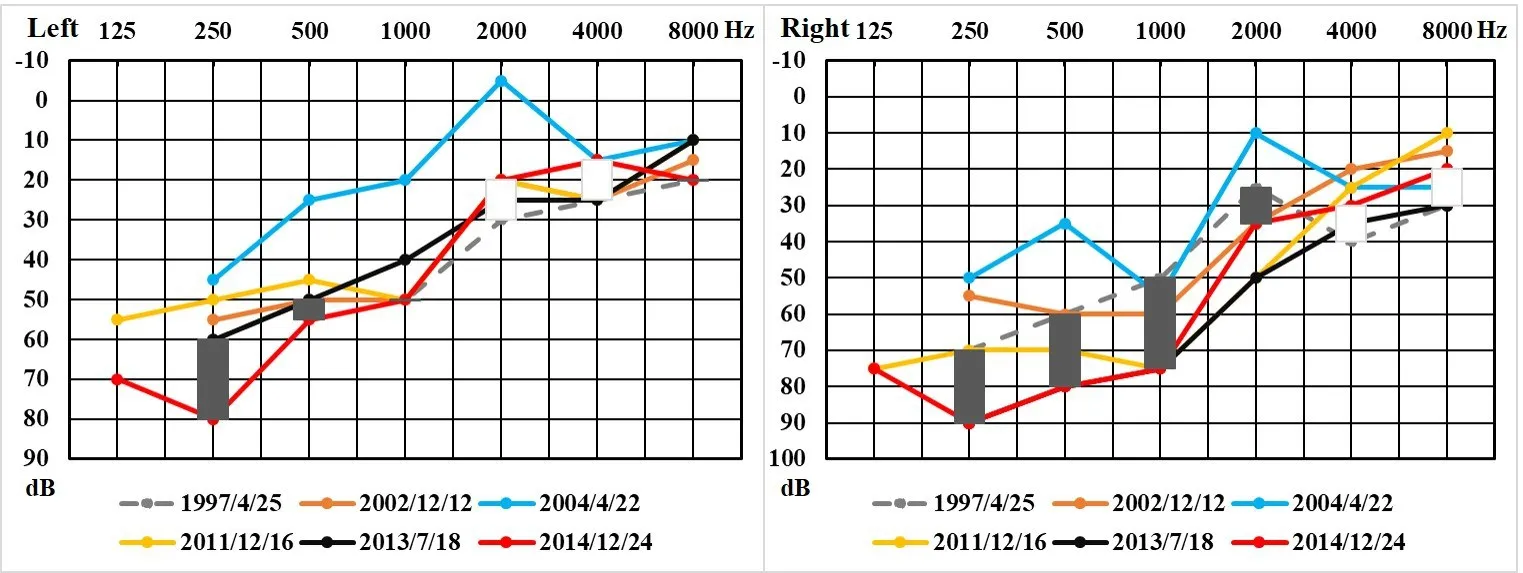
图3 波动恶化型AN患者随访期间听力图变化。Fig.3 The audiogram changes during follow-up in fluctuating deterioration type ofAN patients
图3 显示的是编号为AN24患者随访17年的听力波动性下降的情况。随访5年时,患者双耳听阈几乎保持不变;随访第七年时,双耳听阈改善,左耳尤甚。但至随访第14-16年时,听阈回落;最近一次随访(第17年)时,低频听力进一步恶化,高频听力则有所回升。灰色和白色柱显示初次检测与末次随访之间的听阈差距。灰色柱表示恶化,白色柱表示改善。
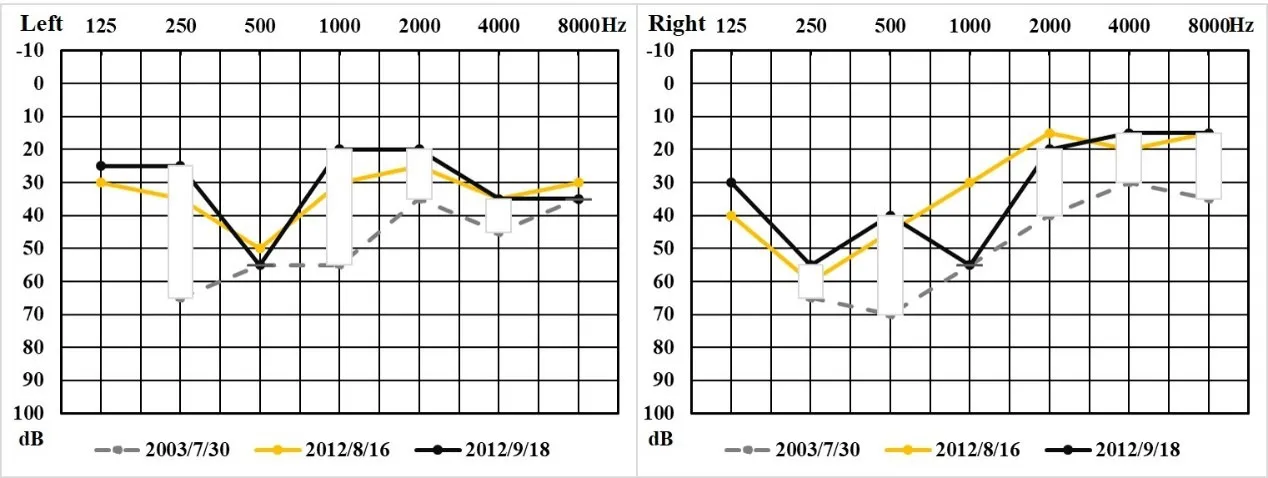
图4 改善型AN患者随访期间听力图变化Fig.4 The audiogram changes during follow-up in improving type ofAN patients
图4 显示的是编号为AN7患者随访9年的听力图变化情况。白色柱表示初次检测与末次随访之间的听阈改变呈改善状态。
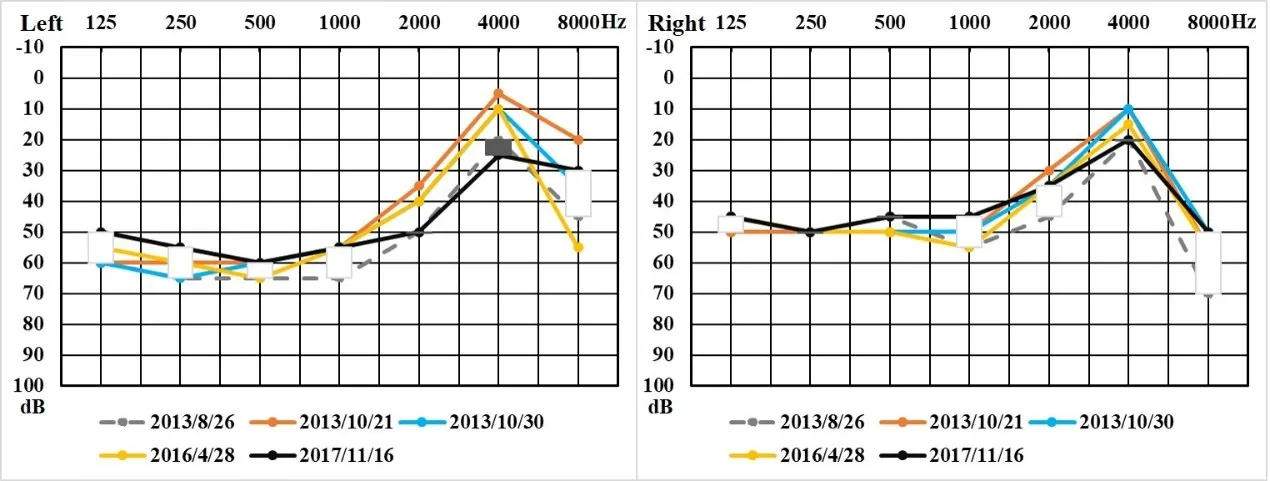
图5 保持型AN患者随访期间听力图变化Fig.5 The audiogram changes during follow-up in remaining type ofAN patients
图5显示的是编号为AN331患者随访4年的听力图变化情况。初次测试时双耳听力基本对称,以低频下降为主。4年间,125-4000Hz听阈波动幅度为5-15dB,8000Hz处听阈波动幅度为15-20dB左右。

图6 病程与听阈的平滑曲线拟合(实线显示听阈随病程变化的情况,虚线为95%CI范围。)Fig.6 Relationship between time duration and hearing threshold(The solid line shows the hearing threshold gains as a function of average time duration.The dotted lines indicate the 95%CI range.)
图6 描绘的是病程与听阈的曲线拟合图(已调整可能的混杂因素包括性别和年龄),250Hz处听阈与病程呈直线相关,但相关性缺乏统计学意义(P>0.05)。500-4000Hz听阈与AN患者病程的相关性曲线可分为两段,转折点在病程3-4年处,在该病程以内,听阈无明显改变;超过该病程范围,随着病程延长,听阈呈现逐渐恶化的趋势。
3 讨论
听神经病的诊断通常是基于患者满足如下两方面条件:耳声发射(OAE)或耳蜗微音电位(CM)存在而同时听觉脑干反应(ABR)缺失或重度异常。听阈或听力图对诊断AN并无特异性。本研究对具有完整纯音听阈结果的听神经病患者进行回顾性分析后发现,AN患者可表现为任何一种听力图类型和听力损失严重程度,经过随访,不同患者可以呈现不同的听力转归,半数以上的AN患者出现听力恶化,根据曲线拟合的结果,随着病程的延长(超过3-4年后),AN患者听阈表现为逐渐变差的整体趋势。
此前有学者对AN患者听力学结果随时间变化的情况进行过报道。随着时间的推移,患者之间存在相当大的差异,并非表现出一致的变化趋势[7]。AN亚型中有一种称为“暂时性AN”,指代的就是部分婴幼儿患者呈现AN样听力结果,但随着时间推移获得完全改善的情况。Shivashankar等[8]报道了24名AN患者中,病程短于5年者大多数听力损失为轻度,病程超过5年者,中重度到极重度听力损失较多。Sininger和Oba研究了59例AN患者,29%的病例表现出听力波动,14%听力明确恶化[3]。Hood L也报道AN患者呈现出不同的听力转归[9]。Chandan和Prabhu在14名AN患者中发现9名听力下降[5]。这些研究结果与本研究相吻合。但是,听力的变化很可能并不是AN本身造成的[10],因为AN的病灶定位主要是内毛细胞、突触、听神经等部位,这些部位的损伤并不直接决定听阈。听力损失的进展很可能与潜在病因有关,也可能与助听器的使用相关。
听神经病是一大类基于症状表型和听力学证据诊断的疾病的统称。最近人类遗传学和动物模型研究发现,听神经病可能涉及众多病理生理机制,包括内毛细胞(inner hair cell,IHC)、IHC突触的丧失、突触传递受损、螺旋神经节病变及更高级听觉上行传导通路被破坏等。虽然听力损失并不是AN诊断的必要条件,也非病情发生发展的必须前提或必然结果,但导致AN的病变也可以通过影响耳蜗机械电转导机制和/或外毛细胞(outer hair cell,OHCs)的耳蜗放大器功能而引起听力损失[11]。以硫胺素缺乏相关性听神经病为例,当使用缺乏硫胺素的配方奶喂养婴儿,后者中的大多数都表现出听神经病样表型,同时部分未能引出耳声发射,表明OHC功能障碍;而在缺乏高亲和力硫胺素转运蛋白的小鼠研究中已证实硫胺素对内外毛细胞均有重要作用。另一个例子是DFNB59突变导致的听神经病[12]。由DF⁃NB59编码的蛋白质pejvakin存在于内外毛细胞和螺旋神经元中。DFNB59突变[13-16]的AN患者既有听力损失也同时可观察到耳声发射异常,表明DFNB59突变破坏OHC功能;动物研究也显示,毛细胞和螺旋神经元中的pejvakin可以帮助过氧化物酶体的增生以对抗病理性损伤带来的氧化应激,而缺失pevjakin的小鼠不能产生这种应答反应,从而导致Corti器中更严重的氧化损伤,进一步加重听力损失。
即便是最终听力恶化的患者中,也有部分曾经经历过听力改善或者是听力稳定的时期。因而现在是改善型或保持型的患者,随着病程延长,未来仍有很大可能变成恶化型。对于这两种类型的患者在预后咨询方面,应该采取更加审慎的态度。但是在改善型或保持型AN患者中,随访达十年以上者各有3例,最长随访期各为18年和16年,这样长期随访的结果也令人相信这两种类型并非只是恶化型的中间类型而可以独立作为最终转归类型而存在。这些不同的转归类型很可能对应于不同的病因,提示未来对AN患者进行基因学分析的必要性。
本研究是较少的关于AN患者听力转归与病程之间相关性的研究之一,利用迄今最大样本量的随访AN患者听力数据,通过曲线拟合发现在病程超过3-4年之后,听力将随着病程延长逐渐恶化的整体趋势,但是具体到不同的个体,听力转归是有极大差异的。但是本研究也存在一些不足之处:1)未获得基因数据,无法从病因学上进行深层次机制阐述;2)未获得患者是否使用助听器的相关数据,无法排除助听器使用是否对听力转归造成影响。尽管如此,本研究对未来指导临床AN患者听力情况转归的咨询有重要参考意义。
4 结论
本研究发现AN患者可表现为任何一种听力图类型和听力损失严重程度,经过随访,患者的听力转归呈现较大个体差异性,半数以上的AN患者出现听力恶化,随着病程延长,这一比例进一步上升。病程与AN患者听阈并非简单的直线相关性,转折点出现在病程3-4年时,在此之前AN患者听阈维持相对稳定,在此之后则表现为逐渐变差的整体趋势。本研究为临床指导医师应对AN患者听力预后的咨询提供重要理论依据。
