石韦的抗病毒黄酮部位及有效化学成分
2019-01-14战妍妃李媛媛安欣欣周洪雷
战妍妃, 李媛媛, 安欣欣, 周洪雷
(山东中医药大学, 山东 济南 250355)
石韦属(PyrrosiaMirbel)属于蕨类植物水龙骨科,主要药材品种为庐山石韦、有柄石韦和石韦,又名金星草、石皮、石剑等.始载于《神农本草经》,中医认为石韦味甘、苦,性微寒,入肺、膀胱经,有利水通淋、清肺泄热等作用[1],用于治疗慢性气管炎、肺热咳喘、金疮尿痛、肾炎尿血[2-6]等.石韦属全世界约70种,我国遍布极广,主要分布在西北、华北等地,极易采集[7].
近年来,传统的中药材在抗病毒方面受到人们的重视,山东中医药大学科研室也一直致力于这方面的研究,并且从石韦中提取得到了药物的有效成分, 即石韦黄酮,石韦黄酮通过采用标准病毒株或临床分离病毒株进行活性检测[8],探究石韦黄酮的抗病毒效果,并且用HPLC-MS鉴定并分析黄酮部位成分[9].为进一步研究石韦的抗病毒活性提供了依据.
1 材料与方法
1.1 材料
1.1.1 病毒株与细胞株
病毒株:肠道EV-71病毒(human enterovirus71,EV-71)、单纯疱疹I型病毒(herpes simplex virus I,HSV-1)、呼吸道合胞病毒(respiratory syncytial virus,RSV)(引自中国疾病预防控制中心病毒病研究所流感病毒研究室);细胞株:恶性胚胎横纹肌瘤细胞(RD细胞,为EV-71病毒敏感细胞、非洲绿猴肾细胞(vero细胞,为HSV-1、RSV 敏感细胞)(由山东省医学科学院基础医学院研究所微生物室提供).
1.1.2 对照品
咖啡酸对照品(批号:Y17D6C7672)、绿原酸对照品(批号:Y24J7K16726)、槲皮素对照品(批号:C20J6Y1722)、木樨草素对照品(批号:Y01D656815)、山柰酚对照品(批号:C26J8Y38642)、山柰素对照品(批号S24N7D25625)、杧果苷对照品(批号Y26M8H36926)均购于上海源叶科技有限公司,阿魏酸对照品(批号:588),购于上海诗丹德有限公司、芦丁对照品(批号:MUST-14102301),购于成都曼斯特生物技术有限公司.
1.1.3 器材
CO2恒温培养箱(日本三洋公司产品),生物安全柜(济南鑫贝西公司产品),离心机(贺立氏台式低温离心机),酶标仪(Thermo公司产品),MC酒精计(0%~100%),UltiMate3000超高相液相色谱仪(美国,Thermo Scientific),四级杆——静电场轨道阱超高分辨质谱仪、Thermo Scientific Heraeus Biofuge Primo R高速离心机(QExactive TMhybrid quadrupole-Orbitrap mass spectromete,美国,Thermo Scientific),KQ5200DB超声波清洗仪、HH-4恒温水浴锅(常州博远实验分析仪器厂).甲醇、乙腈均为色谱纯,乙醇、甲酸为分析纯,屈臣氏水.D101大孔吸附树脂柱.
1.2 实验方法
1.2.1 制备受试药物
质量50 g的石韦粉碎后,用6倍量水回流提取2次,每次1 h,各合并后过滤,浓缩得到水提取物.水提物浓缩至体积50 mL,加入体积分数为95%的乙醇,边加边搅拌,至乙醇体积分数达到80%,冷藏静置12 h后抽滤.将醇沉上清液部位以水溶解,质量浓度为0.5 g/mL,用浓度为0.1 mol/L的HCL调至pH为4,抽滤,滤液上D101大孔吸附树脂柱,使药液液面高于树脂柱上表面2 cm,静置吸附12 h.然后依次用蒸馏水、体积分数为10%、30%、50%的乙醇梯度洗脱,流速为4 BV/h,每个梯度洗脱4 BV,洗脱液浓缩干燥,得各梯度洗脱部位.
1.2.2 药物体外抗病毒试验[10-12]
(1)制备多孔板内单层细胞 将细胞接种96孔板,在37 ℃、体积分数5% 的CO2中培养,待长成单层,备用.
(2)药物体外抗HSV-1、RSV 试验 将受试药物用细胞维持液做倍比系列稀释(第1孔10倍,后续孔2倍),共12个梯度的质量浓度,分别依次加入96孔板内的单层vero细胞上(100 μL/孔),设细胞对照、病毒对照.除细胞对照外,各孔加100TCID50的病毒体积为50 μL.于37 ℃、体积分数5% 的CO2中培养,每日显微镜下观察细胞病变,待病毒对照出现90%细胞病变后终止培养.
(3)药物体外抗EV-71试验 将受试药物用细胞维持液做倍比系列稀释(第1孔10倍,后续孔2倍),共12个梯度的质量浓度,依次加入96孔板内的单层RD细胞上(100 μL/孔),设细胞对照、病毒对照.除细胞对照外,各孔加100TCID50的EV71病毒50 μL.于37 ℃、体积分数5% 的CO2中培养,每日显微镜下观察细胞病变,待病毒对照出现90%细胞病变后终止培养.
(4)测量吸光度 将96孔板中的培养液轻轻拍出,每孔加入100 μL中性红溶液,于37 ℃、体积分数5% 的CO2下反应1 h 取出,倒出中性红溶液,小水流冲洗3~5遍,甩干,每孔加入100 μL脱色液,于37 ℃、体积分数5% 的CO2放置15 min.用酶标仪在540 nm处测吸光度值(A值).
(5)TI值计算
细胞存活率=(实验孔的A值-空白孔的A值)/(细胞对照孔A值-空白孔A值)×100%
病变率=1-存活率
细胞比距=(高于50%病变率-50%)/(高于50%病变率-低于50%病变率)
TCID50=Antilg(Ig高于50%CPE百分率病毒稀释度+比距×稀释因子对数)
TI=TC50/EC50,当TI≥4时,则认为有抗病毒活性,否则无效.
1.2.3 体外抗病毒活性检测
将上述制备的各部位按照药物体外抗病毒试验下测其抗病毒指数(表1~表4).
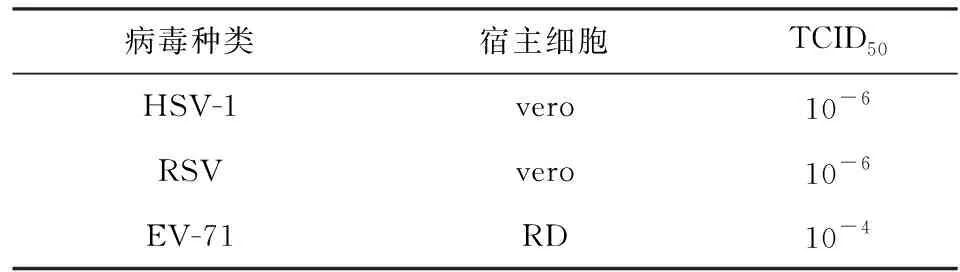
表1 各病毒的TCID50Table 1 TCID50 for each virus
表2石韦体积分数为10%乙醇洗脱部位抗病毒筛选结果
Table2Antiviralscreeningresultsofaristolochiavolumefractionof10%ethanolelutionsite

病毒ρ(TC50)/(mg·mL-1)ρ(EC50)/(mg·mL-1)TIHSV-12-2.42-4.54.287RSV2-1.62-5.514.929EV-712-1.92-4.14.595
表3石韦体积分数为30%乙醇洗脱部位抗病毒筛选结果
Table3Antiviralscreeningresultsofaristolochiavolumefractionof30%ethanolelutionsite

病毒ρ(TC50)/(mg·mL-1)ρ(EC50)/(mg·mL-1)TIHSV-12-1.62-8.7137.187RSV2-1.32-8.2119.428EV-712-0.92-8.9256.000
表4石韦体积分数为50%乙醇洗脱部位抗病毒筛选结果
Table4Antiviralscreeningresultsofaristolochiavolumefractionof50%ethanolelutionsite

病毒ρ(TC50)/(mg·mL-1)ρ(EC50)/(mg·mL-1)TIHSV-12-2.72-7.629.857RSV2-3.12-8.234.297EV-712-2.42-8.568.594
1.2.4 HPLC-MS分析抗病毒有效部位的主要成分
石韦的黄酮部位抗病毒活性显著,具体抗病毒成分需要进一步分析研究.利用HPLC-MS分析石韦有效抗病毒黄酮部位的主要成分,为进一步研究石韦的主要抗病毒成分提供基础.
(1)色谱条件 色谱柱:Thermo-C18柱(Hypersil GOLD aO,100 mm×2.1 mm,1.9 μm);流速:0.3 mL/min;柱温:45 ℃;进样温度:15 ℃;进样体积5 μL;梯度洗脱,流动相A为水(含体积分数为0.05%的甲酸),流动相B为乙腈,洗脱条件见表5.

表5 洗脱条件Table 5 Elution conditions
(2)质谱条件 离子源:HESI;采用负离子模式检测;毛细管电压:3 500 V,毛细管温度:300 ℃;鞘气45,辅气10;源内温度350 ℃;质谱采集范围:100~1 000 m/z;分辨率:70 000;S-Lens RF Level为55.
(3)供试品溶液的制备 精密称取石韦用体积分数为30%的乙醇洗脱的黄酮部位质量20 mg 置于体积25 mL容量瓶中,于体积分数为80%的甲醇中超声溶解,并定容至刻度,过0.22 μm微孔滤膜,得供试品溶液.
2 实验结果
采用四级杆-静电场轨道阱超高分辨质谱仪在1.2.4项条件下对石韦用体积分数30%的乙醇洗脱黄酮部位进行分析,得到相对应的全扫描图(图1),同时进行高分辨二级扫描,得到不同化合物的高分辨二级质谱信息.对离子流色谱图和高分辨二级质谱碎片进行分析[13-15].
2.1 石韦用体积分数为30%的乙醇洗脱黄酮部位成分及分析结果
石韦用体积分数为30%的乙醇洗脱黄酮部位,共有15种化合物,分别为绿原酸、咖啡酸、异杧果苷、杧果苷、牡荆素、阿魏酸、芦丁、木樨草苷、槲皮苷、木樨草素、槲皮素、山柰酚、异鼠李素、香叶木素、山柰素(表6).

图1 石韦总黄酮部位的总离子流图
Table6Resultsofidentificationanalysisof15componentsinflavonoidselutedbyethanolat30%ofthevolumefractionofaristolochia

峰号t/min选择离子Exp/(m·z-1)MSCal/(m·z-1)ppm化合物14.05[M-H]-353.087 86191.055 15、151.038 79353.087 810.14绿原酸24.68[M-H]-179.034 04135.043 81179.034 98-5.25咖啡酸35.45[M-H]-421.078 61331.046 42、301.035 68、259.024 69421.077 632.33异杧果苷45.79[M-H]-421.077 91331.046 23、301.035 61、259.024 78421.077 630.66杧果苷57.91[M-H]-431.099 58341.066 53、323.055 45、311.056 61、293.067 50、283.061 58、269.045 04431.098 372.81牡荆素67.95[M-H]-193.050 19178.026 28、149.059 68、134.035 98193.050 63-2.28阿魏酸78.06[M-H]-609.146 97301.034 61、300.027 74、151.002 47609.146 241.20芦丁88.46[M-H]-447.093 81285.040 83447.093 281.19木樨草苷99.52[M-H]-447.093 60301.034 94、300.028 08、271.024 96、255.029 83、151.002 50447.093 280.72槲皮苷1012.19[M-H]-285.040 83257.045 99、151.002 52、133.028 18、107.012 38285.040 620.74木樨草素1112.25[M-H]-301.035 64273.091 28、179.034 21、151.038 82301.035 380.86槲皮素1213.02[M-H]-285.040 68242.175 96、112.984 09285.040 460.77山柰酚1313.06[M-H]-315.051 45300.027 83、271.024 29、164.010 50、151.002 52、107.012 38315.051 031.33异鼠李素1414.24[M-H]-299.056 82284.034 88、151.002 82、107.013 16299.056 241.94香叶木素1514.80[M-H]-299.056 11113.987 34299.056 24-0.43山柰素
2.2 石韦用体积分数为30%的乙醇洗脱黄酮部位的成分质谱图
在负离子模式下,1号峰保留时间为4.05 min,m/z 353.087 86[M-H]-,二级质谱图中发现191.055 15、151.038 79等绿原酸典型碎片离子峰,经与对照品对比保留时间及质谱信息,化合物1鉴定为绿原酸(图2).
在负离子模式下,2号峰保留时间为4.68 min,m/z 179.034 04 [M-H]-,二级质谱图中发现135.043 81等咖啡酸典型碎片离子峰,经与对照品对比保留时间及质谱信息,化合物2鉴定为咖啡酸(图3).
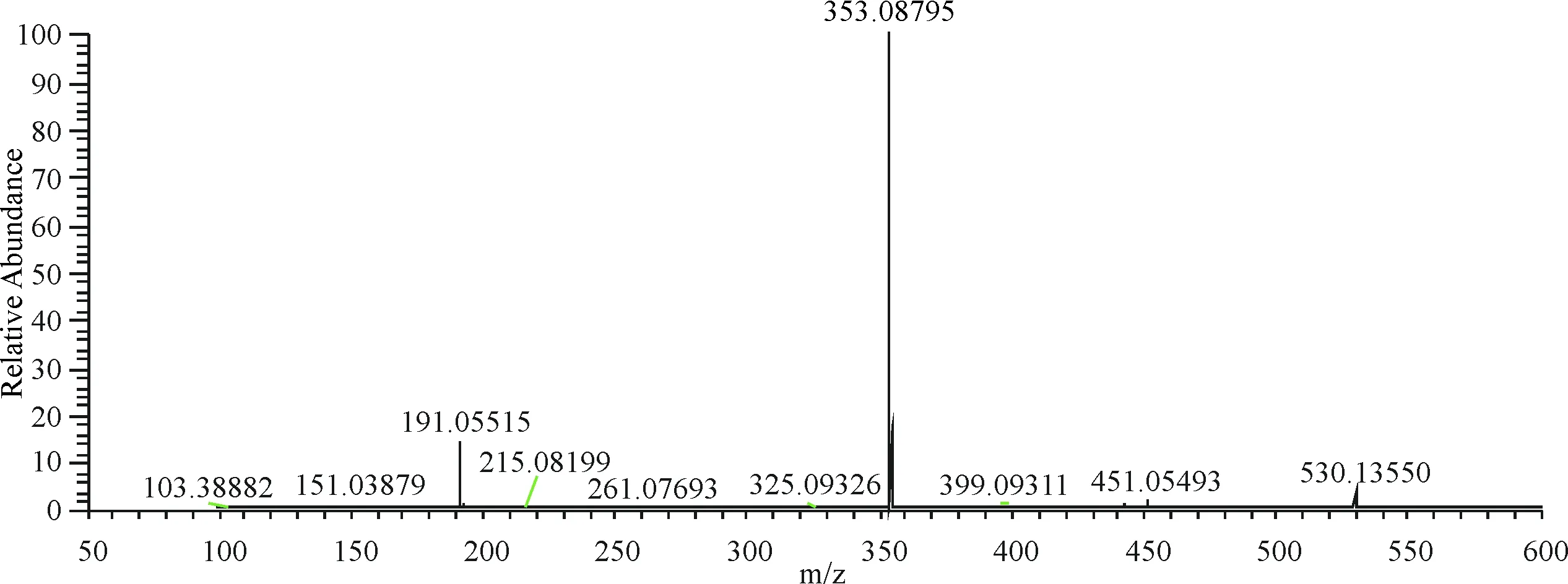
图2 1号成分二级质谱图
Fig.2 No.1 component secondary mass spectrum
在负离子模式下,3号峰保留时间为5.45 min,m/z 421.078 61 [M-H]-,二级质谱图中发现331.046 42、301.035 68、259.024 69等离子碎片峰,m/z 421.078 61发生糖链裂解失去C3H6O3得到m/z 331.046 42,m/z 421.078 61发生糖链裂解失去C4H8O4得到m/z 301.035 68,m/z 421.078 61脱去葡萄糖得到苷元离子m/z 259.024 69,经与对照品对比保留时间及质谱信息,化合物3鉴定为异杧果苷(图4).
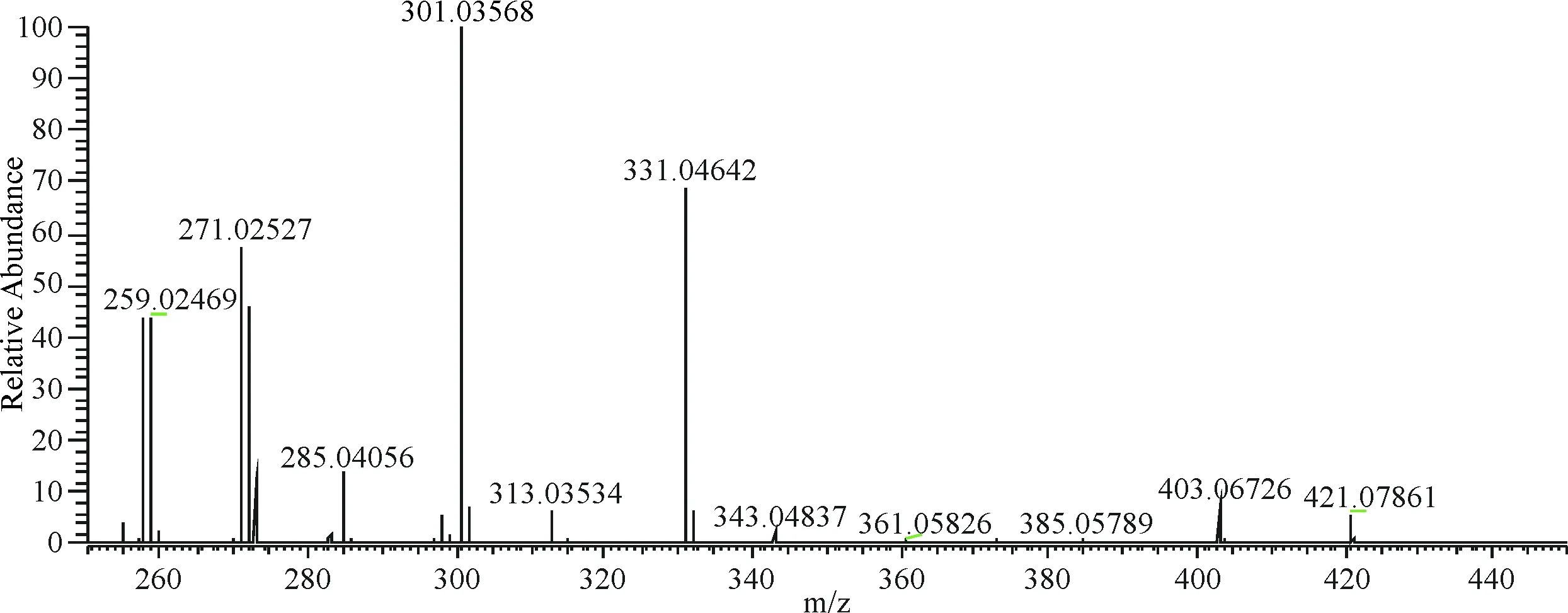
图4 3号成分二级质谱图
在负离子模式下,4号峰保留时间为5.79 min,m/z 421.077 91 [M-H]-,二级质谱图中发现331.046 23、301.035 61、259.024 78等离子碎片峰,与3号峰质谱信息无差别,推测化合物4为杧果苷(图5).

图5 4号成分二级质谱图
在负离子模式下,5号峰保留时间为7.91 min,m/z 431.099 58 [M-H]-,二级质谱图中发现341.066 53、323.055 45、311.056 61、293.067 50、283.061 58、269.045 04等牡荆素典型碎片离子峰,其中m/z 431.099 58发生糖链裂解失去C3H6O3得到m/z 341.066 53,m/z 431发生糖链裂解失去C4H8O4得到m/z311.056 61,m/z341丢失H2O得到m/z 323.055 45,m/z 311丢失H2O得到m/z 293.067 50,m/z 311丢失CO得到m/z 283.061 58,m/z 431发生糖链裂解连续失去C3H6O3和C4H8O4得到m/z 269.045 04,因此推测化合物5为牡荆素(图6).

图6 5号成分二级质谱图
在负离子模式下,6号峰保留时间为7.95 min,m/z 193.050 19 [M-H]-,二级质谱图中发现178.026 28、149.059 68、134.035 98等阿魏酸典型碎片离子峰,其中m/z 193丢失CH3得到m/z 178.026 28,m/z 193.050 19丢失COOH得到m/z 149.059 68,m/z 149丢失CH3得到m/z 134.035 98,推测化合物6为阿魏酸(图7).
在负离子模式下,7号峰保留时间为8.06 min,m/z 609.146 97[M-H]-,二级质谱图中发现301.034 61、300.027 74、151.002 47等芦丁典型碎片离子峰,其中m/z 301.034 61是苷元离子峰,苷元离子失去一个H得到m/z 300.027 74,苷元离子发生RDA反应得到m/z 151.002 47,经与对照品对比保留时间及质谱信息,化合物7鉴定为芦丁(图8).
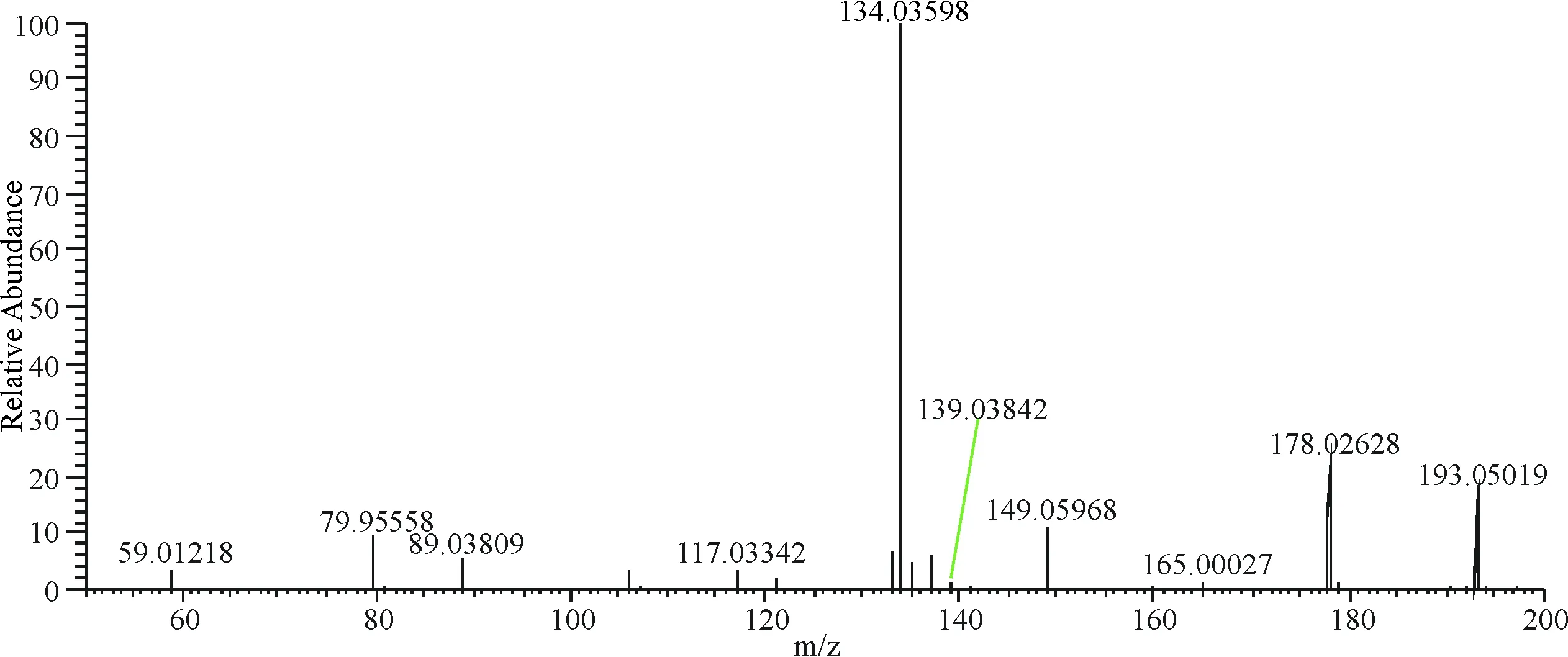
图7 6号成分二级质谱图
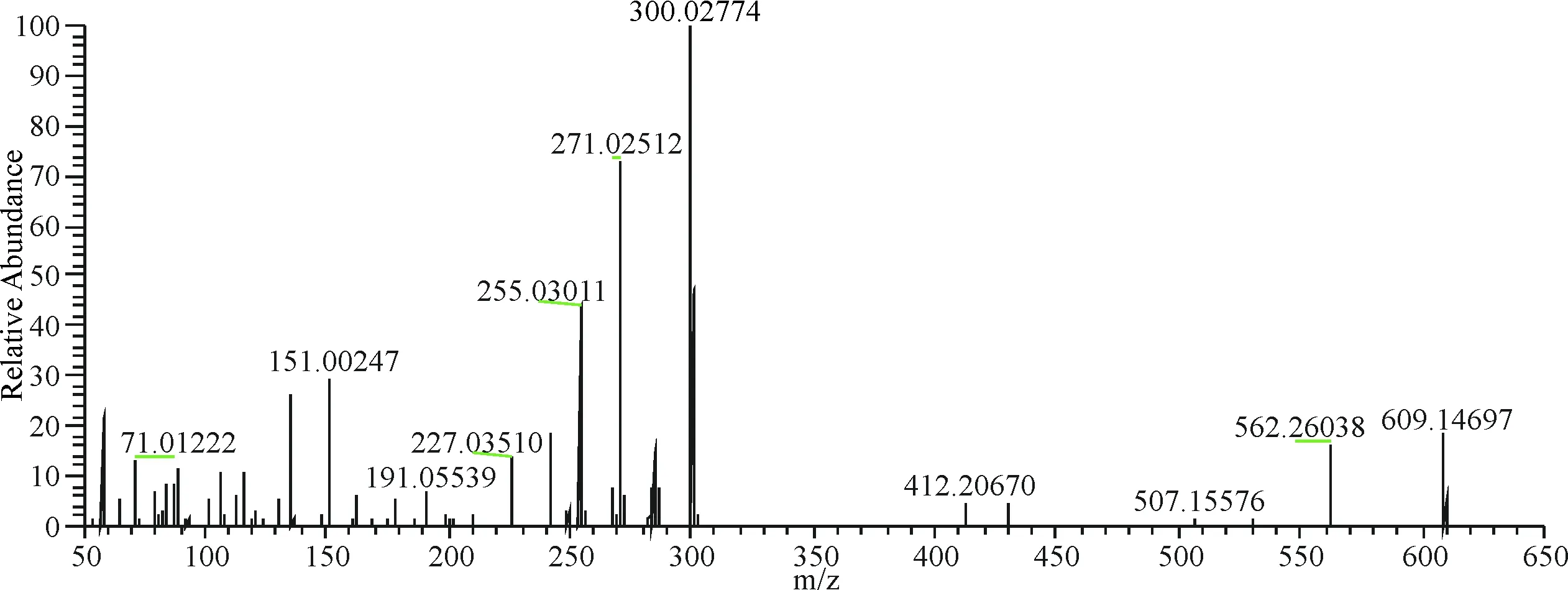
图8 7号成分二级质谱图
在负离子模式下,8号峰保留时间为8.46 min,m/z 447.093 81[M-H]-,二级质谱图中发现285.04083离子碎片峰,m/z 285.040 83为苷元离子峰,推测化合物8为木樨草苷(图9).
在负离子模式下,9号峰保留时间为9.52 min,m/z 447.093 60 [M-H]-,二级质谱图中发现301.034 94、300.028 08、271.024 96、255.029 83、151.002 50等典型槲皮苷碎片离子峰,其中m/z 301.034 94为苷元离子峰,m/z 300.028 08由苷元离子失去一个H产生,m/z 300.028 08失去COH得到271.024 96,m/z 300.028 08失去CO2H得到m/z 255.029 83,苷元发生RDA反应产生m/z 151.002 50,推测化合物9为槲皮苷(图10).
在负离子模式下,10号峰保留时间为12.19 min,m/z 285.040 83[M-H]-,二级质谱图中发现257.045 99、151.002 52、133.028 18、107.012 38等木樨草素典型碎片离子峰,m/z 257.045 99由苷元离子失去一个H和CO产生,苷元发生RDA反应产生m/z 151.002 52、133.028 18、107.012 38,经与对照品对比保留时间及质谱信息,化合物10鉴定为木樨草素(图11).
在负离子模式下,11号峰保留时间为12.25 min,m/z 301.035 064 [M-H]-,二级质谱图中发现273.091 28、179.034 21、151.038 82等槲皮素典型碎片离子峰,m/z 301.035 064脱CO得到m/z 273.091 28,苷元发生RDA反应产生m/z 179.034 21、151.038 82,经与对照品对比保留时间及质谱信息,化合物11鉴定为槲皮素(图12).

图9 8号成分二级质谱图
Fig9 No. 8 component secondary mass spectrum
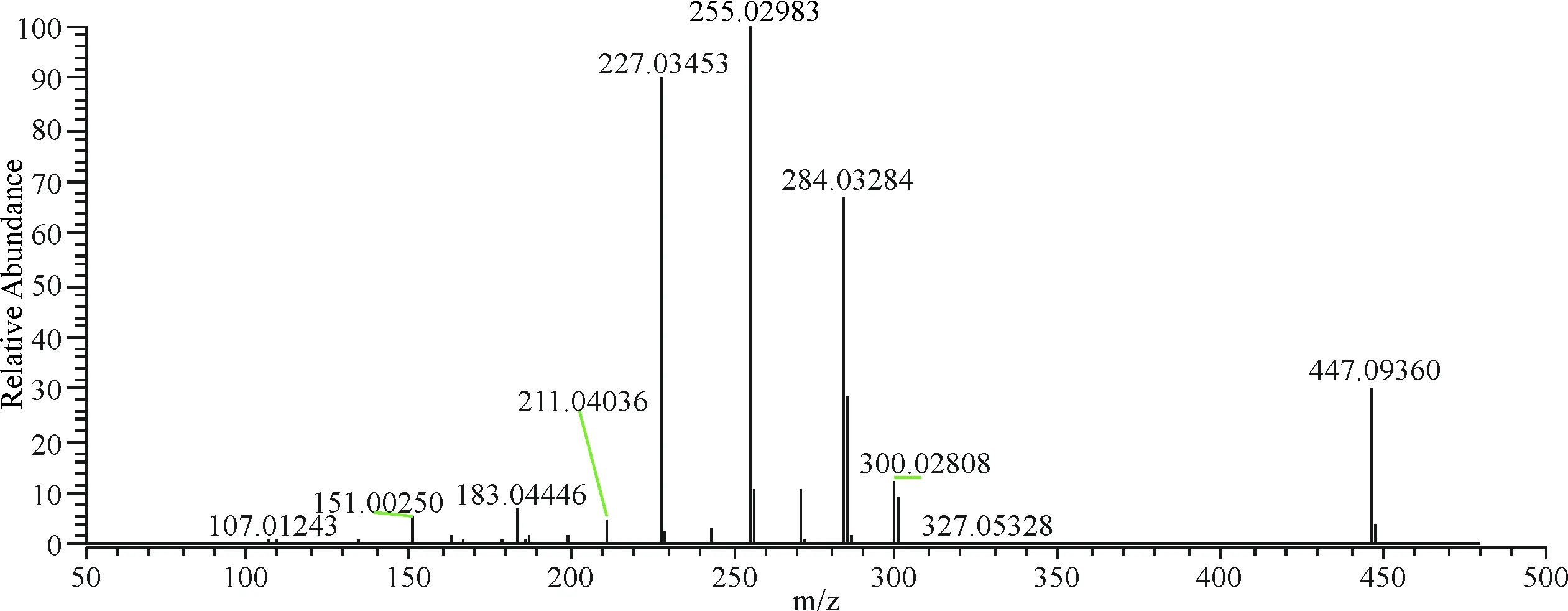
图10 9号成分二级质谱图

图11 10号成分二级质谱图
在负离子模式下,12号峰保留时间为13.02 min,m/z 285.040 68[M-H]-,二级质谱图中发现242.175 96、112.984 09等离子碎片峰,m/z 242.175 96、112.984 09是由m/z 285.040 68发生C环裂解生成,经与对照品对比保留时间及质谱信息,化合物12鉴定为山柰酚(图13).

图12 11号成分二级质谱图
Fig.12 No. 11 component secondary mass spectrum
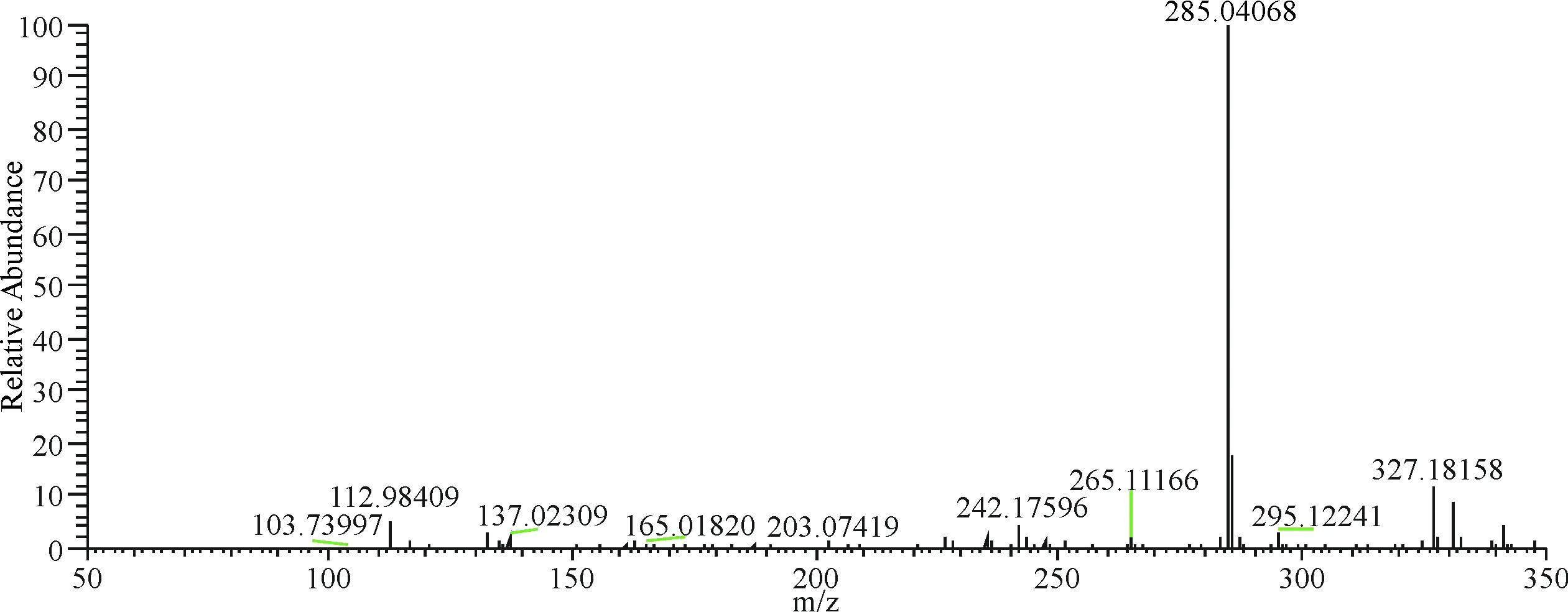
图13 12号成分二级质谱图
在负离子模式下,13号峰保留时间为13.06 min,m/z 315.05145 [M-H]-,二级质谱图中发现300.027 83、271.024 29、164.010 50、151.002 52、107.012 38等离子碎片峰,m/z 315丢失CH3得到m/z 300.027 83,m/z 300.027 83丢失COH得到m/z 271.024 29,m/z 164.010 50、151.002 52、107.012 38是有m/z 300.027 83发生C环裂解生成,化合物13推测为异鼠李素(图14).
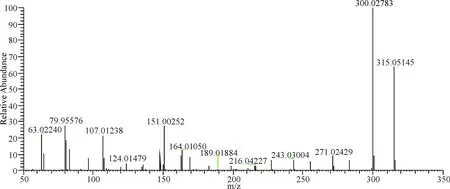
图14 13号成分二级质谱图
在负离子模式下,14号峰保留时间为14.55 min,m/z 299.056 82 [M-H]-,二级质谱图中发284.034 88、151.002 82、107.013 16等离子碎片峰,m/z 299.056 82丢失CH3得到m/z 284.034 88,m/z 151.002 82、107.013 16是有m/z 284.034 88发生C环裂解生成,化合物14推测为香叶木素(图15).
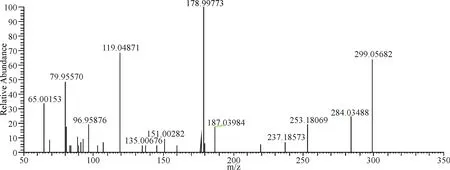
图15 14号成分二级质谱图
在负离子模式下,15号峰保留时间为14.80 min,m/z 299.056 11[M-H]-,二级质谱中m/z 599.119 57是[2M-H]-信号峰,经与对照品对比保留时间及质谱信息,化合物15鉴定为山柰素(图16).
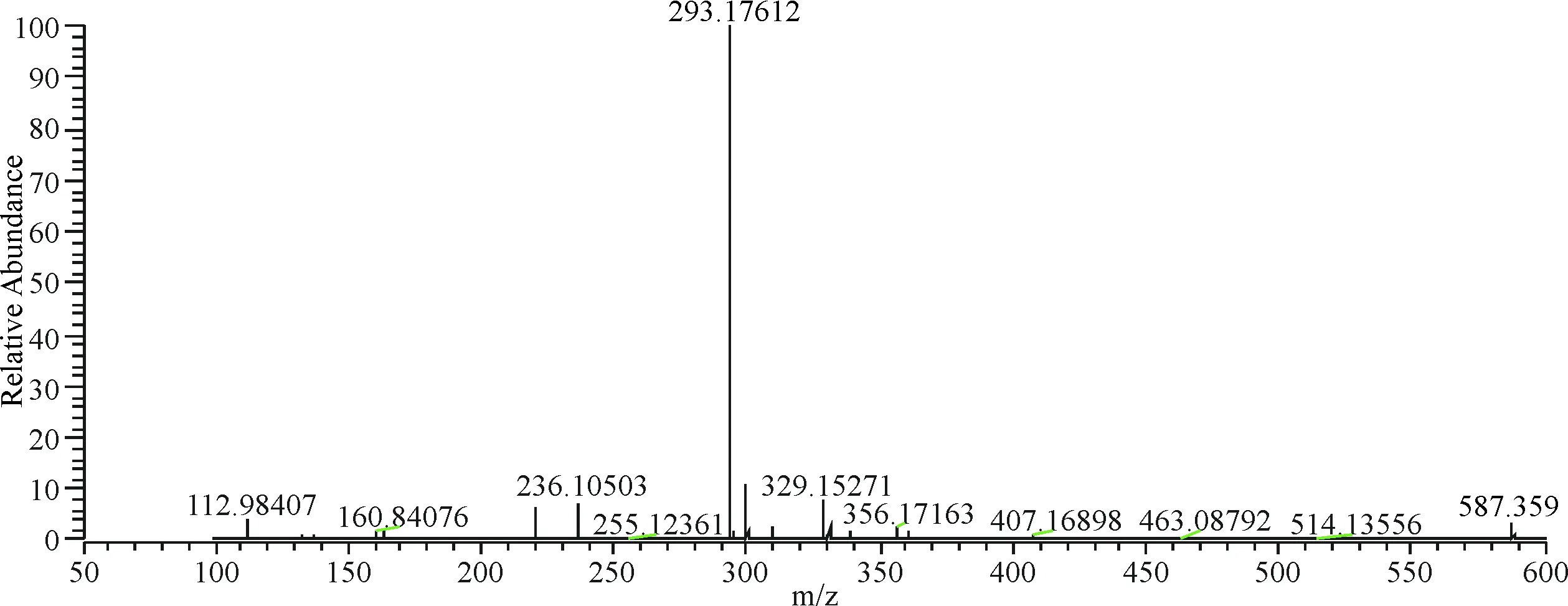
图16 15号成分二级质谱图
3 结论
病毒作为一类高度传染性和变异性的病原体,严重危害人类健康[16].本研究通过对石韦采用不同体积分数乙醇洗脱的黄酮部位进行不同病毒的体外抗病毒实验,体积分数为30%的乙醇洗脱的黄酮部位对肠道EV-71病毒抑制效果最好.因此,利用HPLC-MS联用技术对体积分数为30%的乙醇洗脱的石韦黄酮部位进行了鉴定和表征,在负离子检测模式下利用一级质谱获得黄酮化合物的高质量精度准分子离子峰以及相关碎片离子峰,推断出黄酮化合物的相对分子质量.结合二级质谱数据分析,进一步获得相关结构信息,通过分析裂解规律,参考相关文献报道及对照品质谱信息鉴定出石韦黄酮部位15个成分,其中3个酚酸类成分,12个黄酮类成分.
EV-71为目前肠病毒群中最晚发现的病毒,其感染性强且致病率高,尤其是神经系统方面的并发症.由于EV-71对于中枢神经系统有极高的感染性,故临床上出现之症状包括脑炎、无菌性脑膜炎、急性无力肢体麻痹、手足口症、疱疹性咽峡炎、急性出血性结膜炎、肌肉僵直、头痛、发烧及呕吐等,而其中以手足口症及泡疹性咽峡炎最为常见.一般而言,感染肠病毒多为无症状(约50%~80%)或出现轻微类似感冒的症状,病人会自然痊愈而产生抗体,但因感染肠病毒且转成重症之患者却有极高的机率死于心肺衰竭及广泛性的脑干伤害,实不容小觑[17].长期服用西药,不仅副作用和毒性较大,而且易使病毒产生耐药性,不易治疗.中药治疗具有靶点多,疗效好及毒副作用低等优势,从中药中提取抗病毒成分已经成为抗病毒研究的新策略之一.
目前对石韦的药理作用研究大多致力于抗氧化的研究,本研究通过对石韦黄酮部位进行抗病毒活性追踪和筛选,以寻求石韦新的药理作用发现.在接下来的研究将会进一步确定石韦黄酮部位的主要有效抗病毒成分和含量测定以及抗病毒机理.
