藏药诃子化学成分的高效液相色谱-质谱联用技术快速鉴定研究*
2019-01-29梁文仪梁林金张兰珍
简 平,亓 旗,周 坤,梁文仪,梁林金,叶 婷,张兰珍
(北京中医药大学中药学院 北京 102488)
诃子是使君子科植物诃子Terminalia chebular Retz.及其变种绒毛诃子Terminalia chebula Retz.var.tomentella Kurt.的干燥成熟果实。别名诃黎勒、诃梨,藏医、蒙医称“阿如拉”,泰语称“麻菜果”,原产于印度、缅甸,在我国云南、广东、广西、西藏等地也有分布。具有涩肠止泻,敛肺止咳,降火利咽之功效[1]。诃子主要含有鞣质、酚类、苯丙素类、黄酮和三萜类等多种化学成分,具有抗氧化、抗炎、抗病原微生物、抗肿瘤等作用[2]。目前尚未有液质联用鉴定分析诃子中化学成分的报道。
本研究首次采用高效液相色谱-质谱联用技术(HPLC-LTQ-Orbitrap MS)对诃子提取物中化学成分进行在线分离分析研究,根据其分子离子以及特征碎片离子的精确质荷比,结合标准品、文献数据[3-13]等方法鉴定诃子提取物中的化学成分,并对它们可能的质谱裂解模式进行归纳,以期对诃子的质量控制、药效物质基础及化学成分的快速鉴定提供参考。
1 实验部分
1.1 仪器与试剂
LTQ-Oribitrap XL线性离子阱-串联静电场轨道阱质谱仪:美国Thermo Scientific公司产品,配有热喷雾离子源(HESI)、Xcalibur 2.1化学工作站(美国thermo公司);Thermo Scientific Dionex Utimate 3000 UHPLC Plus Focused超高液相色谱系统:含二元梯度泵,自动进样器,柱温箱,DAD检测器;Chromeleon 7工作站。Millipore Synergy UV型超纯水机(美国Millipore公司);Sartorious BT 25S型万分之一电子分析天平(北京赛多利斯仪器有限公司);超声波清洗器(北京中晟名科技有限公司,100 W);0.22 μm微孔滤膜(天津市津腾实验设备有限公司);甲醇(质谱纯,Fisher公司);乙酸(色谱纯,天津市丰越化学品有限公司)。
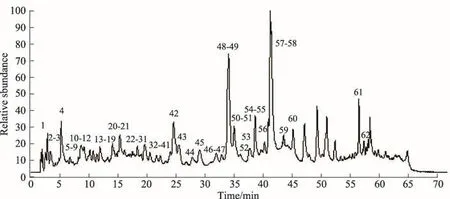
图1 诃子提取物的总离子流图(负离子模式)
诃子药材产于西藏,经北京中医药大学刘春生教授鉴定为使君子科植物诃子Terminalia chebula Retz.的干燥成熟果实;没食子酸(批号141109)购于成都普菲德生物技术有限公司、没食子酸甲酯(批号160105)购于北京四面体生物科技有限公司、柯里拉京(批号MUST — 1051301)、鞣花酸(批号MUST — 15091807)均购于成都曼思特生物科技有限公司、诃子鞣酸(批号Z06D5B2)购于上海源叶生物科技有限公司,纯度≥98%。
1.2 实验方法
1.2.1 色谱条件
色谱柱:Diamonsil C18柱 (4.6 mm×250 mm,5 μm);流动相:0.2%醋酸的水溶液(A),甲醇溶液(B);梯度洗脱条件:0-10 min(5%-15%B),10-15 min(15%-25%B),15-30 min(25%-30%B),30-50 min(30%-60%B),50-55 min(60%-90%B),55-62 min(90%-90%B);流速:1 mL·min-1;进样量:20 μL;柱温:30℃;检测波长:270 nm。
1.2.2 质谱条件
HESI离子源,负离子检出模式,离子源温度350℃,电离源电压4 KV,毛细管电压:35 V,管透镜电压:110 V,鞘气和辅助气均为高纯氮气(纯度>99.99%),鞘气流速:40 arb,辅助气流速:20 arb;数据采用傅里叶变换高分辨全扫方式(TF,Full scan,Resolution 30000)数据依赖性(data-dependent acquisistion)ddMS2和ddMS3;母离子列表(Parent ion list)PIL-MS2和PIL-MS3;并运用CID和HCD(高能量碰撞)相结合的碎解方式等多种策略。
1.2.3 供试品溶液的制备
称取诃子药材粉末约0.2 g,精密称定,置于100 mL具塞锥形瓶中,加入50%甲醇20 mL,超声提取50 min,静置冷却,补足原重量。摇匀,取上清液,过0.45 μm微孔滤膜,即得供试品溶液。
1.2.4 对照品溶液的制备
精密称定对照品没食子酸2.1 mg,没食子酸甲酯2.1 mg,柯里拉京2.0 mg,诃子鞣酸2.1 mg,置 10 mL量瓶中加甲醇溶解,定容,摇匀。精密称定鞣花酸对照品2.3 mg,置10 mL量瓶中加DMSO溶解,定容,摇匀,即得对照品溶液。
2 结果
按照1.2节方法分析诃子提取物,由于诃子所含化学成分主要为酚酸、可水解鞣质、黄酮等酸性化合物,选择负离子模式,得到其在负离子模式下的总离子流图(图1)。根据检测得到的各化学成分保留时间、精确质谱信息,并结合提取离子流图与标准品信息、Scifinder数据库及相关文献对其进行成分确认,共鉴定了62个成分,包括60个酚酸和鞣质,2个三萜类(峰61,62)。其中,通过与对照品比对鉴定的化学成分有:没食子酸(gallic acid)、没食子酸甲酯(methyl gallate)、柯里拉京(corilagin)、诃子鞣酸(chebulagic acid)、鞣花酸(ellagic)acid。峰5,19,20,26,31,34,35,38,44,45,51,53,55和峰59为首次从藏药诃子中发现。详情列于(表1)。
2.1 酚酸类化合物鉴定
1号峰保留时间为2.91 min,其分子离子峰为m/z 191[M—H]—,该离子失去一个中性碎片H2O(18u)产生碎片离子m/z 173[M-H—H2O]—,失去一个中性碎片CO(28u)和2个H2O(18u)产生碎片离子 127[M —H—CO—2H2O]—。根据元素组成分析,推测分子式为C7H12O6,相对分子质量理论值为191.0550,实测值为191.0554。1 号峰被推测为 quinic acid[14,15]。
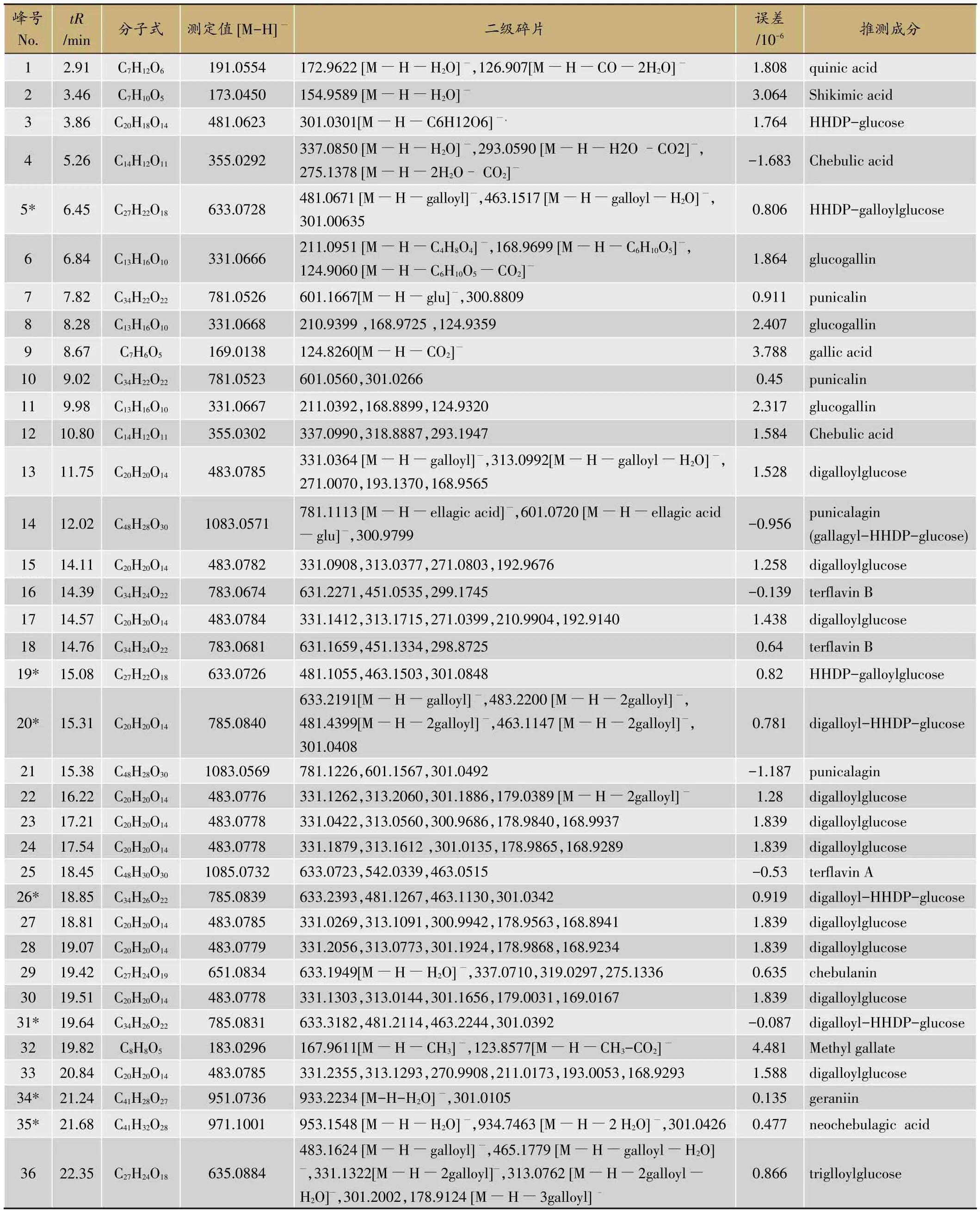
表1 诃子提取物中的主要化学成分
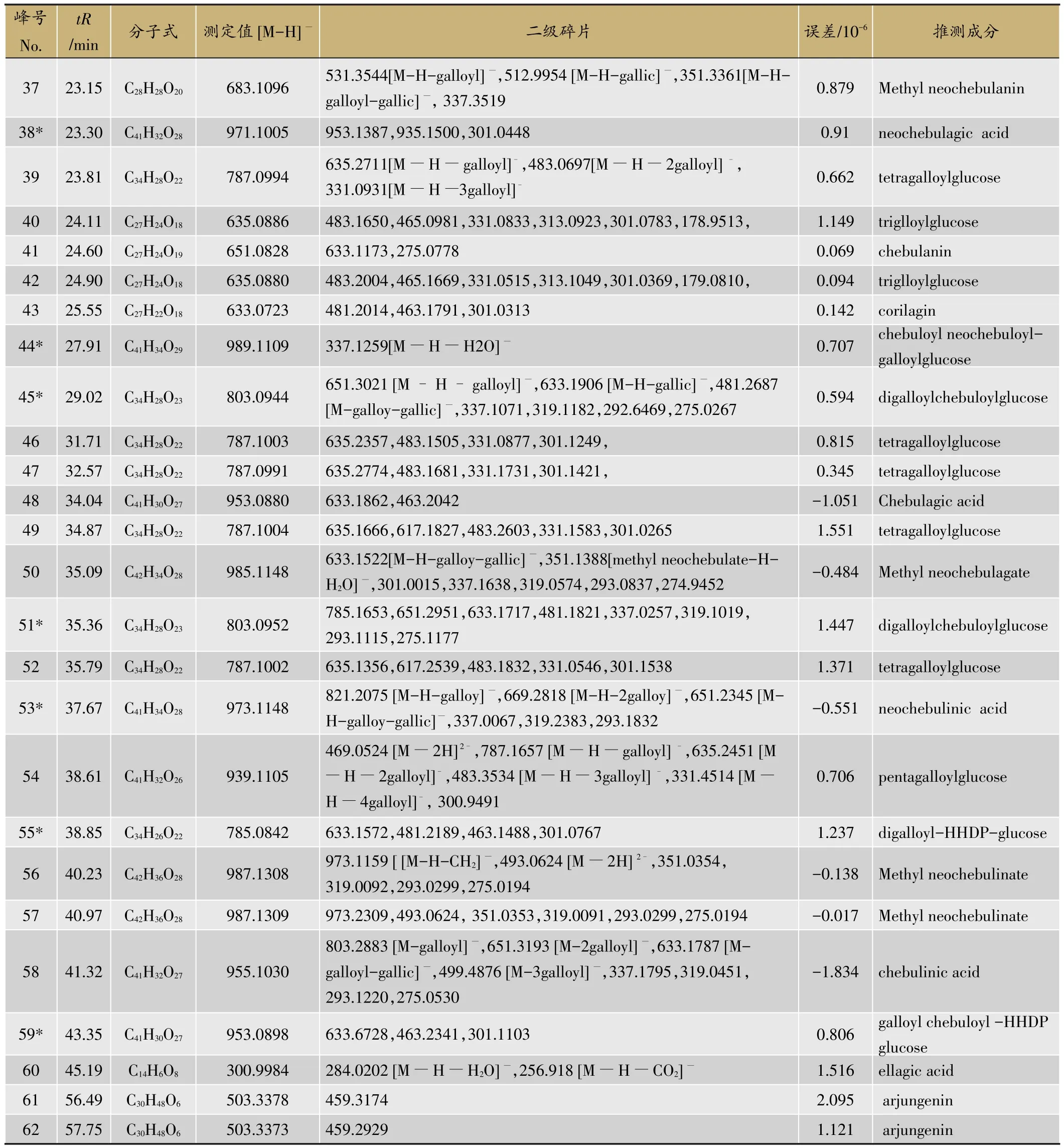
续表1
2号峰保留时间为3.46 min,其分子离子峰为m/z 173[M—H]—,失去一个中性碎片H2O(18 u)产生碎片离子m/z 155[M—H—H2O]—。根据元素组成分析,推测分子式为C7H10O5,相对分子质量理论值为173.0444,实测值为173.0450。2号峰被推测为Shikimic acid[5]。
通过标准品比对,结合文献数据[14,17],峰9和60被鉴定为gallic acid和ellagic acid。gallic acid分子离子峰为m/z 169[M—H]—,gallic acid失去一个中性碎片CO2(44 u)产生碎片离子m/z 125[M—H—CO2]—。根据元素组成,其分子式为C7H6O5,相对分子质量理论值为169.0131,实测值为169.0138;ellagic acid的分子离子峰为m/z 301[M—H]—,特征碎片离子m/z 603[2M— H]—,ellagic acid失去一个中性碎片 H2O(18 u)产生碎片离子m/z 283[M—H—H2O]—,m/z 257[M-HCO2]—为其失去一个中性碎片CO2(44 u)产生的碎片离子。根据元素组成,推测分子式为C14H6O8,相对分子质量理论值为300.9979,实测值为300.9984。
2.2 简单没食子酰酯类化合物鉴定
简单没食子酰类化合物,其特征碎片离子源于失去没食子酰基部分(-galloyl,-152 u)而产生。以54号峰为例,保留时间为38.61 min,其分子离子峰为m/z 939[M—H]—,依次失去一个没食子酰基(152 u),从而形成的系列碎片离子有:m/z 787[M—H—galloyl]-,m/z 635[[M—H—2galloyl]-,m/z 483[M—H—3galloyl]-,m/z 331[M—H—4galloyl]-,m/z 179[M—H—5galloyl]-。根据元素组成,推测分子式为C41H32O26,相对分子质量理论值为m/z 939.1098,实测值为m/z 939.1105。54号峰被推测为pentagalloylglucose。
39,46,47 ,49和52号峰的保留时间分别为23.81min,32.02 min,32.85 min,34.90 min和35.80 min,其分子离子峰均为m/z 787[M—H]—。根据元素组成,推测其分子式为C34H28O22,相对分子质量理论值为m/z 787.0988,39号峰实测值为m/z 787.0994,峰46实测值为m/z 787.0995,47号峰实测值为m/z 787.0991,49号峰实测值为m/z 787.1004,52号峰实测值为m/z 787.1002。根据其依次失去一系列没食子酰基,结合简单没食子酰类化合物的特征碎片,39,46,47,49和52号峰被推测为tetragalloylglucose及其同分异构体;36,40,42号峰的保留时间分别为22.35,24.11和24.90,其分子离子峰均为m/z 635[M—H]—。根据元素组成,推测其分子式为C27H24O18,相对分子质量理论值为635.0879,36号峰实测值为635.0883,40号峰实测值为635.0886,42号峰实测值为635.0880。根据简单没食子酰类化合物的特征碎片,被推测为triglloylglucose及其同分异构体。
13,15,17 ,22-24,27,28,30,33号峰的保留时间分别为 11.80 min,14.10 min,14.60 min,16.22 min,17.21 min,17.54 min,18.81 min,19.07 min,19.51 min和20.80 min,其分子离子峰为m/z 483[M—H]—。根据元素组成,推测其分子式为C20H20O14,相对分子质量理论值为m/z 483.0769,13号峰实测值为m/z 483.0785,15号峰实测值为m/z 483.0782,17号峰实测值为m/z 483.0784,22号峰实测值为m/z 483.0776,23号峰实测值为m/z 483.0778,24号峰实测值为m/z 483.0778,27号峰实测值为m/z 483.0785,28号峰实测值为m/z 483.0779,30号峰实测值为m/z 483.0778,33号峰实测值为m/z 483.0785。结合简单没食子酰类化合物的特征碎片,被推测为digalloylglucose及其同分异构体。
6,8,11 号峰的保留时间分别为6.84 min,8.28 min和9.98 min,其分子离子峰为m/z 331[M—H]—。根据元素组成,推测其分子式为C13H16O10,相对分子质量理论值为m/z 331.0660,6号峰实测值为m/z 331.0666,8号峰实测值为m/z 331.0668,11号峰实测值为m/z 331.0667。结合简单没食子酰类化合物的特征碎片,被推测为 glucogallin 及其同分异构体[14,17,18]。以 glucogallin为例,说明简单没食子酰酯类化合物的裂解方式:m/z 331[M—H]-为其分子离子峰,失去一个中性碎片C4H8O4(120 u)产生碎片离子m/z 211[M—H—C4H8O4]—,失去一个没食子酰基(152 u)产生碎片离子m/z 179[M—galloyl]—,失去一个中性碎片C6H10O5(162 u)产生没食子酸碎片m/z 169[M—H—C6H10O5]—,失去一个中性碎片C6H10O5的基础上,再失去一个中性碎片CO2(44 u)产生碎片离子m/z 125[M—H—C6H10O5— CO2]—。
32号峰的保留时间为19.82 min,其分子离子峰为m/z 183[M—H]—,失去一个CH3(15u)中性碎片形成碎片离子m/z 168[M—H—CH3]—,再失去一个CO2(44u)形成碎片离子m/z 124[M—H—CH3-CO2]—。根据元素组成,推测其分子式为C8H8O5,相对分子质量理论值为m/z 183.0288,实测值为m/z 183.0296。峰32被鉴定为methyl gallate,这与其标准品碎裂信息一致。
2.3 鞣质类化合物鉴定
鞣花鞣质由于其结构中具有HHDP部分,碎片离子m/z 301是其典型特征。5,19,43号峰的保留时间分别为6.45 min和25.55 min,其分子离子峰为m/z 633[M—H]—和m/z 1267[2M—H]—,失去一个没食子酰基产生碎片离子m/z 481[M—H—galloyl]—,继续失去一个H2O(18u)产生碎片离子m/z 463[M—H—galloyl—H2O]—。根据元素组成,推测其分子式为C27H22O18,相对分子质量理论值为m/z 633.0722,峰5实测值为m/z 633.0728,19号峰实测值m/z 633.0726,峰43实测值m/z 633.0723。该化合物失去332 u形成m/z 301(HHDP)碎片离子,这表明其结构中含有一个galloylglucose(332 u)单元。因此5,19,43号峰被鉴定为galloyl—HHDP—glucose及其异构体[16,19],进一步与对照品比较,43号峰被鉴定为corilagin。
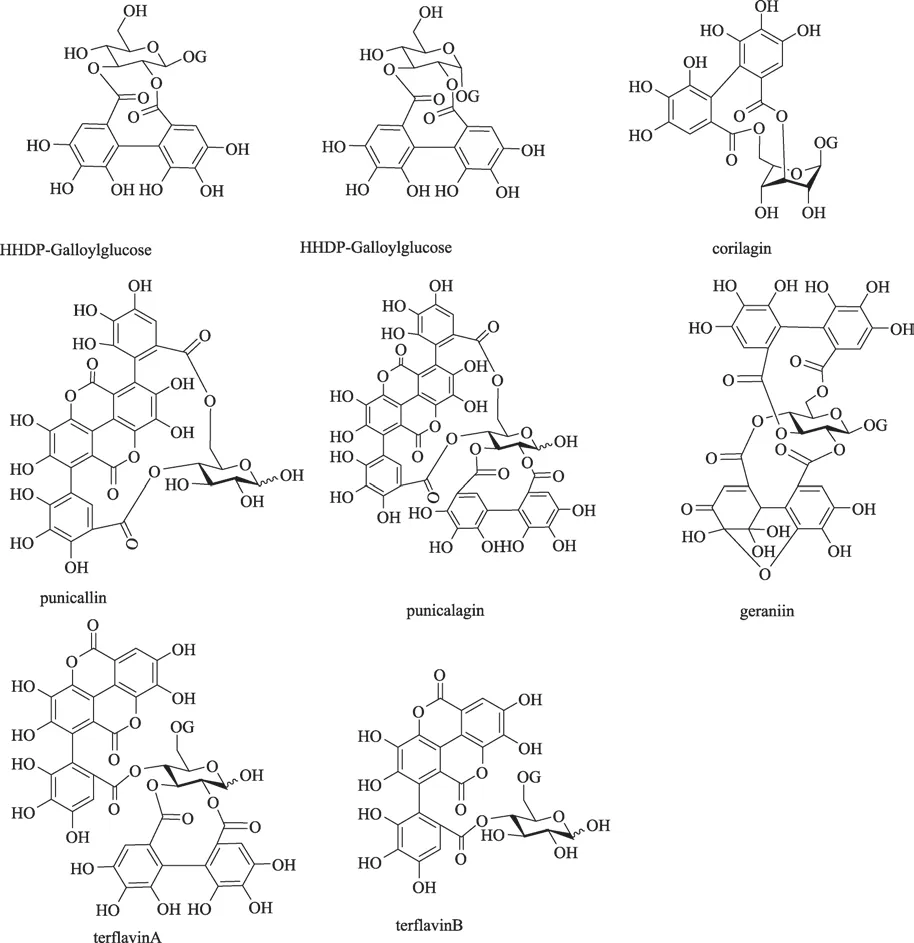
图1 诃子鞣质类部分化合物结构图
20,26,31 和55号峰的保留时间分别为15.30 min,18.85 min和19.64 min,38.90 min,分子离子峰为m/z 785[M—H]—,该离子连续失去没食子酰基产生碎片离子m/z 633[M—H—galloyl]—、m/z 481[M—H—2galloyl]—,继续失去一个中性碎片H2O(18u)产生碎片离子m/z 463[M—H—2galloyl—H2O]—。根据元素组成,推测其分子式为C34H26O22,相对分子质量理论值为m/z 785.0832,20号峰实测值为m/z 7785.0841,26号峰实测值为m/z 7785.0839,31号峰实测值为m/z 785.0831,55号峰实测值为m/z 785.0842。结合特征碎片离子m/z 300(HHDP),20,26,31和55号峰被推测为digalloyl—HHDP—glucoses[23]。然而仅凭MS,MS/MS和UV等手段,仍无法区分tercatain及其同分异构体。
34号峰的保留时间为21.24 min,分子离子峰为m/z 951[M—H]—,该离子失去一个中性碎片H2O(18u)产生碎片离子m/z 933[M—H—H2O]—。根据元素组成,推测其分子式为C41H28O27,相对分子质量理论值为m/z 951.0734,实测值为m/z 951.0736。结合文献数据与特征碎片m/z 301[21],34号峰被推测为geraniin。
3号峰,分子离子峰为m/z 481[M—H]—,失去一个葡萄糖产生碎片离子m/z 301(HHDP)。根据元素组成,推测其分子式为C20H18O14相对分子质量理论值为m/z 481.0613,实测值为m/z 481.0623。3号峰被初步推测为HHDP—glucose。14和21号峰的保留时间分别为12.02 min和15.38 min,分子离子峰为m/z 1083[M—H]—,失去一个鞣花酸单元产生碎片离子m/z 781[M—H—ellagic acid]—,继续失去一个葡萄糖产生碎片离子m/z 601[M—H—ellagic acid—glu]—。根据元素组成,推测其分子式为C48H28O30,相对分子质量理论值为m/z 1083.0582,14号峰实测值为m/z 1083.0571,21峰实测值m/z 1083.0569。结合特征碎片离子m/z 541[M— 2H]2—、m/z 301(DPPH),14和21号峰被推测为punicalagin。反相色谱中,α—punicalagin比β—punicalagin先出峰。所以14号峰被推测为α—punicalagin,21号峰被推测为为β—punicalagin。对应于punicalagin的裂解碎片m/z 781[M—H—ellagic acid]—,7和10号峰的分子离子峰为m/z 781[M—H]—,保留时间分别为7.82 min和8.28 min,失去一个葡萄糖碎片产生碎片离子m/z 601[M—H—glu]—。根据元素组成,推测其分子式为C34H22O22,相对分子质量理论值为m/z 781.0519,7号峰实测值为m/z 781.0526,峰10实测值m/z 781.0523。结合碎片离子m/z 301(DPPH),7和10号峰被推测为punicalin及其同分异构体[20]。
16和18号峰的保留时间分别为14.39 min和14.76 min,分子离子峰为m/z 783[M—H]—,结合文献数据[22],特征碎片离子有m/z 391[M — 2H]2—,m/z 631,m/z 451,m/z 299。根据元素组成,推测其分子式为C34H24O22,相对分子质量理论值为m/z 783.0675,16号峰实测值为m/z 783.0674,18号峰实测值为m/z 783.0681。16和18号峰初步推测为terflavin B及其异构体。25号峰在保留时间15.43—18.41 min范围内出现了一个宽峰,表明其可能由几个同分异构体组成,分子离子峰为m/z 1085[M—H]—。根据元素组成,推测其分子式为C48H30O30,相对分子质量理论值为m/z 1085.0738,25号峰实测值为m/z 1085.0732,结合文献数据[22],25号峰被初步推测为terflavin A。
m/z 337[Chebulic acid—H—H2O]—是诃子次鞣质类化合物的特征碎片,是由诃子次鞣质的基本结构单元诃子次酸(Chebulic acid)分子内失去一个中性碎片H2O形成,该类化合物的特征碎片还有m/z 319[Chebulic acid— H — H2O — H2O]—,m/z 293[Chebulic acid—H — H2O-CO2]—,m/z 275[Chebulic acid— H — H2O— H2O — CO2]—。
35和38号峰的保留时间分别为21.68 min和23.33 min,分子离子峰为m/z 971.10[M—H]—。根据元素组成,推测其分子式为C41H32O28,相对分子质量理论值为m/z 971.0996,35号峰实测值为m/z 971.1001,38号峰实测值为m/z 971.1005,结合特征碎片离子m/z 953[M — H — H2O]—,m/z 935[M — H — 2H2O]—,m/z 467[M—2H—2H2O]2—,初步推测其为neochebulagic acid及其异构体[19]。
44号峰的保留时间为27.91 min,分子离子峰为m/z 989[M—H]—。根据元素组成,推测其分子式为C41H34O29,相对分子质量理论值为m/z 989.1102,实测值为m/z 989.1109。结合特征碎片离子m/z 494[M—2H]2-,m/z 337。峰44被推测为chebuloyl neochebuloyl galloylglucose[19]。
45和51号峰的保留时间为29.02 min和35.30 min,分子离子峰为m/z 803[M—H]—,该离子失去一个中性碎片没食子酸后产生碎片离子m/z 633[M—H—gallic]—,该离子失去一个没食子酰基产生碎片离子m/z 651[M-H-galloyl]—,继续失去一个没食子酸中性碎片形成m/z 481[M—galloy—gallic]—。根据元素组成,推测其分子式为C34H28O23,相对分子质量理论值为m/z 803.0938,45号峰实测值为m/z 803.0944,51号峰实测值为m/z 803.0945。结合其特征离子m/z 337,m/z 319,m/z 293,m/z 275,m/z 401[M — 2H]2—,45和51号峰被推测为digalloyl—chebuloyl—glucose及其同分异构体[22]。
53号峰的保留时间为37.67 min,分子离子峰为m/z 973[M—H]—,连续失去没食子酰基产生碎片离子m/z 821[M — H — galloy]—、m/z 669[M — H — 2galloy]—、m/z 517[M—H—3galloy]—,失去一个没食子酰后继续失去一个没食子酸中性碎片产生碎片离子m/z 651[M—H—galloy—gallic]—。根据元素组成,推测其分子式为C41H34O28,相对分子质量理论值为m/z 973.1153,实测值为m/z 973.1148。结合特征碎片m/z 337,53号峰被推测为neochebulinic acid。
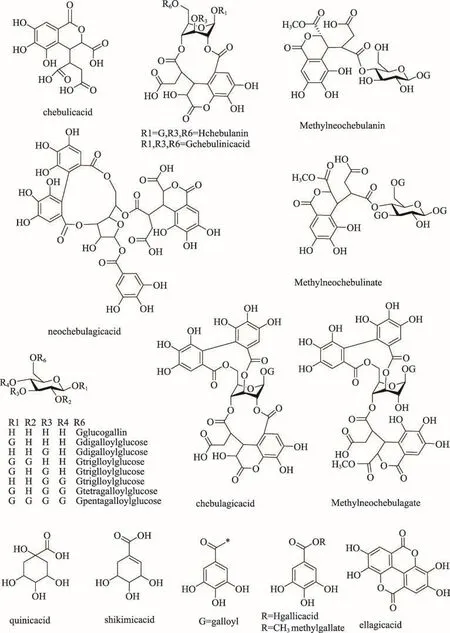
图2 诃子鞣质类、酚酸类部分化合物结构图
48和59号峰的保留时间分别为34.04 min和43.35 min,分子离子峰为m/z 953[M—H]—,该离子失去一个羧基形成碎片离子m/z 454[M—H—COOH]2-。根据元素组成,推测其分子式为C41H30O27,相对分子质量理论值为953.0891,48号峰实测值为953.0881,59号峰实测值为953.0898。根据文献数据结合特征离子有 m/z 476[M — 2H]2—,m/z 633,m/z 463,m/z 300(DPPH),二者初步被鉴定为galloyl chebuloyl—HHDP-glucose[17,19],进一步与标准品对比,48 号峰被鉴定为chebulagic acid。
峰4和12的保留时间为5.26 min和10.80 min,分子离子峰为m/z 355[M—H]—。依据特征离子m/z 337[M—H—H2O]—、m/z 711[2M—H]—。根据元素组成,推测其分子式为C14H12O11,相对分子质量理论值为m/z 355.0296,峰4实测值为m/z 355.0292,峰12实测值为m/z 355.0302。因此4和12号峰被初步鉴定为chebulic acid及其异构体[17,19]。峰37,保留时间为 23.15 min,分子离子峰为m/z 683[M—H]—,失去一个没食子酸中性碎片产生碎片离子m/z 513[M—H—gallic]—,失去一个没食子酰基后产生碎片离子m/z 531[M—H—galloyl]—,继续失去一个没食子酸中性碎片产生碎片离子m/z 351[M—H—galloyl—gallic]—。根据元素组成,推测其分子式为C28H28O20,相对分子质量理论值为m/z 683.1090,实测值为m/z 683.1096。因此,峰37被初步推测为 methyl neochebulanin[16,19]。
29和41号峰的保留时间分别为19.40 min和24.60 min,分子离子峰为m/z 651[M—H]—。根据元素组成,推测其分子式为C27H24O19,相对分子质量理论值为m/z 651.0828,实测值为m/z 651.0828。结合特征碎片离子m/z 633[M—H—H2O]—,29和41号峰被初步推测为chebulanin及其同分异构体。
50号峰的保留时间为35.09 min,分子离子峰为m/z 985[M—H]—,失去一个CH2(14u)中性碎片产生碎片离子m/z 971[[M—H—CH2]—,失去一个没食子酸中性碎片和没食子酰基后产生碎片离子m/z 633[M—galloy—gallic]—。根据元素组成,推测其分子式为C42H34O28,相对分子质量理论值为m/z 985.1153,50号峰实测值为m/z 985.1148。结合文献数据和特征碎片离子m/z 492[M — 2H]2—,m/z 351[methyl neochebulate—H—H2O]—,50号峰被推测为methyl neochebulagate及其同分异构体[22]。
56和57号峰的保留时间分别为40.23 min和40.97 min,分子离子峰为m/z 987[M—H]—。根据元素组成,推测其分子式为C42H36O28,相对分子质量理论值为m/z 987.1309,实测值为m/z 987.1308。依据文献数据和特征碎片m/z 973[M—H—CH2]—,m/z 493[M—2H]2—,m/z 351[methyl neochebulate— H — H2O]—,56和57号峰被推测为methyl neochebulinate及其同分异构体[22]。
58号峰的保留时间为41.32 min,分子离子峰为m/z 955[M—H]—,连续失去没食子酰基产生碎片离子m/z 803[M — galloyl]—、m/z 651[M — 2galloyl]—、m/z 499[M—3galloyl]—,失去3个没食子酰基后继续失去一个葡萄糖产生碎片离子峰m/z 319[M—3galloyl—glu]-。根据元素组成,推测其分子式为C41H32O27,相对分子质量理论值为m/z 955.1047,实测值为m/z 955.1030。因此,58号峰被推测为chebulinic acid[17]。
2.5 三萜类化合物鉴定
在负离子模式下,61和62号峰其分子离子峰为m/z 503[M—H]—,该离子脱去CO2(14u)形成碎片离子m/z 459[M-H-CO2]—。根据元素组成分析,两者分子式为C30H48O6,相对分子质量理论值为m/z 503.3367,实测值为m/z 503.3378和m/z 503.3373。卢普平等人从诃子乙醇提取物中分离得到的三萜类化合物有arjungenin,分子式均为C30H48O6,其相对分子质量为m/z 503.3367,与所测数据一致,因此初步推测61和62号峰为arjungenin及其同分异构体。
3 总结与讨论
本实验采用HPLC—MS技术对诃子提取物的化学成分进行研究,通过高分辨质谱中精确分子质量归属出元素组成,分析裂解碎片信息,结合标准品信息及相关文献共鉴定出62种化学成分,主要为可水解鞣质类。其中,14个化合物为首次从诃子中鉴定得到。分析了已鉴定化合物的质谱碎裂途径,推测出酸类和可水解鞣质类化学成分的质谱裂解规律,可为中药化学成分及其类似物质的结构解析提供参考。
