沙利度胺对实验性自身免疫性脑脊髓炎大鼠CD4+T细胞凋亡的影响
2018-10-08王赵伟吴承龙谢建平肖桂荣钟芳芳
王赵伟 吴承龙 谢建平 肖桂荣 钟芳芳
多发性硬化是临床上常见的中枢神经系统自身免疫性疾病,目前缺乏特效药[1]。沙利度胺可用于多发性骨髓瘤,且价格低廉[2-3]。近年来研究发现它在自身免疫性疾病中具有应用前景[4-5]。实验性自身免疫性脑脊髓炎(EAE)大鼠是最为常用的多发性硬化动物模型。笔者前期EAE模型的动物实验发现,沙利度胺对于改善大鼠EAE发病期症状具有一定的作用[6],但关于具体作用机制还不明确。已知EAE发病时中枢髓鞘脱失、轴突损伤和预后的关系极为密切,为进一步明确沙利度胺对减轻EAE大鼠中枢髓鞘、轴突损伤的作用以及CD4+T细胞的调控机制,笔者作了本研究,现将结果报道如下。
1 材料和方法
1.1 材料 11~12周龄雄性SD大鼠30只,体重160~180g;10~12周龄豚鼠10只,雌雄不拘,均购自上海斯莱克实验动物有限公司;坚牢蓝(LFB)染液(货号:G1030)、甘氨酸银染色试剂盒(货号:G1052)均购自武汉塞维尔生物科技有限公司;沙利度胺(货号:T144-1G)、完全弗氏佐剂(货号:F5881-6X10ml)均购自美国Sigma-Aldrich公司;荧光标记的CD3(货号:12-0030-82)、CD4抗体(货号:17-0040-82) 均购自美国 eBioscience公司。Annexin V-FITC/碘化丙啶(PI)凋亡检测试剂盒(货号:70-AP101-60)购自杭州联科生物技术股份有限公司。小鼠抗大鼠CD4(货号:sc-53041)、GFAP一抗(货号:sc-33673)、小鼠IgG kappa结合蛋白偶联辣根过氧化物酶(m-IgGκBP-HRP;货号:sc-516102-CM)均购自圣克鲁斯生物技术有限公司。
1.2 方法
1.2.1 动物分组与建模 将SD大鼠分成3组(即空白对照组、模型组、药物组),每组10只。模型组与药物组采用皮下注射豚鼠脊髓匀浆方法制作EAE模型[7]。将豚鼠经10%水合氯醛麻醉并用0.9%氯化钠溶液左心室灌注处死,获得新鲜脊髓组织混入等量0.9%氯化钠溶液后充分匀浆;再混入等量完全弗氏佐剂,用注射器抽打成油包水乳剂。将新鲜制成乳剂皮下注射于SD大鼠四肢足垫(0.4ml/只),即刻以及48h后分别腹腔注射一次百日咳毒素(1ml/次)。以EAE造模日计为第0天。而空白对照组仅注射0.9%氯化钠溶液。
1.2.2 沙利度胺给药 沙利度胺经二甲基亚砜溶解后用0.9%氯化钠溶液稀释,终溶液二甲基亚砜浓度为2%,沙利度胺浓度为90mg/ml。药物组大鼠从第0天开始腹腔注射给药,连续15d,1次/d,每次剂量按60mg/kg计。空白对照组、模型组仅腹腔注射不含沙利度胺的溶剂。
1.2.3 髓鞘及轴突特殊病理染色 第20天将SD大鼠经10%水合氯醛麻醉,利用0.9%氯化钠溶液左心室灌注处死。脊髓组织用40g/L多聚甲醛中固定。经脱水、透明、浸蜡制成蜡块,切片用于后续染色。LFB染色:石蜡切片,脱蜡至水;LFB染液60℃水浴预热30min,切片浸染3~4h;切片冷却10~15min,自来水洗;切片,70%乙醇、碳酸锂溶液中交替分化,光镜下控制分化程度,自来水洗;脱水、封片。甘氨酸银染色:石蜡切片,脱蜡至水;切片在酸性甲醛浸泡5min,蒸馏水洗3次;37℃预热的甘氨酸银液浸泡3~5min;甩掉甘氨酸银液,放入还原液Ⅰ数秒;切片,放入还原液Ⅱ数秒,蒸馏水洗;5%硫代硫酸钠处理,蒸馏水洗3次;脱水、封片。在光学显微镜下观察组织病理变化。
1.2.4 免疫组化染色 组织切片经烤片、脱蜡、水化后,在0.01M柠檬酸缓冲液中高压锅加热进行抗原修复,PBS 洗涤 3 次;滴加 CD4(1∶400)或 GFAP 一抗(1∶300),4℃过夜,PBS 洗涤 3 次;滴加 m-IgGκBP-HRP(1∶100)孵育120min,PBS洗涤3次;滴加DAB工作液,光镜下控制显色时间,去离子水洗涤,梯度乙醇脱水,二甲苯透明,中性树胶封片。用PBS代替一抗作为阴性对照。每张切片随机取3个高倍视野(400倍)观察阳性细胞形态、分布,并计算CD4+T细胞数量[8]。
1.2.5 流式细胞术检测外周血CD4+T细胞凋亡情况 第20天取尾静脉血0.5ml,经红细胞裂解液处理获得白细胞,细胞计数板计数,调整细胞浓度为2×107/ml;用移液器分别吸取1μl CD3、1.25μl CD4荧光标记抗体于EP管,冰上孵育30min;每管加入2ml染色缓冲液洗涤 2次;移取 5μl Annexin Ⅴ和 10μl PI;室温孵育 5min,立刻(BD FACSAria)检测外周血CD4+T细胞凋亡情况。
1.3 统计学处理 应用SPSS 14.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用Dunnet-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 EAE发病期髓鞘及轴突损伤比较 LFB染色:空白对照组脊髓组织未见明显髓鞘脱失,而模型组、药物组均有髓鞘片状脱失。其中药物组髓鞘脱失多为局部小片状,很少有大片髓鞘脱失,而模型组以大片髓鞘脱失多见。甘氨酸银染色:空白对照组轴突被染成黑色,分布均匀,未见局部丢失;模型组、药物组均可见轴突丢失,其中模型组轴突密度低于药物组,见图1。
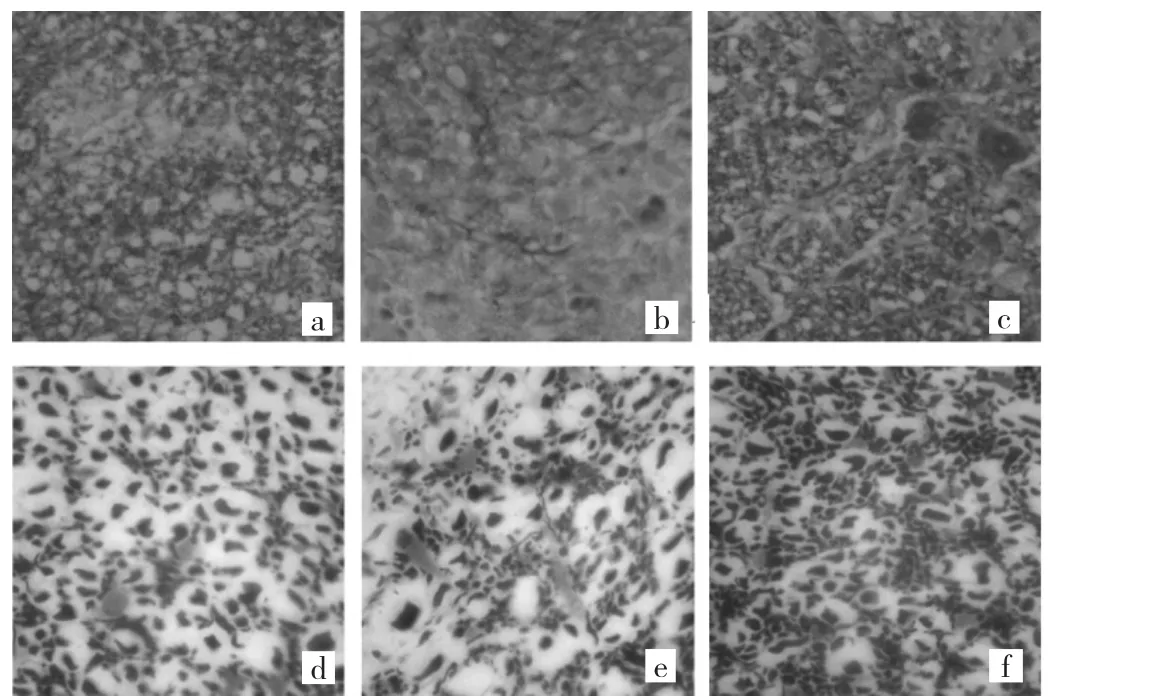
图1 EAE发病期髓鞘及轴突损伤比较(a:药物组,LFB染色,×400;b:模型组,LFB 染色,×400;c:空白对照组,LFB 染色,×400;d:药物组,甘氨酸银染色,×1000;e:模型组,甘氨酸银染色,×1000;f:空白对照组,甘氨酸银染色,×1 000)
2.2 EAE发病期星形胶质细胞增生比较 与空白对照组比较,模型组、药物组星形胶质细胞均有增生,其中药物组星形胶质细胞增生反应较模型组轻,细胞体积也相对较小,见图2。

图2 EAE发病期星形胶质细胞增生比较(a:药物组;b:模型组;c:空白对照组;×400)
2.3 EAE发病期外周血T细胞及凋亡CD4+T细胞比例的比较 与模型组比较,药物组CD4+T细胞比例明显降低,凋亡CD4+T细胞比例明显增高,差异均有统计学意义(均P<0.05);而CD3+T细胞比例差异无统计学意义(P>0.05),见表1。
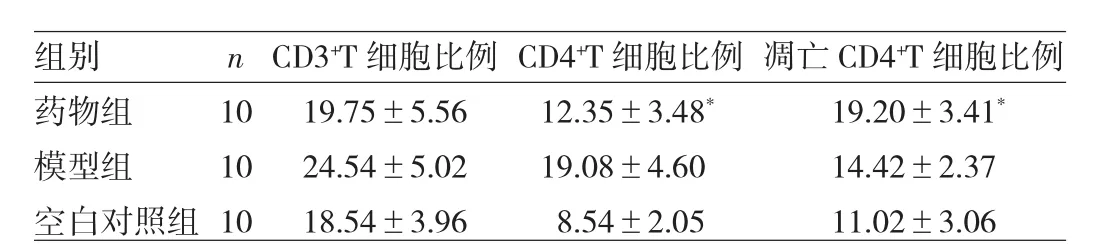
表1 EAE发病期外周血T细胞及凋亡CD4+T细胞比例的比较(%)
2.4 EAE发病期脊髓CD4+T细胞浸润程度比较 空白对照组未发现CD4+T细胞浸润,而药物组CD4+T细胞浸润较模型组明显减轻,见图3。进一步作半定量分析,药物组 CD4+T 细胞数为(179.1±55.23)个/mm2,明显少于模型组的(259.8±61.55)个/mm2,差异有统计学意义(P<0.05)。
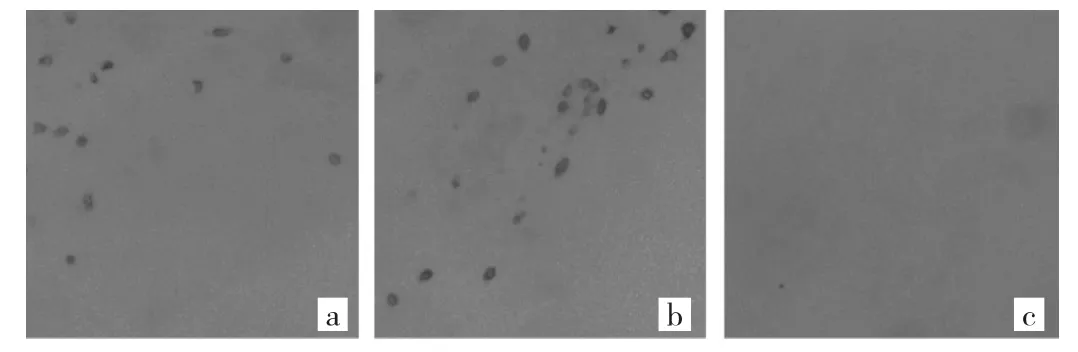
图3 EAE发病期脊髓CD4+T细胞浸润程度比较(a:药物组;b:模型组;c:空白对照组;×400)
3 讨论
一般认为,脱髓鞘疾病在炎症后可通过少突胶质细胞再生进行修复,神经功能可能达到基本恢复。若多发性硬化病情较重或反复发病,多数会遗留明显的神经缺损症状,造成较重的疾病负担[9]。神经功能的永久性缺损与轴突的不可逆损伤有关[10]。
本研究发现沙利度胺治疗EAE大鼠,不仅能减轻中枢髓鞘的脱失,还能减少轴突的丢失,表明沙利度胺具有潜在改善疾病预后的作用。星形胶质细胞是中枢内重要的免疫调控细胞,对于维持中枢免疫平衡、营养神经元具有重要意义[11-12]。本研究发现,沙利度胺可以抑制中枢炎症过程中星形胶质细胞的增生,减轻炎症反应。而星形胶质细胞的炎性增生反应是EAE发病严重程度的生物标志物。另一方面,本研究也提示沙利度胺可能通过调控星形胶质细胞最终减轻髓鞘及轴突损伤,从而抑制EAE发病。在发病过程中,外周CD4+T细胞可由软脑膜侵袭至中枢组织,从而引起炎症反应[13-14]。本研究发现沙利度胺可抑制发病高峰期过度增生的外周CD4+T细胞。此外,流式细胞术检测结果发现沙利度胺可促进外周CD4+T细胞凋亡,降低外周CD4+T细胞比例。进一步作免疫组化染色证实,沙利度胺可抑制中枢CD4+T细胞浸润。可见,沙利度胺可能通过促进外周CD4+T细胞凋亡,从而抑制细胞向中枢浸润,最终减少髓鞘脱失及轴突损伤。
但是,关于确切的凋亡调控机制尚不明确。目前认为沙利度胺可以抑制肿瘤血管的增生,具有调控血管再生的功能[15]。而多发性硬化、EAE发病过程中存在血管炎症反应,既有血管内皮的损伤、血脑屏障的破坏,又有炎性血管增生的存在[16-17]。沙利度胺可能通过调控血管内皮细胞生物反应,从而影响外周CD4+T细胞向中枢浸润。关于沙利度胺对血脑屏障的调控作用有待进一步研究明确。
综上所述,沙利度胺可减轻EAE大鼠发病过程中髓鞘脱失及轴突损伤,抑制星形胶质细胞过度炎症反应,对于改善疾病预后具有一定作用。沙利度胺的免疫调控机制可能与促进外周CD4+T细胞凋亡、抑制细胞向中枢浸润有关。
