耳聋动物内耳基因治疗现状
2018-09-22戢小军陈伟杨仕明
戢小军 陈伟 杨仕明
解放军总医院耳鼻咽喉头颈外科 解放军耳鼻咽喉研究所 聋病教育部重点实验室(北京100853)
耳聋是最常见的致残性疾病之一,据WHO 2013年的数据显示[1],全世界范围内约有3.6亿人遭受听力损伤的困扰,其中感音神经性聋占大部分。伴随着生物科学的迅速发展,耳聋的基础研究及治疗也取得了长足的进步。半数语前聋是由于耳聋基因导致的,65岁以上老龄人当中有接近1/4的人群是与年龄相关的耳聋,并且影响生活质量。遗传性耳聋是新生儿常见的疾病,发病率大约1/1000,且80%是常染色体隐性遗传,20%为显性[2]。目前治疗耳聋的方法比如助听器、振动声桥及人工耳蜗等,刺激感音毛细胞和螺旋神经节,弥补听力损失,然而,这些助听装置在频率敏感性、言语分辨及噪声环境下还有许多缺陷。因此,内耳的基因治疗有望成为遗传性耳聋的理想治疗方法。本文从耳聋动物模型的选择、基因载体的选择、基因治疗的路径及效果进行阐述。
1 耳聋动物模型
在动物模型的研究方面,有学者采用小鼠作为耳聋模型,Long Ma[3]成功的利用呋塞米和卡那霉素制造了药物性耳聋的小鼠模型。但是人和小鼠的巨大差异导致无法作为基因疗法研发的动物平台,小鼠模型的诸多缺点也制约了基因疗法向人类临床发展,首先鼠和人的进化关系远,这是造成多方面生物学差异的基础;其次小鼠在物质、能量代谢等基础生理特征与人差异太大,不能较好的模拟人的许多疾病;另外小鼠的听觉形成于出生后第二周,而人类的听觉则在妊娠晚期就已经发育成熟。这种发育规律上的差异导致小鼠模型无法有效的再现那些在个体发育早期就已经出现的听力缺陷症状,从而也无法作为基因疗法研发的动物平台。因此在基因疗法临床应用之前亟需在与人类相似性更高的大动物模型上开展临床前动物实验[4]。本课题组前期研究发现,小型猪与人的基因同源性高,各脏器即组织的大小结构和生理学方面也极其相似,猪耳蜗与人更为接近,长度为39.47mm,转数为3圈半,较人类耳蜗多出一圈。在猪的内耳基底膜上具有三排外毛细胞与一排内毛细胞,而且毛细胞的形态与人类也高度相似[5]。于此同时猪的听觉电生理特征也与人类相近,其听力阈值为35-45dB SPL[6],而人类约为30dB SPL。猪的听觉频率范围为42 Hz到40.5 kHz,最佳听觉敏感范围为250 Hz到16 kHz,与人类一致[7];猪的内淋巴电位约为77.3 mV[6],推测与正常人类一致。另外,猪的中耳腔形态和咽淋巴组织结构均与人类高度一致,非常适合作为中耳炎模型[8]。猪耳蜗骨壁的厚度、强度与人更为接近[9]同时具有经济学和伦理学等方面的优势,因此作为耳科动物模型有很好的应用前景[10]。本课题组在我国重庆发现荣昌猪是双侧重度感音神经性聋,与Waardenburg综合征2A型的特点类似,对该疾病的机制和治疗的研究提供了天然的模型[11],对研究WaarDenburg综合征的发病机制有着重要的意义。
2 基因载体的选择
尽管已经有许多通过基因操作成功恢复听功能的报道,基因治疗仍还无法从基础研究转化为临床应用。主要的困难之一是缺乏基因递送技术,在安全有效地进行内耳细胞靶向递送的同时,可以实现外源基因导入活体内耳后的持续作用。基因递送技术的重要技术环节包括内耳导入途径和基因载体[12]。在基因载体方面,目前常用的有非病毒载体如脂质体,病毒载体如慢病毒载体、腺病毒载体、腺相关病毒载体(Adeno-associated virus,AAV)等。在此主要讨论病毒载体,AAV为其安全性,转染效率高而获得广泛应用。Eric Zinn[13]报道了一种新型的合成AAV载体,Anc80基因载体,对肝、肌肉和视网膜组织均有特异性,高转染效率在基因治疗上将被广泛应用。Zheng-Yi Chen等报道通过耳蜗底转开窗导入不同血清型的AAV及腺病毒(adenovirus,Ad),导入后两周时间可见内毛细胞大量表达绿色荧光蛋白,不同血清型AAV其外毛细胞表达量不一样,其中AAV2/Anc80L65转染大多数内毛细胞和外毛细胞,AAV2转染大多数内毛细胞和一部分外毛细胞,AAV8转染大部分内毛细胞,外毛细胞表达较弱。AAV9只局限于表达在内毛细胞。AAV不仅转染毛细胞,还转染Deiter’s细胞(DC)、Hensen细胞和Claudius细胞。Ad5不仅不能转染内毛细胞,而且还杀死大部分外毛细胞,进而导致听力下降[14],因此AAV是内耳基因转染的理想病毒载体。Lauren A.Kilpatrick等阐述了AAV载体是内耳基因治疗的理想载体,并且AAV多种血清型(1,2,5,6,8)均有较高效的表达,血清型8转导效率较高,CMV作为启动子,指出通过圆窗膜注射导入基因载体能够很好的保护小鼠的低频和中频听力,携带绿色荧光蛋白(green fluorescent protein,GFP)载体在小鼠内耳毛细胞、支持细胞及螺旋韧带均有荧光表达,其中内毛细胞表达效率最高。作者指出此模型为今后内淋巴的药物注射治疗内耳疾病提供理想的途径[15]。
3 耳聋的生物治疗
3.1 干细胞治疗
由于内耳毛细胞和螺旋神经元(spiral ganglion neurons,SGNs)的损伤是导致感音神经性聋的主要因素之一,近年来,人们利用骨髓来源的间充质干细胞进行细胞治疗和基因治疗进行了不断的探索,骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)由于高扩增潜能,遗传稳定,易于分离、培养和扩增,低免疫源性和免疫调节功能,在将来的临床应用中具有潜在优势。将BMSCs移植入内耳恰恰可以弥补哺乳动物内耳受损毛细胞以及SGNs的不可再生[16]。尹晓玲[17]报道将干细胞移植与人工耳蜗植入相结合,以实现SGNs损伤修复从而提高人工耳蜗植入的效能。在干细胞植入内耳的方式上,有经中阶植入,经鼓阶植入和经蜗轴螺旋管植入,其采用的是经鼓阶植入,对耳蜗的损伤较小。
3.2 基因治疗
在耳聋基因治疗体内研究方面,耳蜗中阶、圆窗、卵圆窗是内耳基因治疗的传统手术径路。耳蜗管里充满着外淋巴液,耳蜗中阶有内淋巴液,我们可以通过圆窗膜或者卵圆窗路径到达鼓阶和前庭阶。由于圆窗膜路径在许多动物模型当中是可接受的,而且是内耳唯一的非骨性开口,目前广泛采用病毒载体从圆窗膜导入。Xunbei Shi[18]报道了AAV1携带GFP基因载体导入小型猪的内耳中,通过圆窗膜导入路径在小型猪的内毛细胞中可见高表达,2周时可见GFP表达,3周时表达达到峰值,同时在Hensen细胞、内柱细胞、外柱细胞、螺旋缘及螺旋韧带有表达,外毛细胞未见表达,但是由于猪是大动物模型,其转染率结果低于小鼠。Jeffrey指出Tmc基因治疗能够恢复小鼠听觉功能,小鼠Tmc1(transmembrane channel-like 1)点突变导致Beethoven耳聋,是人DFNB7/11和DFNA36突变很好的动物模型,通过圆窗膜导入外源的AAV2/1-cba-Tmc1/2基因到鼓阶,能够修复Tmc1点突变,恢复小鼠听觉功能[19]。Omar Akil[20]使用AAV-1病毒载体通过圆窗膜导入治疗VGLUT3敲除的耳聋小鼠,在不损伤内耳及中耳重要结构的条件下最大限度的保留了听力。在基因治疗上,Bifeng Pan构建了一个Usher综合症敲除模型小鼠,采用Anc80L65合成AAV载体将野生型Ush1c转导入小鼠内耳中,转导率达到了80-90%,同时恢复了基因和蛋白的表达,修复了感音毛细胞功能,基本恢复了复杂的听觉和平衡感治愈内耳功能。为将来基因治疗内耳疾病提供较好的治疗方法[21]。
4 基因导入手术路径的选择
4.1 圆窗膜导入手术路径
耳蜗作为基因治疗的理想的靶器官,有一些优点,其一,体积小,因此导入的病毒剂量是有限的;还有耳蜗由于有蜗壳与其他组织器官相对隔绝,对其他组织的副作用少;最后耳蜗内有淋巴液填充,有利于病毒在迷路内转导[20]。目前研究较多的是治疗基因导入耳蜗可提高由老龄、基因或环境因素导致的听力损伤,这种方法可以安全有效的把治疗基因导入耳蜗Corti器的毛细胞中。基因治疗导入毛细胞可以通过直接注射到耳蜗管中,然而,这能改变蜗管内高钾环境,破坏耳蜗内电位,导致耳蜗毛细胞的损伤及不可逆的听力损失。Wade W.Chien[22]报道经圆窗膜穿刺转染病毒后,术后一部分小鼠可见中耳积液,导致术后的听力下降,因此,圆窗膜手术方式术后也有一定的并发症。近年来利用经典的病毒和热门的CRISPR/Cas9,通过基因替代、基因沉默、基因编辑等方法在内耳基因治疗上均取得一定进展。Wade W.Chien[23]指出TMC1(the protein transmembrane channel-like 1)基因突变引起常染色体显性和隐性听力损失。Beethoven鼠是TMC1突变的动物模型,Gao[24]采用CRIPR-Cas9基因编辑工具来敲除Beethoven鼠的突变位点,达到恢复听力的目的。其使用的基因载体是阳离子脂质体,其与Cas9复合体结合体内导入Beethoven小鼠模型当中,基因载体也是导入鼓阶当中。
在基因导入路径上,大部分选择圆窗膜导入内耳基因治疗,且得到了很高的转染效率即治疗效果,Lukas D Landegger报道了一种合成的AAV(Anc80L65)能够有效的将目的基因转导到哺乳动物的内耳当中,通过圆窗膜注射将Anc80L65导入后检测到内毛细胞和外毛细胞中均有高表达,并且小鼠的听力及平衡功能无明显变化,为将来耳聋和眩晕前庭疾病提供可靠的基因治疗[25]。Xia L[26]等比较两种导入途径转染耳蜗毛细胞,第一种是完整圆窗膜注射导入AAV病毒载体,另一种是通过酶消化技术将病毒载体跨过圆窗膜渗透进入,其比较了两种方法转染毛细胞的效率,圆窗膜穿刺术内毛细胞转染率是58%,外毛细胞是19%,圆窗膜酶消化渗透术内毛细胞为47%,外毛细胞为17%,两组差别无明显统计学意义,值得一提的是,胶原酶消化圆窗膜当浓度达到90mg/ml,圆窗膜穿孔,其ABR阈值升高。
4.2 半规管及前庭开窗导入手术路径
除了圆窗膜路径,另一部分学者通过半规管及前庭开窗方式导入病毒载体,龚树生等通过给新生小鼠的后半规管开窗技术导入AAV8-GFP载体,术后检测术耳和非手术耳ABR发现双耳听力无明显差异,并且术侧耳蜗内毛细胞、边缘细胞、前庭毛细胞和前庭支持细胞有较高的GFP表达。在没有损伤小鼠听力和前庭功能的情况下使外源基因在小鼠耳蜗内得到表达,提供了耳蜗前庭疾病基因治疗的可行方法[27]。Wade W.Chien[28]采用后半规管开窗术将AA8-whirlin基因导入新生小鼠内耳中,术后可见椭圆囊毛细胞和耳蜗内毛细胞均可见表达,其转染率分别为53.1%和77.1%。Whirler耳聋小鼠作为人Usher综合征的动物模型,Kevin Isgrig[29]使用AAV8-whirlin导入到小鼠后半规管中,前庭和耳蜗表达whirlin毛细胞数增加,不仅提高了听力,还恢复了平衡功能,治疗效果长达4个月。在研究小鼠的解剖结构和基因治疗方面,Davina Gassner[30]也使用了携带GFP的Ad载体行后半规管导入,术前术后的听力无统计学差异,2天后可观察到耳蜗支持细胞、内毛和外毛细胞可见GFP的表达。可见小鼠动物模型中后半规管手术路径是一个可以值得探讨的方法,既可以得到耳蜗毛细胞的高转染率,又保存了听力,较传统的圆窗膜手术路径有了更大的改进。
Kohei Kawamoto[31]也是用小鼠作为耳聋基因治疗模型,腺病毒作为载体,携带细菌基因lacZ,用两种手术路径导入,其一是后半规管开窗术(canalostomy),另一种是耳蜗底转开窗导入(cochleostomy),两种手术路径均能使lacZ基因表达在外淋巴腔隙的细胞中。后半规管开窗术壶腹嵴的毛细胞中可见基因表达,而耳蜗底转开窗导入表达在Corti器和球囊毛细胞中。同时,该研究还发现后半规管入路能够保存听力而耳蜗底转开窗入路不能,但后半规管导入路径中前庭功能有短暂的减低,但两周后恢复。该研究提示后半规管手术方式是一种既可以保存听力,又能有效的将目的基因导入前庭和耳蜗的有效路径。对动物手术来说,相对于耳蜗底转开窗,半规管容易暴露,对神经和血管损伤较小,听力也能较好的保护。但是手术过程中携带病毒载体的导丝不确定进入膜迷路内淋巴或者是外淋巴腔隙中,同时由于半规管容积较小,导入的病毒及内耳淋巴液容易渗漏。另外,在手术路径比较方面,Hiroko Okada[32]同时采用了半规管开窗和圆窗膜入路的手术,导入携带GFP的Ad载体和AAV载体,观察两种手术方式在毛细胞和前庭中的表达情况及听力的变化。Jun Suzuk[33]研究了Anc80病毒载体通过后半规管路径导入,成功的实现了全部内毛细胞和大部分外毛细胞的表达,指出Anc80载体和这种手术路径是非常有效的耳蜗和前庭基因治疗的方法。实验结果证明,半规管开窗手术方式在没有损伤听力和前庭功能的情况下,在耳蜗毛细胞、支持细胞和前庭的纤维细胞中均可见表达,提示在听觉及平衡功能不受损伤的条件下,这或许是最合适的基因导入路径,对于将来用于人类耳聋基因治疗有更好的前景。
4.3 联合手术入路导入及其他手术路径
除了后半规管开窗术,还有通过上半规管导入病毒载体研究基因表达。Mark Praetorius[34]报道用Ad载体携带GFP(绿色荧光蛋白)分别耳蜗底转开窗和上半规管开窗导入,耳蜗底转开窗导致20kHz的高频听力下降,低剂量的Ad载体圆窗膜导入可不损伤听力,而剂量增加后可出现10dB的听力减退,上半规管入路导入没有导致任何的听力损伤。另外,Yamasoba T[35]报道通过内淋巴囊导入腺病毒载体,可见前庭、耳蜗和壶腹毛细胞的表达,但未提及听力的情况。
不仅如此,Hidekane Yoshimura[36]研究联合治疗,即同时行圆窗膜注射导入载体和半规管开窗术,AAV2/9(3.90×1013vg/ml)内毛细胞的转染效率,顶转89.7%,中转92.2%,底转为98.1%。既达到了较高的转染效率又很好的保护了听力。因此,综上所述,在内耳基因治疗手术路径上,包括耳蜗底转开窗、圆窗膜导入、半规管导入和内淋巴囊路径,以及综合手术路径的方法,既有外源基因的内耳表达,又保护了听力。
在手术路径的选择上,多数时候需要考虑靶细胞的种类。例如,KCNQ1和KCNE1突变引起的Jervell和Lange-Nielsen综合征(伴有感音神经性耳聋和心脏畸形)就需要导入内淋巴中。如需要在螺旋神经元上有表达,就要导入外淋巴中[37]。
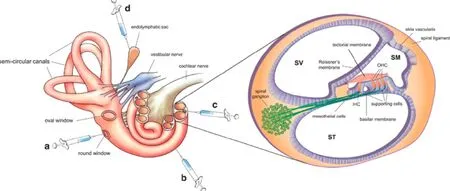
图1 耳蜗基因治疗导入途径示意图。a:圆窗膜注射,b:耳蜗侧壁鼓阶注射,c:耳蜗侧壁中阶注射,d:淋巴囊注射Fig.1 Gene therapy delivery routes a:Round window membrane,b:Cochleostomy(scala tympani),c:Cochleostomy(scala media),d:Endolymphatic sac
总之,通过构建缺陷基因载体以及比较不同的手术入路导入路径,获得高效、安全、控释和靶向特异的外源分子内耳递送技术,既获得了很好的治疗效果又保存了听力和内耳的感音结构。基因治疗有着广泛的应用前景,但目前绝大部分还局限于动物模型当中,还有许多的障碍去克服,但有理由相信,不管是在手术路径和基因位点选择上,感音神经性耳聋和遗传性耳聋的内耳基因治疗的临床应用将会得到迅速的发展。
