四环素耐药粪肠球菌生物膜的分析
2018-09-07魏影郭妍柏柳陈艳丽黄嵘赫余治健邓启文李桂秋
魏影 郭妍 柏柳 陈艳丽 黄嵘赫 余治健 邓启文 李桂秋
作者单位:1 黑龙江省医疗服务管理评价中心考核准入科,黑龙江 哈尔滨 150081;2 深圳市南山区人民医院中心实验室,广东深圳 518052
粪肠球菌感染大多数为内源性感染,能通过机体肠上皮细胞而易位,接着感染淋巴结,然后再扩散到机体的其他细胞组织,在医院内可引起人体多系统感染:泌尿系感染、皮肤软组织感染、呼吸道感染等,还能引起危及生命的心内膜炎、腹腔感染、败血症等[1-4]。生物膜形成是粪肠球菌的重要特点。近年研究表明四环素耐药粪肠球菌已经成为较高的比例,文献报道我国粪肠球菌四环素耐药率波动60%左右。细菌对四环素产生耐药主要是获得了四环素耐药基因,并且这些基因常与可移动成分如可传递性质粒、转座子、接合转座子和整合子接合导致其在菌群间广泛传播。然而四环素耐药粪肠球菌的耐药基因特点和生物膜形成之间关系鲜见报道。多个毒性因素与粪肠球菌生物膜的形成有关,粪肠肠球菌的毒力因子有聚类物质、表面蛋白、细胞溶解素、明胶酶E、透明质酸酶、信息素诱导蛋白、胶原结合蛋白、心内膜炎抗原及信息素等。四环素耐药粪肠球菌中这些毒力因子的分布尚不清楚。因此,本实验主要探讨四环素耐药粪肠球菌生物膜形成特点及与毒力基因、耐药基因分布之间的关系,分析该类细菌生物膜形成特点。
1 材料和方法
1.1 材料
251株自深圳市南山医院2010年1月—2017年6月分离自患者标本的粪肠球菌,质控菌株是粪肠球菌菌株ATCC29212和OG1RF (ATCC47077)。
1.2 方法
1.2.1 菌株鉴定和药敏试验 采用BD Phoenix-100全自动细菌鉴定/药敏系统进行药敏试验,主要药物包括氨苄西林和万古霉素。采用2017年版美国临床和实验标准化协会(CLSI)推荐的微量肉汤稀释法再次确认四环素药敏结果,以粪肠球菌ATCC29212作为质控菌株。四环素敏感、中介和耐药判断标准为MIC≤4 mg/L、MIC=8 mg/L和MIC≥16 mg/L。
1.2.2 毒力基因的检测 毒力基因esp、gelE、Asa1、cylA、hyl引物由北京六合华大基因公司合成[5-6]。按试剂盒说明提取菌株基因组DNA,-20℃保存备用。采用PCR检测毒力基因。PCR体系(50 μl):Dream Taq Green PCR Master Mix(2×) 25 μl,上、下游引物各 1 μl,DNA2 μl, 加 dd H2O 补至 50 μl。PCR 反应条件:95℃预变性3 min;95℃变性30 s,52℃退火30 s,72℃延伸1 min,共30个循环;72℃ 10 min,PCR产物于4℃保存。PCR反应产物均用1%的琼脂糖凝胶电泳,根据有无阳性扩增产物及目的基因片段长度进行判断分析。
1.2.3 生物膜检测及判读 根据参考方法,对生物膜的形成进行了检测。对在TSB培养基中过夜生长的细菌;稀释200与TSBG培养基中,其中有0.5%的葡萄糖;每孔200 μl加样到96孔聚苯乙烯微板上,每个菌株3个复孔;37℃的情况下静态孵化24小时;吸干孔子菌液并用PBS清洗3次,用甲醇固定15分钟后吸干,用0.5%的结晶紫染色10分钟后吸干,再用蒸馏水冲洗;最后加入4∶ 1无水乙醇和丙酮的汇合溶液,混合均匀后在OD570光度下检测。每一项试验至少进行3次。生物膜OD值的判读在染色后的96个微孔读数从0.05~3.50。生物膜表型分类基于他人的方法,强阳性(OD 570>2),中等(OD 570,1~2),或弱(OD 570>0.5和OD 570<1)。
1.3 统计学分析方法
采用Execl表格建立数据库,统计入组菌株各项指标结果,采用SPSS 19.0统计软件进行统计学分析。用t检验进行连续性变量的单因素分析,采用χ2检验或Fisher’s确切概率法分析分裂变量。所有检验都是双侧的,当P<0.05时,认为差异具有统计学意义。
2 结果
2.1 四环素耐药粪肠球菌生物膜的形成特点
在结晶紫染色后的96孔板读数从0.04~3.50。生物膜表型分类基于他人的方法分为(OD570>2),中等(OD570,1~2),或弱(OD570>0.5和<1.0)[7-9]。OG1RF控制菌株(弱生物膜)和ATCC29212菌株OD570的中值分别为0.95和0.22。在所有被检测的粪肠球菌分离菌株中,有超过一半的粪肠生物膜表现为弱阳性及以上,在这些生物膜形成的菌株中,弱生物膜表型、中等生物膜表型和强生物膜表型中菌株数相差不大。利用肉汤稀释法测定了四环素的MIC值,并对MIC16 μg/ml的抗性标准进行了分类,发现199株含有四环素抗性的菌株,没有万古霉素耐药株。四环素敏感、中介和耐药的粪肠球菌生物膜形成的流行率为50.0%(17/34)、55.6%(10/18)和59.3%(118/199),见表1。生物膜的形成比率有逐步升高的趋势,值得注意的是强生物形成比例在四环素耐药和中介菌株中高于四环素敏感组(19.6% vs.16.7%vs.8.8%),中介组和耐药组强生物膜形成比例差别没有统计学意义。这些粪肠球菌没有氨苄西林和万古霉素耐药株。
2.2 四环素耐药粪肠球菌生物膜形成与四环素耐药基因之间的联系
PCR检测结果提示四环素耐药粪肠球菌的耐药基因tetM和tetL阳性检出率分别为87.9%(175/199)和25.6%(51/199);没有检测到一株tetS基因阳性株,tetM和tetL耐药基因与生物膜形成之间关系仍有待进一步研究。tetM和tetL基因与生物膜形成经统计学分析无相关性(P>0.05),见表2。
2.3 生物膜形成与毒力基因间的相关性
199株粪肠球菌四环素耐药的菌株,对PCR扩增毒性基因的分析表明,esp、asal和cylA阳性粪肠球菌分离菌株比其相对应的阴性分离株的生物膜形成率提高,其与生物膜形成经统计学分析有相关性(P<0.05);而hyl基因与其结果正好相反,但其与生物膜形成经统计学分析也有相关性(P<0.05);此外,生物膜的形成与gelE毒力基因无相关性(P>0.05)(见表3)。
3 结论
本研究结果提示四环素耐药粪肠球菌的生物膜阳性率(59.3%)与四环素中介组和四环素敏感组差异没有统计学意义,可能与四环素敏感菌株组合中间组入组例数太少有关,四环素不耐药组的粪肠球菌生物膜形成比例有待进一步研究。总体而言,四环素耐药粪肠球菌生物膜阳性与粪肠球菌整体阳性率相比并没有偏高,但是四环素耐药组和中介组中强阳性的菌株比例高于敏感组是需要引起注意。粪肠球菌生物膜形成和抗生素耐药关系的研究报道较多。本研究四环素耐药组中无万古霉素和氨苄西林耐药株,因此对于四环素耐药菌株中这些多重耐药菌株的生物膜特点仍有待进一步研究。四环素耐药基因的检测中发现,粪肠球菌主要携带tetM基因,tetM、tetL和tetS基因与生物膜的形成没有相关性。我们的整体结果提示在四环素耐药粪肠球菌中抗生素的敏感性与生物膜的形成无相关性,四环素耐药基因tetM、tetL和tetS与生物膜形成无相关性。

表1 生物膜形成能力和四环素敏感性之间的关系(n,%)
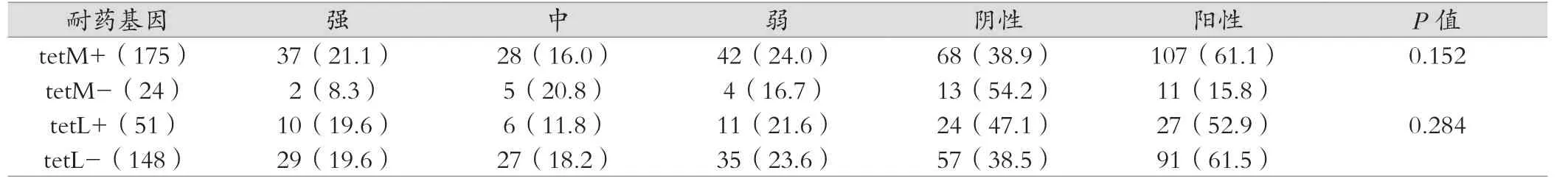
表2 四环素耐药基因和生物膜形成之间的关系(n,%)
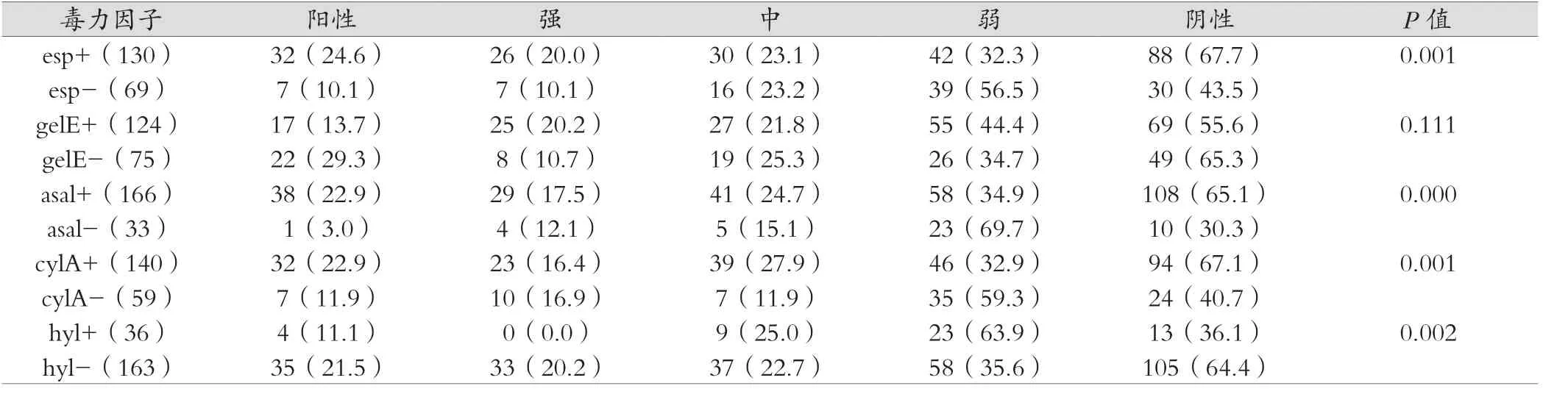
表3 四环素耐药粪肠球菌中生物膜形成能力与毒力基因之间关系
本研究发现四环素耐药粪肠球菌中esp+分离株更有可能表现出强或中等的生物膜形成,这与之前的几项研究一致,这些研究表明该毒力基因和粪肠球菌生物膜形成之间联系[5-6,10-13]。本研究提示gelE基因与粪肠球菌强阳性生物膜形成成反比;这与先前的研究结果中gelE可能有利于粪肠球菌生物膜的发展不一样,但也有另一些研究则发现,在粪肠球菌中,gelE的存在与生物膜的形成没有相关性[3]。此为本实验中还发现四环素耐药粪肠球菌中asal 、hyl和cylA与粪肠球菌生物膜的形成有相关性;此前有报道称,cylA与尿道分离的粪肠球菌生物膜形成有关[4]。因此四环素耐药粪肠球菌中esp、asal、hyl和cylA等毒力基因与生物膜形成密切相关。
总之,目前的研究表明四环素耐药粪肠球菌容易形成生物膜,生物膜形成阳性率与四环素中介菌株比较无差别。四环素耐药粪肠球菌中抗生素的敏感性与生物膜的形成无相关性,四环素耐药粪肠球菌生物膜形成能力与四环素耐药基因tetM、tetL和tetS基因无相关性。esp、asal、hyl和cylA与四环素耐药粪肠球菌生物膜形成显著性相关。
