芍药苷对糖尿病小鼠肾组织中TLR2信号通路的调节作用
2018-09-05段分分杨雯雯邵云侠吴永贵
段分分,杨雯雯,邵云侠,王 坤,吴永贵
作为糖尿病患者临床常见的一种微血管并发症,糖尿病肾病(diabetic nephropathy,DN)已受到学者的广泛关注。研究[1-2]表明巨噬细胞活化介导的肾内炎症在DN发生发展中起重要作用。Toll样受体(Toll-like receptors,TLR)是模式识别受体,负责启动炎症反应和免疫应答,研究[3]显示其家族成员 Toll受体 2 (Toll-like receptor 2,TLR2)参与了DN持续炎症反应,加重DN肾组织损伤。因此,探讨干扰或阻断TLR2信号传导通路的药物,有助于防治DN的发展。芍药苷(paeoniflorin, PF)是白芍总苷(total glucosides of paeony,TGP)的主要生物活性成分,研究[4]显示PF可抑制糖尿病大鼠肾组织炎症反应,减轻肾脏损害。该研究拟探讨PF对DN发挥肾脏保护作用的机制与TLR2信号通路相关,为DN的进一步诊治提供新思路。
1 材料与方法
1.1实验动物健康雄性8~10周龄C57BL/6J同窝野生型小鼠60只,18~20 g,TLR2-/-小鼠24只,均购自南京大学动物模式中心。进入安徽医科大学SPF级动物房前检疫1周,合格后进入饲养室。饲养室12 h交替照明、温度(22±2)℃,相对湿度(55±5)%。
1.2药品与主要试剂PF (南京广润生物制品公司);链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);糖原染液D004(南京建成生物工程研究所);通用二步法试剂盒PV-9000、DAB辣根过氧化物酶显色试剂盒(北京中杉金桥公司);Reverse Transcription System A3500(美国 Promega公司);兔抗CD68、TLR2、髓样分化因子88(myeloid differentiation primary response gene 88,MyD88)、诱生型一氧化氮合酶(inducible nitric oxidesynthase,iNOS)抗体(美国Abcam公司);兔抗磷酸化核因子κB p65(phospho-nuclear factor kappa B p65,NF-κB p-p65)、核因子κB p65(nuclear factor kappa B p65,NF-κB p65)抗体(美国Cell Signaling公司);兔抗磷酸化白介素受体相关激酶-1(phospho-IL-1 receptor-associated kinase-1,p-IRAK-1)抗体(美国Santa Cruz公司);鼠抗β-actin、HRP羊抗鼠IgG、HRP羊抗兔IgG抗体(武汉三鹰公司);ECL试剂盒、TRIzol Reagent(美国Thermo Scientific公司);BCA试剂盒(上海碧云天公司)。
1.3方法
1.3.1动物模型建立及分组 C57BL/6J及TLR2-/-小鼠连续5 d腹腔注射STZ 50 mg/kg,一周后使用血糖仪测小鼠尾静脉的随机血糖,以血糖大于16.7 mmol/L者作为糖尿病模型,同时对照组给予同等剂量的枸橼酸溶液。
动物分组:C57BL/6J对照组(Control);模型组(DM);PF干预低剂量组[STZ+PF 25 mg/(kg·d)];PF干预中剂量组[STZ+PF 50 mg/(kg·d)];PF干预高剂量组[STZ+PF 100 mg/(kg·d)];TLR2-/-对照组(TLR2-/-);TLR2-/-模型组(TLR2-/-+STZ)。每组各12只。PF采取腹腔注射,每天一次至12周。其余组给予同等剂量的生理盐水。
1.3.2实验标本收集 小鼠标准喂养,实验12周末将各组小鼠取出后置于代谢笼中,收集24 h的尿液,留作24 h尿白蛋白排泄率(urinary albumin excretion rate,UAER)测定。麻醉后称体重并记录,眼球取血,分离血清,用于测定血糖。取肾后去肾包膜及肾周脂肪,称重并记录肾重,一侧肾脏放至冻存管中,置于液氮,留作后续Western blot及RT-PCR检测。另侧肾脏经4%多聚甲醛固定,石蜡包埋用于PAS染色及免疫组化检测。
1.3.3病理形态学观察 PAS染色光学显微镜下随机选取10个视野的肾小球和肾小管间质,进行肾小球系膜扩张指数和肾小管间质损伤指数评分。肾小球评分:正常肾小球为0,系膜基质增生面积<25%为1,25%~50%为2,51%~75%为3,>75%为4。肾小管间质损伤评分标准:正常肾小管间质为0,肾小管萎缩、扩张伴管型形成、间质炎性反应与纤维化面积<25%为1,25%~50%为2,>50%为3。肾小球系膜扩张指数和肾小管间质损伤指数评分即为切片组织评分的平均值。
1.3.4免疫组织化学 石蜡切片常规脱蜡处理,流水冲洗1 min,滴加3% H2O2阻断内源性过氧化物酶活性,切片置于枸橼酸钠溶液液中微波下行抗原修复,山羊血清封闭10 min以消除非特异染色,PBS洗涤后,分别滴加一抗CD68(1 ∶50)、TLR2(1 ∶250)、NF-κB p65(1 ∶600),同时滴加PBS溶液于阴性对照中,4 ℃封闭过夜,滴加PV9000试剂1室温孵育20 min,随后滴加PV9000试剂2室温孵育30 min,随后滴加DAB显色液。在显微镜下控制切片的着色时间,随后复染、脱水、透明、封片。光学显微镜下每组切片随机选取10个视野采集图片,使用图像分析软件Image-Pro Plus 6.0进行半定量分析,测定各组肾小球和肾小管间质中的CD68阳性细胞数目,以及TLR2、NF-κB p65的阳性面积百分比,统计比较各组的平均值。
1.3.5RT-PCR法检测各组肾组织的mRNA的表达 采用TRIzon法提取各组肾组织总的RNA,并检测RNA纯度,以RNA为模板反转录成 cDNA。RT-PCR采用SYBR Green法,GAPDH作为校正内参,用2-ΔΔCt法分析基因的相对表达。引物均由上海生工生物工程公司合成,引物包括肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、单核细胞趋化蛋白-1(monocyte chemoattractant protein 1,MCP-1)。引物序列见表1。

表1 各引物序列
1.3.6Western blot法检测各组肾组织蛋白的表达 将各组肾组织取出适量置于冰上裂解,提取总蛋白。取40 μg蛋白样品上样,经电泳、转膜、牛奶封闭,加一抗TLR2(1 ∶1 000)、MyD88(1 ∶250)、p-IRAK-1(1 ∶200)、IRF3(1 ∶1 000)、NF-κB p-p65(1 ∶1 000)、NF-κB p65(1 ∶1 000)、iNOS(1 ∶1 000)、β-actin(1 ∶35 000) ,4 ℃孵育过夜,加入相应二抗(1 ∶8 000),室温孵育45 min,ECL发光试剂盒显影、成像。用Image J软件对Western blot条带进行半定量分析。

2 结果
2.1各组小鼠一般指标变化12周末DM小鼠血糖、肾重/体重、UAER明显高于Control及TLR2-/-组小鼠(P<0.05,P<0.01);与DM组比较,STZ+PF[25、50、100 mg/(kg·d)]及TLR2-/-+STZ组小鼠血糖差异无统计学意义(P>0.05),但STZ+PF[25、50、100 mg/(kg·d)]及TLR2-/-+STZ组小鼠体重/肾重、UAER 水平明显减低(P<0.05,P<0.01)。见表2。
2.2肾组织病理学改变光镜下观察显示,与Control组小鼠比较,TLR2-/-组小鼠PAS染色差异无统计学意义,DM组系膜扩张指数及肾小管间质损伤指数评分明显高于Control组(P<0.01);与DM组比较,STZ+PF[25、50、100 mg/(kg·d)]及TLR2-/-+STZ组小鼠肾组织病理改变明显减轻,系膜扩张指数(F=238.6,P<0.01)及肾小管间质损伤指数评分显著降低(F=251.5,P<0.01)。见图1。
2.3肾组织CD68、TLR2及NF-κBp65免疫组化改变免疫组化结果显示,Control及TLR2-/-组小鼠的肾小球及肾小管间质中CD68阳性巨噬细胞浸润较少,差异无统计学意义(P>0.05),DM组肾小球及肾小管间质中CD68阳性细胞浸润较Control组明显升高(P<0.01),STZ+PF[25、50、100 mg/(kg·d)]与DM组比较,CD68表达明显减低,差异有统计学意义(F肾小球=540.8、F肾小管间质=89.36,P<0.01),见图2。TLR2主要表达于肾小管上皮细胞胞质中,Control组TLR2仅少量表达,TLR2-/-组几乎不表达,而DM组肾小管上皮细胞胞质中TLR2表达较Control明显增加(P<0.01),STZ+PF[25、50、100 mg/(kg·d)]中上调的TLR2表达明显受到抑制(F肾小管间质=507.8,P<0.01),各组小鼠肾小球 TLR2表达差异无统计学意义(F肾小球=15.58,P>0.05),见图3。Control及TLR2-/-组肾组织仅有少量NF-κB p65表达,DM组肾小球及肾小管间质中NF-κB p65表达明显高于Control(P<0.01),STZ+PF[25、50、100 mg/(kg·d)]与DM组相比,NF-κB p65表达降低,差异有统计学意义(F肾小球=827.4,F肾小管间质=725.6,P<0.01),见图4。
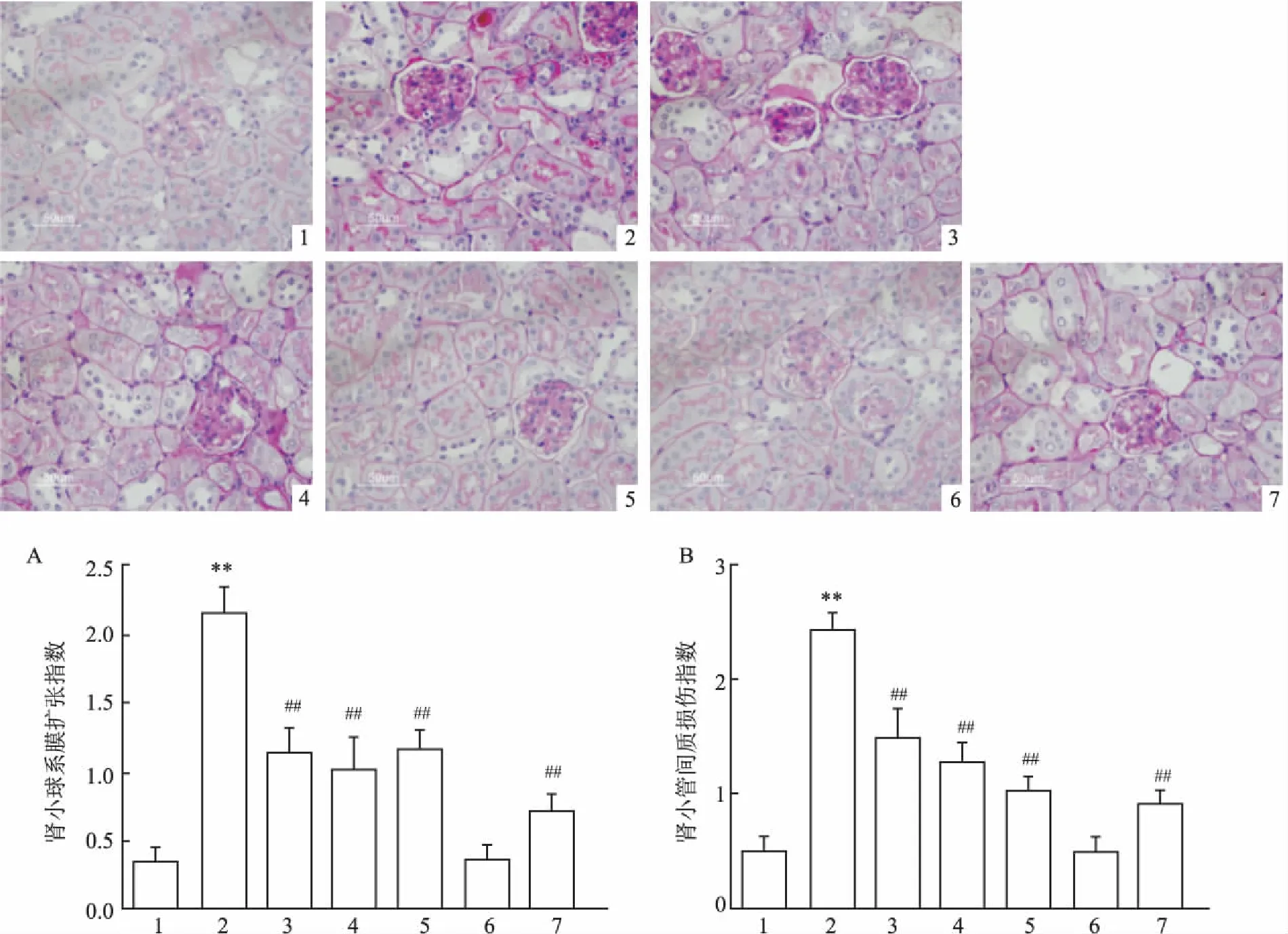
图1 各组小鼠肾组织病理学改变 PAS×400
A:肾小球系膜扩张指数;B:肾小管间质损伤指数;1:Control组;2:DM组;3:STZ+PF 25 mg/(kg·d)组;4:STZ+PF 50 mg/(kg·d)组;5:STZ+PF 100 mg/(kg·d)组;6:TLR2-/-组;7:TLR2-/-+STZ组;与Control组比较:**P<0.01;与DM组比较:##P<0.01
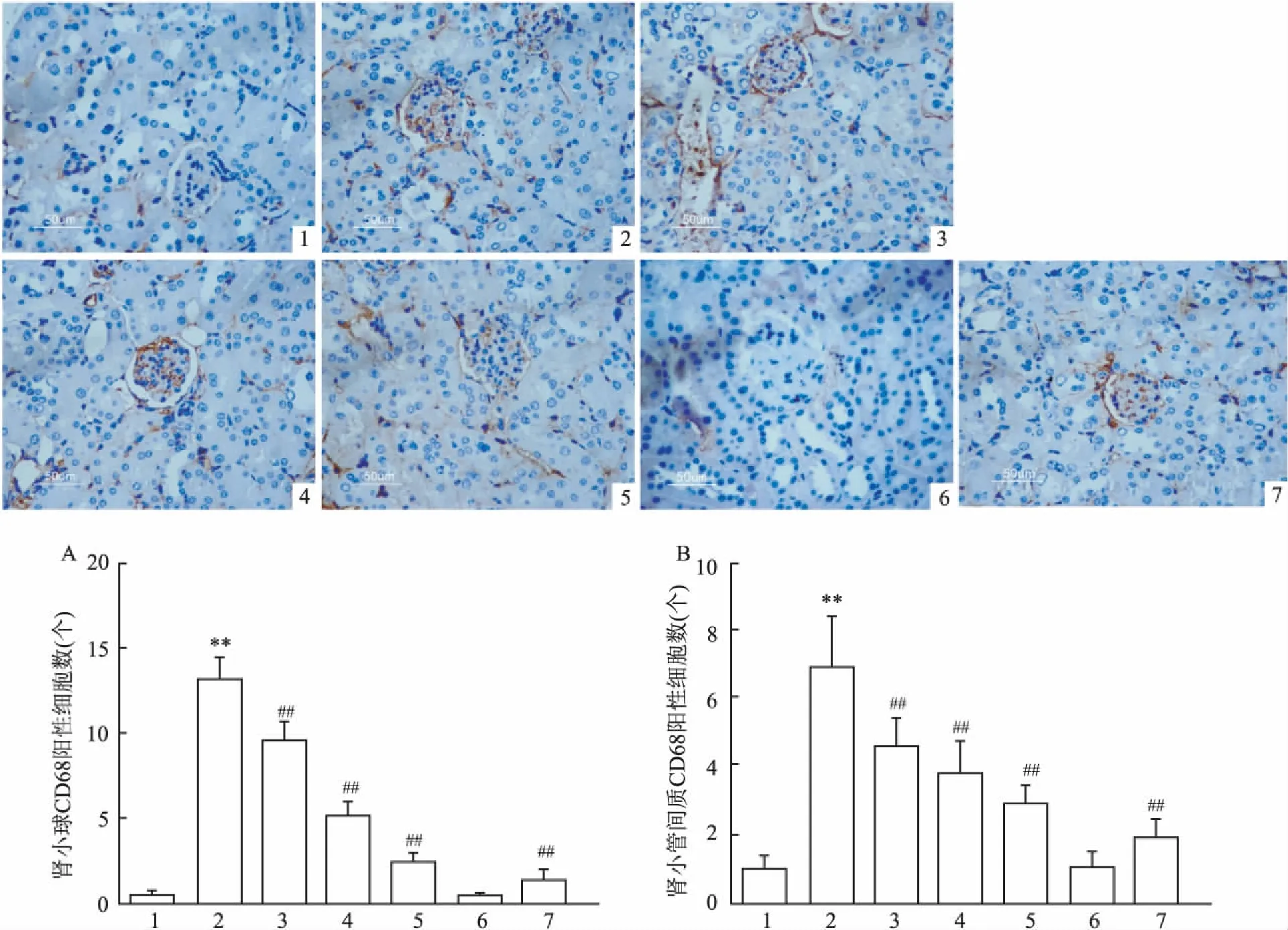
图2 各组小鼠肾组织CD68的表达 PV二步法×400
A:肾小球CD68阳性细胞数;B:肾小管间质CD68阳性细胞数;1:Control组;2:DM组;3:STZ+PF 25 mg/(kg·d)组;4:STZ+PF 50 mg/(kg·d)组;5:STZ+PF 100 mg/(kg·d)组;6:TLR2-/-组;7:TLR2-/-+STZ组;与Control组比较:**P<0.01;与DM组比较:##P<0.01
表2 各组小鼠一般指标变化
与Control组比较:*P<0.05,**P<0.01;与DM组比较:#P<0.05,##P<0.01
2.4各组小鼠肾组织TNF-α、IL-1β和MCP-1的mRNA表达与Control组比较,DM组小鼠肾组织中TNF-α、IL-1β和MCP-1的mRNA表达明显上调(P<0.01),TLR2-/-组小鼠上述指标表达则明显下降(P<0.05,P<0.01);与DM组比较,STZ+PF[25、50、100 mg/(kg·d)]及TLR2-/-+STZ组小鼠TNF-α、IL-1β和MCP-1表达均明显下降(P<0.01)。各指标组间差异具有统计学意义(FTNF-α=237.7、FIL-1β=136.6、FMCP-1=63.07,P<0.01)。见图5。

图3 各组小鼠肾组织TLR2的表达 PV二步法×400
A:肾小球TLR2阳性面积百分比;B:肾小管间质TLR2阳性面积百分比;1:Control组;2:DM组;3:STZ+PF 25 mg/(kg·d)组;4:STZ+PF 50 mg/(kg·d)组;5:STZ+PF 100 mg/(kg·d)组;6:TLR2-/-组;7:TLR2-/-+STZ组;与Control组比较:**P<0.01;与DM组比较:##P<0.01
2.5各组小鼠肾组织TLR2、MyD88、p-IRAK-1、NF-κBp-p65、NF-κBp65、iNOS蛋白表达Western blot结果显示,与Control组比较,DM组小鼠TLR2、MyD88、p-IRAK-1、NF-κB p-p65、NF-κB p65、iNOS的蛋白表达明显上调(P<0.01),TLR2-/-组小鼠上述指标蛋白表达则明显下降(P<0.01);与DM比较,STZ+PF[25、50、100 mg/(kg·d)]及TLR2-/-+STZ组小鼠TLR2、MyD88、p-IRAK-1、NF-κB p-p65、NF-κB p65、iNOS的蛋白表达受到抑制(P<0.05,P<0.01)。各指标组间差异具有统计学意义(FTLR2=168.1、FMyD88=123.6、Fp-IRAK-1=21.11、FNF-κB p-p65=880.3、FNF-κB p65=92.93、FiNOS=23.17,P<0.05,P<0.01)。见图6~7。
3 讨论
DN作为一种长期并发症,预防其进展仍然是一个重要挑战。蛋白尿是肾脏疾病进展的主要危险因素[5-6],测定UAER可评价糖尿病治疗效果[5,7],其值降低代表明显的肾脏保护作用。本研究结果表明PF干预及TLR2基因敲除均可降低糖尿病小鼠UAER,减轻肾脏组织病理损伤,提示了PF及TLR2基因敲除对糖尿病小鼠肾脏有保护作用。
TLR2信号通路与DN肾组织持续的微炎症状态有关。TLR2是Toll样受体家族一员,是配体激活的膜结合受体,其可通过MyD88依赖途径激活NF-κB入核,导致TNF-α、MCP-1等炎性细胞因子上调,促进炎症反应[3]。Li et al[8]研究表明在STZ诱导的糖尿病小鼠腹腔注射TLR2激动剂Pam3CysSK4可上调TLR2-MyD88-NF-κB的表达,增加MCP-1的分泌,加重肾脏损伤。本研究DM组小鼠肾组织中TLR2、NF-κB p65信号被激活,促炎因子TNF-α、IL-1β和MCP-1表达增加,TLR2、MyD88、p-IRAK-1、NF-κB p-p65和NF-κB p65的蛋白表达显著上调,而敲除TLR2基因则明显减弱了上述情况[9]。同时,本研究DM组小鼠肾组织观察到有大量巨噬细胞(CD68阳性细胞)浸润,且巨噬细胞活化以M1型为主,其标志物iNOS表达上调。

图4 各组小鼠肾组织NF-κB p65的表达 PV二步法×400
A:肾小球NF-κB p65阳性面积百分比;B:肾小管间质NF-κB p65阳性面积百分比;1:Control组;2:DM组;3:STZ+PF 25 mg/(kg·d)组;4:STZ+PF 50 mg/(kg·d)组;5:STZ+PF 100 mg/(kg·d)组;6:TLR2-/-组;7:TLR2-/-+STZ组;与Control组比较:**P<0.01;与DM组比较:##P<0.01
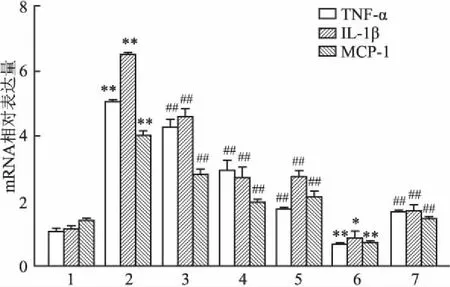
图5 各组小鼠肾组织TNF-α、IL-1β和MCP-1的mRNA表达
1:Control组;2:DM组;3:STZ+PF 25 mg/(kg·d)组;4:STZ+PF 50 mg/(kg·d)组;5:STZ+PF 100 mg/(kg·d)组;6:TLR2-/-组;7:TLR2-/-+STZ组;与Control组比较:*P<0.05,**P<0.01;与DM组比较:##P<0.01
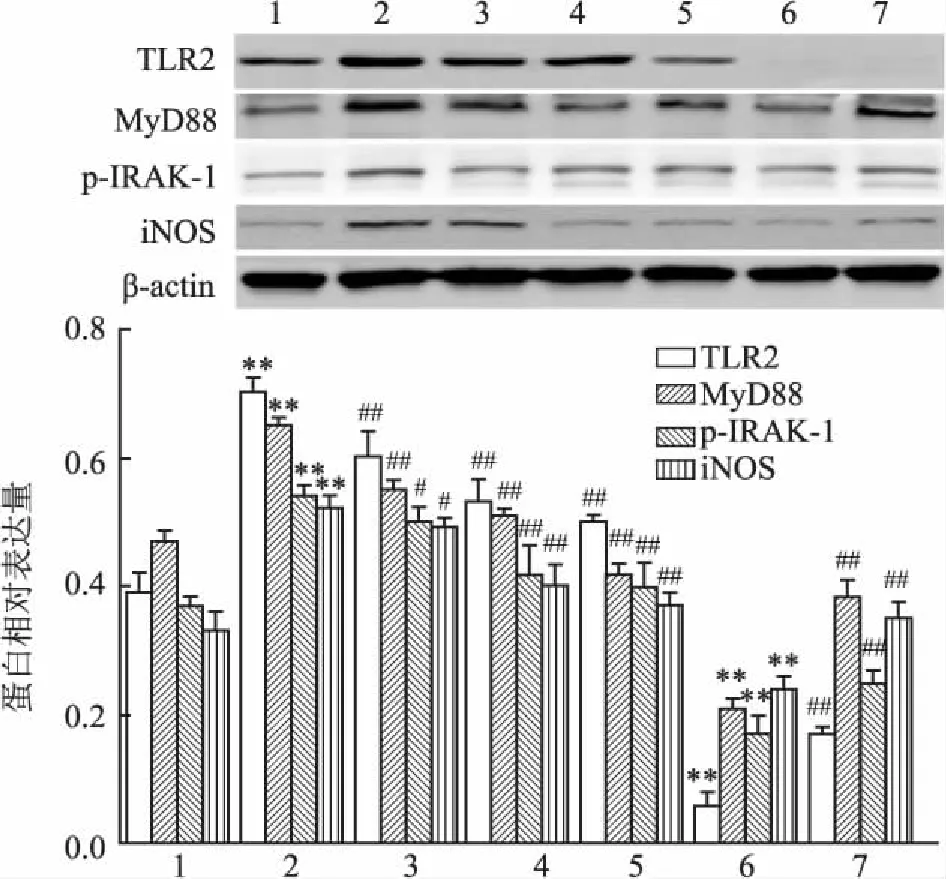
图6 各组小鼠肾组织TLR2、MyD88、p-IRAK-1、iNOS的蛋白表达
1:Control组;2:DM组;3:STZ+PF 25 mg/(kg·d)组;4:STZ+PF 50 mg/(kg·d)组;5:STZ+PF 100 mg/(kg·d)组;6:TLR2-/-组;7:TLR2-/-+STZ组;与Control组比较:**P<0.01;与DM组比较:#P<0.05,##P<0.01

图7 各组小鼠肾组织NF-κB p-p65、NF-κB p65的蛋白表达
A:NF-κB p-p65; B:NF-κB p65;1:Control组;2:DM组;3:STZ+PF 25 mg/(kg·d)组;4:STZ+PF 50 mg/(kg·d)组;5:STZ+PF 100 mg/(kg·d)组;6:TLR2-/-组;7:TLR2-/-+STZ组;与Control组比较:**P<0.01;与DM组比较:##P<0.01
而敲除TLR2基因后肾组织中棕染的CD68明显减少,iNOS表达受到抑制。众所周知,DN的发展与炎症关系密切,其中巨噬细胞浸润是DN特征性表现之一[2,10]。研究[9-10]显示DN肾组织中浸润的巨噬细胞主要是M1型,M1型巨噬细胞能产生大量炎性细胞因子,促进组织损伤。Shao et al[11]研究显示TLR2-/-可减轻由高糖诱导的骨髓来源巨噬细胞向M1型活化及炎症因子的产生。由此证明TLR2可通过MyD88依赖性途径调节巨噬细胞聚集和激活。采取有效针对性地抑制DN中TLR2的过度表达可阻碍DN的发展。 TGP目前已经广泛应用于各种疾病如红斑狼疮、类风湿关节炎的治疗,PF是TGP的主要活性成分[12]。研究[13-14]表明TGP可抑制肾小球和肾小管间质巨噬细胞TLR2和TLR4的表达,TGP有明显的肾脏保护作用。目前PF对DN保护作用的具体机制尚不明确。Shao et al[11]采用体外研究发现PF可通过TLR2信号通路抑制高糖诱导的巨噬细胞活化,减轻TNF-α、IL-1β和MCP-1的表达。本研究PF干预显示出与TLR2基因敲除相同的治疗效果,PF干预可降低24 h UAER,减轻糖尿病小鼠肾脏损伤,阻断肾组织中NF-κB p65活化和巨噬细胞募集,抑制促炎因子TNF-α、IL-1β和MCP-1的表达,与Fu et al[4]研究结果相一致。同时,PF可以抑制糖尿病小鼠肾组织中TLR2水平的升高,降低下游通路MyD88、p-IRAK-1的表达。说明PF可能部分通过抑制TLR2信号通路而发挥对DN的肾脏保护作用。PF对其他Toll受体信号通路的作用有待进一步研究。
综上所述,PF可通过抑制糖尿病小鼠TLR2的表达阻止巨噬细胞活化,减轻炎症反应从而发挥肾脏保护作用,为DN患者PF治疗提供了支持性证据。
