CD68在慢性乙型肝炎发病机制的临床初步研究
2018-09-05陈治东管世鹤程婉秋
陈治东,管世鹤,杨 凯,张 浩,姚 杰,程婉秋
乙型肝炎病毒(hepatitis B virus,HBV)是一种双链DNA嗜肝病毒,感染人体后引起急慢性肝炎、肝纤维化、肝硬化甚至肝癌[1-2]。目前,全球约有2.48亿感染人群,其中我国慢性乙型肝炎(chronic hepatitis B,CHB)患者约为2 000万[3-6]。研究[6]表明,HBV感染介导的间接免疫损伤是急慢性肝炎发病及病情进展重要机制。其中,以肝脏免疫细胞激活及其相关细胞因子分泌为特征的机体固有免疫,在HBV感染早期发挥重要作用[1]。枯否细胞(Kupffer cells, KC)作为肝脏巨噬细胞,其激活不仅参与CHB患者肝脏固有免疫,还在抗病毒治疗过程发挥重要功能[7]。CD68是一种糖基化跨膜蛋白,在人体单核细胞和组织巨噬细胞均有表达,其含量与细胞激活状态密切相关,常用于研究巨噬细胞功能。据报道,HBV及其结构蛋白能通过肝脏CD68阳性细胞NF-κB信号途径进而上调白介素(IL)-1β、IL-6、趋化因子配体8(chemokine cc-motif ligand 8,CXCL8)和肿瘤坏死因子(tumor necrosis factor,TNF)等细胞因子分泌[2]。然而,目前关于CHB患者CD68 含量及其与HBV感染关系尚未明。该研究拟通过分析比较CHB患者和健康对照者血清CD68分子含量及其与肝功能指标及HBV血清学标志物间关系,同时检测CHB患者外周血单个核细胞(peripheral blood mononuclear cell, PBMC)及肝组织CD68的表达情况,以探讨CD68能否作为评估CHB患者肝脏损伤程度及HBV病毒载量的免疫学指标。
1 材料与方法
1.1材料
1.1.1试剂和仪器 人CD68分子检测试剂盒购自上海源叶生物科技有限公司;HBV DNA定量和HBV基因分型诊断试剂盒购自上海复星长征医学科学有限公司;密度梯度分离液购自天津灏洋华科生物科技有限公司;RNA提取、逆转录试剂盒购自美国Thermo scientific公司;聚合酶链式反应(Polymerase chain reaction,PCR)试剂盒购自日本TaKaRa公司;CD68单克隆抗体购自美国Bioworld technology公司;CD68 mRNA引物购自生工生物工程上海股份有限公司;二抗及免疫组化试剂盒购自北京中杉金桥生物技术有限公司;荧光定量PCR仪Agilent M×3000P购自美国Stratagene公司;酶标仪KHB ST-360购自上海科华实验系统有限公司。
1.1.2病例资料 选取慢性乙型肝炎患者共计78例,男53例,女25例。按照《慢性乙型肝炎防治指南(2015年版)》慢性乙型肝炎诊断标准:既往有乙型肝炎病史或乙肝表面抗原(HBsAg)阳性超过6个月。
排除标准:① HIV病毒、丙型肝炎病毒及其它种类病毒感染者;② 酒精性肝炎、药物性肝损伤、肝脏内外与胆管有梗阻或者占位病变;③ 较严重肝硬化及肝癌;④ 感染性疾病、心血管疾病、内分泌疾病、恶性肿瘤;⑤ 自身免疫性肝病、原发性硬化性胆管炎及其它自身免疫性疾病;⑥ 接受免疫增强或者免疫抑制药物治疗。选择同期体检人群健康者84例作为健康对照组。
1.2方法
1.2.1肝功能指标及HBV相关指标定量检测 肝功能指标、甲胎蛋白(alpha fetal protein,AFP)及HBV血清学指标分析分别由西门子全自动生化分析仪Dimension® EXLTMwith LM、罗氏全自动电化学发光分析仪Cobas e602和雅培全自动化学发光分析仪i4000 SR检测。HBV DNA定量和分型检测操作按照检测试剂盒说明书步骤。本研究所有涉及指标检测在安徽医科大学第二附属医院检验科完成,且试剂、质控品、定标品均在有效期之内。
1.2.2血清CD68分子测定 按照检测试剂盒说明书步骤,标准品孔加不同浓度标准品50 μl;样本孔加待测样品10 μl,再加稀释液40 μl;加入酶标记抗体100 μl,封板,37 ℃温育60 min后洗板;加入底物A、B各50 μl,37 ℃避光孵育15 min后,加终止液50 μl,15 min内使用酶标仪KHB ST-360在波长450 nm处测定各孔的OD值。绘制标准曲线,按照曲线方程计算各样本浓度值。
1.2.3实时荧光定量PCR检测PBMC 中CD68 mRNA 水平 TRIzol法提取PBMC总RNA,逆转录成cDNA。CD68上游引物:5′-CATTCCCCTATGGACACCTCA-3′,下游引物:5′-GTCTCCGGATGATGCAGAAAG-3′;β-actin上游引物:5′-CCTGGCACCCAGCACAAT-3′,下游引物:5′-GGGCCGGACTCGTCATAC-3′。扩增程序:37 ℃ 2 min;94 ℃保温2 min;94 ℃ 15 s→56 ℃ 45 s,循环40次;72 ℃ 5 min。56 ℃采集荧光信号。
1.2.4免疫组织化学染色检测PBMC及肝组织CD68的表达 PBMC细胞染色:PBMC置于洁净载玻片,0.4%多聚甲醛固定20 min。0.5%Triton X-100通透20 min。3%H2O2孵育15 min。加预稀释CD68单克隆抗体,37 ℃孵育60 min。加二抗,37 ℃孵育30 min。加二氨基联苯胺(DAB),室温下避光孵育3 min。95%乙醇1 min,无水乙醇1 min加少量树脂封片。
免疫组化:肝穿组织组织切片后脱蜡、抗原修复,3%H2O2浸泡10 min,血清封闭37 ℃温箱30 min;加一抗(1 ∶100)37 ℃温箱90 min,加酶标二抗37 ℃ 30 min,加DAB显色剂;冲洗后,苏木精复染30 s;依次放入70%酒精、80%酒精、90%酒精、95%酒精、100%酒精、100%酒精、二甲苯、二甲苯;中性树胶封片。
1.3统计学处理采用SPSS 16.0软件进行分析,两组定量数据和定性数据分别采用t检验或χ2检验;相关性分析采用Pearson检验。以P<0.05表示差异有统计学意义。
2 结果
2.1人口学特征及实验室指标本研究纳入CHB组78例,健康对照组84例,两组年龄及性别无统计差异无统计学意义。CHB组丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransaminase,AST)、谷酰转肽酶(gamma-glutamyl transpeptidase,GGT)、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)显著高于健康对照组,碱性磷酸酶(alkaline phosphatase,ALP)、AFP无显著差异。见表1。

表1 研究对象基线资料
2.2血清CD68含量与HBV血清学指标相关性分析CHB组血清CD68含量明显高于健康对照组(P<0.001),且与HBV DNA载量的增高趋势相一致,即CHB组血清CD68与HBV DNA呈正相关性(r=0.355 0,P=0.001 4),而与HBsAg含量无显著相关性(r=0.085,P=0.459)。进一步分析CD68与HBV基因型、乙肝e抗原(HBeAg)(-/+)相关性显示,B型(40例)和C型(38例)CHB患者血清CD68含量分别为(0.188±0.033) pg/L、(0.196±0.027) pg/L,差异无统计学意义(P=0.215);HBeAg(+)与HBeAg(-)CHB患者血清CD68含量分别为(0.186±0.043)pg/L、(0.195±0.020)pg/L,差异亦无统计学意义(P=0.200)。见图1。
2.3血清CD68水平与肝功能关系相关性分析ALT、AST、TBIL、DBIL、GGT和ALP是评估肝脏损伤程度常用的生化指标,尤其ALT和AST在慢性乙型肝炎临床分期和治疗中具有重要意义。通过分析CHB组血清CD68与肝脏损伤指标显示,血清CD68与ALT和AST均呈正相关性(r=0.345 0,P=0.002 0;r=0.328 9,P=0.003 3),而与其它肝脏生物化学指标TBIL、DBIL、GGT、ALP间无显著相关性。见图2。
2.4PBMC中CD68mRNA表达RT-PCR检测结果显示,CHB组患者PBMC CD68 mRNA相对表达量为(15.71±15.04),健康对照者PBMC CD68 mRNA相对表达量为(13.95±14.01);两组间相对表达量差异无统计学意义(P=0.668 0)。
2.5肝组织及PBMC中CD68表达免疫组化染色结果显示,CD68阳性细胞呈棕褐色,正常肝组织未见,CHB患者肝组织CD68表达明显升高,主要分布于门脉及肝小叶内,见图3A、3B。此外,CD68均可见于CHB患者与健康对照者PBMC,呈低表达,且无明显差异,见图3C、3D。

图1 血清CD68含量与乙肝血清学指标关系
A:健康对照组与CHB组患者血清CD68表达水平比较;与健康对照组比较:***P<0.0001;B:CHB患者血清CD68含量与HBV DNA载量相关性分析;C: CHB患者血清CD68含量与HBV基因分型对应关系;D: CHB患者血清CD68含量与HBeAg状态对应关系
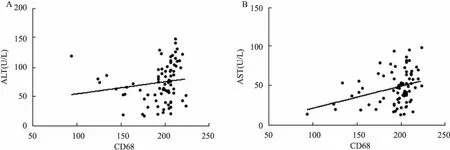
图2 CHB组CD68含量与肝功能指标关系A:CHB组CD68含量与ALT相关性分析;B:CHB组CD68含量与AST相关性分析

图3 肝组织及PBMC免疫组化染色结果
A:CHB患者肝组织 ×1 000;B:对照组肝组织 ×1 000;C:CHB患者PBMC ×400;D:对照组PBMC ×400;红色箭头:肝组织中CD68阳性细胞呈棕褐色;蓝色箭头:PBMC
3 讨论
慢性乙型肝炎病毒感染过程是HBV复制和宿主免疫反应之间相互作用的动态过程。肝脏免疫功能依赖于其组织结构,包括肝细胞、KC、NK细胞、NKT细胞等固有免疫细胞组成复杂肝脏免疫系统。其中KC约占肝脏非实质细胞的30%以上,数量显著高于T细胞,在HBV感染初期凭借诱导炎性细胞因子干拢素α(IFN-α)和IL-6发挥重要的固有免疫功能[8]。CD68分子是巨噬细胞的重要表面标记,常用于巨噬细胞鉴定和功能研究。目前,已明确CD68在HBV相关慢加急性肝衰竭、自身免疫性肝病、疟疾、肿瘤等疾病当中均能发挥重要免疫功能[9-10]。然而,CD68分子与CHB发病关系并未完全阐明。
本研究显示,CHB组患者血清CD68分子含量明显高于健康对照组,且与CHB组患者HBV DNA载量呈正相关性,提示CHB患者体内病毒复制活跃能刺激巨噬细胞激活并释放CD68分子。这与刘渊 等[11]研究发现CHB患者肝组织中CD68阳性巨噬细胞数量明显高于健康对照组结论相符 。在动物模型研究中,Kouwaki et al[12]发现HBV感染早期肝脏F4/80阳性NK细胞产生针对HBV病毒的干扰素-γ。然而,本研究未显示血清CD68分子含量和HBV血清学指标HBsAg含量及HBeAg状态呈显著相关性。HBV感染细胞模型研究显示,HBsAg可以通过CD1d依赖途径干扰细胞内脂质环境进而激活NKT细胞[13]。HBsAg可以选择性地阻断JNK -MARK通路,抑制单核/巨噬细胞TLR2配体诱导的IL-12生成,HBV借此逃避免疫清除作用[14]。CD68分子含量在HBV DNA载量与HBsAg含量及HBeAg状态存在差异,究其原因可能与HBV分泌的相关病毒抗原组分诱导肝脏产生免疫抑制效应,包括巨噬细胞呈低反应性有关。本地区流行HBV基因型主要为B型与C型,研究显示血清CD68分子含量B型、C型CHB患者间无显著差异。该两种基因型HBV均可刺激巨噬细胞活化并增加机体CD68分子释放。血清ALT与AST是临床评估肝脏功能最常用的诊断指标,血清CD68含量与ALT、AST明显正相关。即CHB患者血清CD68含量随ALT和AST升高而逐渐升高,提示CD68与CHB患者肝脏免疫损伤及疾病严重程度也密切相关。
此外,本研究显示PBMC CD68 mRNA和蛋白的表达在CHB患者与健康对照者间比较差异无统计学意义。在PBMC中表达CD68 的单个核细胞较少,其表达的mRNA 量也比较少。CD68在PBMC 与血清中差异性表达,提示血清中高表达CD68分子可能源于PBMC外细胞分泌。免疫组织化学染色结果显示,CD68在CHB患者肝组织的表达升高,主要分布于门脉及肝小叶区域,推测升高CD68可能体现HBV感染后巨噬细胞在肝脏局部微环境中增殖分化,通过调节免疫应答反应,参与慢性乙型肝炎疾病发展。
总之,免疫学标志物与疾病进展及抗病毒疗效日益受到关注。本研究结果表明,CD68分子除了可作为巨噬细胞表面标志物,还可能通过参与病毒复制和肝脏免疫,具有潜在评估CHB患者临床诊疗新型指标。后续从HBV感染诱导巨噬细胞分泌CD68分子机制入手,深入研究HBV与机体固有免疫相互作用关系,并探讨抗病毒治疗过程中CD68含量的动态变化,以阐明巨噬细胞CD68分子在病毒感染、复制及抗病毒治疗中可能存在的效应机制,为最终揭示HBV致病机制奠定理论基础。
