三株乳酸杆菌的分离鉴定与益生特性研究
2018-07-05梁东梅李玉鹏杜艳芬安建勇崔茂盛李治欣乔家运杨卓婧王文杰李海花
梁东梅 ,李玉鹏 ,杜艳芬 ,朱 琪 ,安建勇 ,崔茂盛 ,李治欣,乔家运,杨卓婧,王文杰,李海花 *
(1.天津师范大学生命科学学院,天津 300387;2.天津市畜牧兽医研究所,天津 300381;3.赛默飞世尔(上海)仪器有限公司,上海 201206;4.河南省洛阳市老城区动物卫生监督所,河南洛阳471000)
肠道是机体最大的免疫器官,是防御外来病原菌感染的第一道防线(Ohland和Macnaughton,2010)。猪大肠杆菌病是由致病性大肠杆菌引起的主要危害仔猪肠道健康的一种多发病。虽然利用抗生素能够预防该病的发生,但是长期使用也会产生诸多的负面效应(Cameron等,2016),因此提高仔猪自身抵抗力是有效防控仔猪大肠杆菌病的有效途径。乳酸杆菌是仔猪肠道中最早定植的菌群之一,其能产生抑菌物质,维持肠道菌群平衡(Ren等,2015),改善仔猪肠道屏障 (刘海鸿等,2017),增强仔猪免疫力(周建国等,2014),减轻致病菌引起的肠道损伤,提高生长性能 (Qiao等,2015;Yang等,2014),有望替代抗生素在仔猪饲粮中使用。本研究从健康猪粪便中分离鉴定出三株乳酸杆菌,并利用猪小肠上皮细胞(IPEC-J2)模
型,研究了这三株乳酸菌在IPEC-J2细胞上黏附的特点、对致病性大肠杆菌的生长抑制作用和黏附抑制作用,并进行了比较,为在仔猪饲粮中选择性添加使用该乳酸菌提供了依据,为深入研究乳酸杆菌调节仔猪肠道屏障功能奠定了基础。
1 试验材料与方法
1.1 细胞和菌株 产肠毒素大肠杆菌(ETEC)K88菌株购买于中国兽医药品监察所菌种保藏中心。猪小肠上皮细胞(IPEC-J2)株购买于上海冠导生物工程有限公司。
1.2 主要试剂 RPMI Medium 1640 basic培养液、胰蛋白酶EDTA消化液和胎牛血清均购自美国Gibco公司,青链霉素、PBS缓冲液、硫酸庆大霉素和TritonX-100均购自北京索莱宝生物公司,TRIzol试剂盒、Taq 酶、10×buffer、dNTPs 均购买于上海生工生物工程股份有限公司,MRS培养基和LB培养基均为自制。
1.3 乳酸杆菌分离 无菌条件下取28日龄健康断奶仔猪新鲜粪便10 g,平均分成两份,一份放入冻存管中-80℃保存,另一份在超净工作台中用无菌生理盐水稀释至10-4、10-5和10-6梯度,分别取0.2 mL粪便稀释液接种于选择性培养基MRS中,置于37℃恒温培养箱中培养24 h。挑取形态疑似的单克隆菌落在MRS上继续培养,然后不断挑取单克隆菌落进行划线,直至得到纯净单一菌落。
1.4 乳酸杆菌生理生化及PCR鉴定 依照 《伯杰氏细菌鉴定手册》观察菌株的形态并测定其生化反应 (布坝南和吉本斯,1984)。根据乳酸杆菌16S rRNA保守序列,采用Primer 5.0软件设计特异性引物 (5’-AGAGTTTGATCCTGGCTCAG-3’;5’-GGTTACCTTGTTACGACTT-3’),引物序列由上海生工生物工程股份有限公司合成。采用TRIzol试剂盒提取细菌基因组DNA,并以之为模板,利用乳酸菌鉴定的引物进行PCR扩增。PCR扩增体系为(50 μL):Taq 酶(5 U/μL)1 μL,DNA模板 2 μL,10×buffer 5 μL,上、下游引物各 1 μL,dNTPs(10mM each)1 μL,PCR 水 39 μL。 PCR 反应程序:94 ℃ 5 min、94 ℃ 25 s、62 ℃ 25 s、72 ℃1 min 30 s、40个循环,72 ℃终延伸 3 min、16 ℃2 min。用1%琼脂糖凝胶电泳检测PCR扩增结果。将PCR产物纯化后送金唯智生物公司进行核苷酸序列测定,测序结果与GenBank数据库中的参考菌株序列进行比对,确定所分离的三株乳酸杆菌的属种。
1.5 乳酸杆菌抑菌活性能力的测定 活菌计数法:将三株乳酸杆菌分别接种于MRS液体培养基,37℃静置过夜培养,然后5000 r/min 4℃离心10 min,收集培养上清液,置4℃保存备用。将上述三株乳酸菌培养上清液分别与大肠杆菌溶液(浓度为 1.68×109cfu/mL)混合作用,作用时间分别为 0、5、15、30 min 和 60 min, 然后将大肠杆菌凃布LB培养板,37℃过夜培养后,进行菌落计数。每个菌株的每个时间点分别做3次重复。
牛津杯法 (杜金城等,2016):在直径10 cm培养皿中加入15 mL含2%琼脂的无菌水,静置。待琼脂凝固后,用无菌镊子把牛津杯等距离放入培养皿中。将大肠杆菌(1×108cfu/mL)及LB固体培养基(10 mL)混匀倒入培养皿中,待其凝固后将牛津杯取出,并分别将三种乳酸杆菌培养上清液(150 μL)加入牛津杯孔中,其中每个菌株做3个重复,用MRS培养液做空白对照。将培养皿置4℃冰箱2 h,待培养上清液扩散后,将培养皿转入37℃培养箱中培养24 h,然后测定抑菌圈直径。
1.6 乳酸杆菌黏附猪小肠上皮细胞能力测定用含10%胎牛血清、1%青链霉素的RPMI Medium-1640 basic培养基培养IPEC-J2细胞,培养条件是37℃、5%CO2,待细胞生长至对数生长期时,消化细胞并接种于两块24孔细胞培养板(细胞浓度为3×105个/孔),待细胞生长密度至50%,分别加入植物乳杆菌、唾液乳杆菌和嗜酸乳杆菌(浓度均为5×107cfu/孔),置细胞培养箱分别孵育3、6 h和24 h,弃去培养液,用不含血清的DMEM清洗3次以去除未黏附的乳酸杆菌,然后向其中一块培养板每孔加入100 μL 0.5%TritonX-100,37℃孵育8 min以裂解细胞,再加入900 μL PBS终止裂解,吹打混匀后吸出样品。将样品进行梯度稀释后,涂布MRS培养板厌氧培养48 h,进行乳酸杆菌计数,此时乳酸杆菌数(C1)为IPEC-J2细胞吞噬和黏附的乳酸菌总数;另一块培养板每孔加入含100 μg/mL庆大霉素的培养液0.4 mL,孵育2 h。弃去庆大霉素,按照上述方法裂解细胞并终止反应,并对乳酸杆菌进行培养和计数,此时乳酸杆菌数 (C2)为IPEC-J2细胞吞噬的乳酸杆菌数。黏附的乳酸菌活菌数量=乳酸杆菌数C1-乳酸杆菌数C2。
1.7 乳酸杆菌抑制大肠杆菌黏附猪小肠上皮细胞能力的测定 将IPEC-J2细胞分别接种于两块 24孔培养板(细胞浓度为3×105个/孔),待细胞生长密度至50%,分别加入植物乳杆菌、唾液乳杆菌及嗜酸乳杆菌 (浓度为5×107cfu/孔),孵育细胞6 h,分别用大肠杆菌K88(浓度为5×106cfu/孔)刺激细胞 0、3、6 h 和 24 h。 刺激结束后按照乳酸杆菌黏附猪小肠上皮细胞能力试验中的方法对细胞进行裂解和大肠杆菌计数。黏附的大肠杆菌活菌数量=大肠杆菌数C1-大肠杆菌数C2。
1.8 统计分析 使用Excel和SPSS 20.0软件进行数据统计分析,比较不同乳酸杆菌不同时间点黏附IPEC-J2细胞的能力以及乳酸杆菌抑制大肠杆菌K88黏附IPEC-J2细胞能力是否具有显著性差异。试验结果以“平均值±标准差”表示。采用单因素ANOVA进行方差分析,并采用t检验进行组间差异显著性检验。
2 结果与分析
2.1 菌株的形态学观察 分离纯化的乳酸杆菌菌株经37℃厌氧培养24 h后,呈圆形凸起、不透明、乳白色或灰白色、边缘整齐光滑的单菌落,经过革兰氏染色镜检,初步判定分离菌株为杆状的革兰氏阳性菌。对单个菌落进行划线保存,得到三株纯净单一菌落,编号分别为L1、L2、L3。
2.2 乳酸杆菌生化及PCR鉴定 三株分离菌株生化鉴定结果如表1,根据 《伯杰氏细菌鉴定手册》确定编号L1、L2、L3为乳酸杆菌。
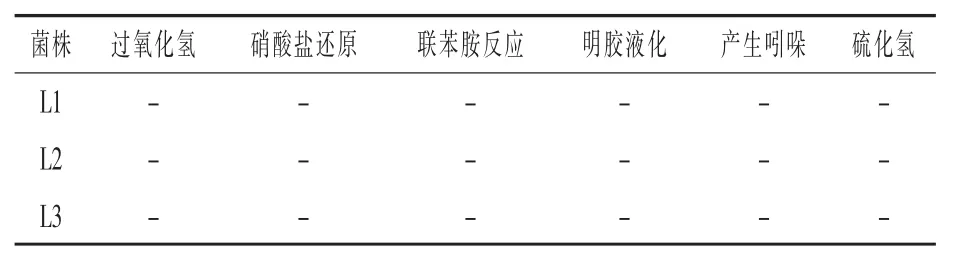
表1 三株分离菌株生化试验结果
琼脂糖凝胶电泳结果如图1所示,乳酸杆菌L1、L2和L3的PCR扩增条带大小分别约1500 bp,与预期产物条带大小相符。将目的条带进行胶回收纯化并测序,测序结果在NCBI数据库中经过BLAST比对,结果发现,L1菌株与植物乳杆菌同源性达99.45%,L2菌株与唾液乳杆菌同源性达99.36%,L3菌株与嗜酸乳杆菌同源性达98.21%,因此本研究分离的乳酸杆菌L1、L2和L3菌株分别为植物乳杆菌、唾液乳杆菌和嗜酸乳杆菌。
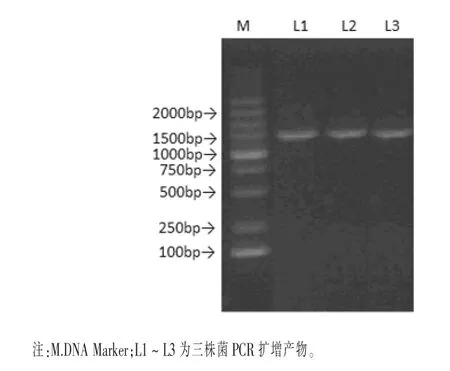
图1 三株菌16SrRNAPCR扩增产物电泳结果
2.3 乳酸杆菌抑制大肠杆菌能力的测定 三株乳酸杆菌培养上清液抑制大肠杆菌能力的结果见表2和表3。如表2所示,植物乳杆菌抑菌圈直径为30.8 mm,唾液乳杆菌和嗜酸乳杆菌抑菌圈直径分别为18.7、16.6 mm,可见三株乳酸杆菌培养上清液对大肠杆菌均有良好的抑制效果,其中以植物乳杆菌的抑菌效果最好,同时MRS培养液对照组的抑菌圈直径为0 mm,说明MRS培养液对大肠杆菌无抑制作用。活菌计数法结果如表3所示,与植物乳杆菌作用0 min相比,植物乳杆菌作用 5、15、30 min和60 min后抑菌力均是 100%;与唾液乳杆菌作用0 min相比,唾液乳杆菌作用5、15、30 min和 60 min后抑菌力分别提高了20%、21%、24%和52%;与嗜酸乳杆菌作用0 min相比,嗜酸乳杆菌作用5、15、30 min和60 min后抑菌力分别提高了9%、18%、24%和51%,并且随着乳酸杆菌作用时间的延长其抑菌效果也最明显,牛津杯法和活菌计数法检测的抑菌效果一致。试验数据表明,三株乳酸杆菌能够有效抑制大肠杆菌生长,其抑菌能力强弱依次是植物乳杆菌、唾液乳杆菌和嗜酸乳杆菌。

表2 牛津杯法测三株乳酸杆菌抑制大肠杆菌能力的结果mm

表3 活菌计数法测三株乳酸杆菌抑制大肠杆菌能力的结果109cfu/mL
2.4 乳酸杆菌黏附IPEC-J2细胞能力的测定三株乳酸杆菌黏附IPEC-J2细胞能力的结果如表4,与植物乳杆菌作用细胞3 h相比,植物乳杆菌作用细胞6 h和24 h时其黏附数分别增加了18%和7%;与唾液乳杆菌作用细胞3 h相比,唾液乳杆菌作用细胞6 h和24 h时其黏附数分别增加了23%和15%;与嗜酸乳杆菌作用3 h相比,嗜酸乳杆菌作用细胞6 h和24 h时其黏附数分别增加了18%和13%。与乳酸杆菌作用3 h相比,三株乳酸杆菌作用细胞6 h和24 h时其黏附数均显著增加,并且以乳酸杆菌作用6 h时的黏附数为最多。试验数据表明,三株乳酸杆菌对IPECJ2细胞具有很好的黏附性,其中植物乳杆菌黏附性较好。
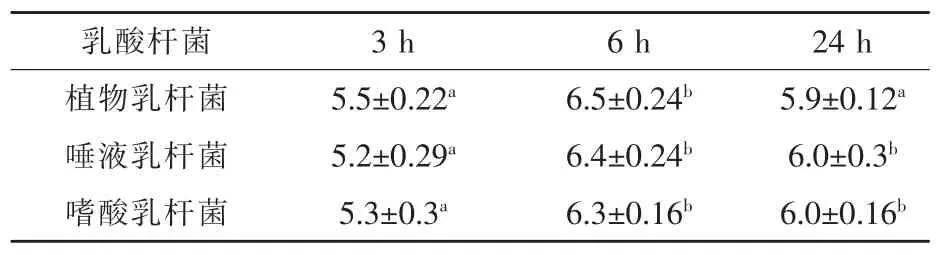
表4 三株乳酸杆菌黏附能力测定的结果log cfu/mL
2.5 乳酸杆菌对大肠杆菌黏附猪小肠上皮细胞的影响 乳酸杆菌对大肠杆菌黏附猪肠上皮细胞的影响结果如表5所示,与大肠杆菌刺激细胞0 min相比,大肠杆菌刺激细胞3、6 h和24 h时植物乳杆菌对其黏附数分别降低了16%、19%和6%,唾液乳杆菌对其黏附数分别降低了6%、16%和3%,嗜酸乳杆菌对其黏附数分别降低了4%、12%和3%,并且均以大肠杆菌刺激细胞6 h时三株乳酸杆菌对其黏附数降低为最多。试验数据表明,三株乳酸杆菌能够有效抑制大肠杆菌黏附猪小肠上皮细胞,其抑制能力强弱依次是植物乳杆菌、唾液乳杆菌和嗜酸乳杆菌。

表5 三株乳酸杆菌对大肠杆菌黏附猪小肠上皮细胞测定的结果log cfu/mL
3 讨论
3.1 三株乳酸杆菌抑菌能力 肠道微生物构成的屏障是肠道屏障的重要组成部分,对宿主肠道功能的发挥具有重要作用。乳酸杆菌在代谢过程中产生的乳酸、抗菌肽等有益物质,可显著降低环境pH和氧化还原点位值,使肠内酸度增高,一方面促使主细胞分泌的胃蛋白酶原转变为胃蛋白酶,还能提高胃蛋白酶活性,促进动物对蛋白质的消化吸收,从而提高饲料报酬、改善动物生长性能;另一方面能够抑制和杀灭革兰氏阴性菌、过氧化氢酶阳性细菌、大肠杆菌类和沙门氏菌等病原菌,调节肠道菌群平衡(黄奕雯等,2017;陈大卫等,2014)。由此可见,乳酸菌对于提高动物生产性能和健康水平具有十分重要的意义。本研究分别采用牛津杯法和活菌计数法分析获得的三株乳酸杆菌的抑菌活性,结果表明三株乳酸杆菌对产肠毒素大肠杆菌具有很强的抑制作用,并且植物乳杆菌的抑菌能力明显高于唾液乳杆菌和嗜酸乳杆菌,这与杨红亚等(2013)和侯颖等(2017)报道一致,然而三株乳酸杆菌饲喂仔猪后能否有效抵抗大肠杆菌的感染还需要深入研究。研究表明,嗜酸乳杆菌饲喂仔猪后降低了直肠内容物中大肠杆菌的数量,增加了乳酸杆菌的数量(Qiao等,2015)。但也有研究结果表明,乳酸杆菌的加入并没有本试验抑菌效果明显(杜金城等,2016),与本研究结果有差异,这可能是由于菌株不同、产酸能力不同以及抑制的病原菌不同等因素造成的差异。仔猪肠道除了面临致病性大肠杆菌入侵的威胁外,还要面临其他病原菌如沙门氏菌、链球菌、巴氏杆菌和丹毒杆菌等的威胁,因此,这三株乳酸菌对其他肠道病原菌的生长繁殖是否具有抑制作用还有待进一步研究。
3.2 三株乳酸杆菌黏附及竞争性黏附能力 乳酸杆菌发挥作用的关键是首先定植到细胞上,通过竞争营养及黏附部位阻挡病原菌与细胞表面受体的结合,或者黏附细胞后细胞释放活性抑菌物质抑制病原菌黏附来调节猪肠道内菌群平衡,提高仔猪健康水平。由于在体内很难量化菌株对细胞的黏附,应用体外细胞培养试验方法来反映菌株的黏附性能已成为公认的模式(García-Ruiz等,2014;Valeriano 等,2014)。本试验选用猪小肠上皮细胞(IPEC-J2)为模型,用分离的乳酸杆菌作用细胞后检测其黏附性。结果表明,三株乳酸杆菌对肠上皮细胞均具有一定的黏附性,其中植物乳杆菌黏附性较好,这与Wang等(2017)的结果相一致。同时乳酸杆菌作用IPEC-J2细胞24 h时,其黏附细胞的能力均下降,这可能是由于培养液中的营养物用尽,或者是细菌表面与细胞膜外糖脂共价结合的膜磷壁酸减少,或者是细胞表面黏附受体达到饱和所引起的黏附力下降(赵静等,2014),这一结果与吴凡等(2015)及刘海鸿等(2017)在乳酸杆菌作用细胞后2 h和4 h时黏附力开始下降有所不同,这可能是由于生长环境、菌株和细胞等的不同引起的差异,也可能是由于不同菌株在不同生长阶段代谢产物不同所引起的黏附效果不同(向鑫玲等,2016)。在分析乳酸杆菌对大肠杆菌黏附猪小肠上皮细胞的影响时发现,三株乳酸杆菌与对照组相比均具有显著抑制大肠杆菌黏附细胞的特性,这是由于乳酸杆菌黏附细胞后竞争营养及黏附部位阻挡了大肠杆菌与细胞表面受体的结合。然而当大肠杆菌刺激时间达24 h时,乳酸杆菌抑制大肠杆菌黏附细胞的能力下降,这可能是由于大肠杆菌释放的内毒素对细胞产生了毒性作用,影响了细胞正常的生理功能。
综上所述,分离的三株乳酸杆菌对猪肠上皮细胞具有良好的黏附能力,并可抑制产肠毒素大肠杆菌的生长和黏附猪小肠上皮细胞,为其在仔猪饲粮中的应用提供了依据,为深入研究乳酸杆菌调节仔猪肠道屏障功能奠定了基础。
4 结论
从健康猪粪便中分离鉴定出三株乳酸杆菌分别是植物乳杆菌、唾液乳杆菌和嗜酸乳杆菌,三株乳酸杆菌能够有效抑制致病性大肠杆菌的生长,具有黏附猪小肠上皮细胞的特性,并能够有效抑制致病性大肠杆菌黏附于猪小肠上皮细胞。
[1]布坝南R E,吉本斯N E.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰氏细菌鉴定手册》翻译组,译.北京:科学出版社,1984.793~820.
[2]陈大卫,郭飞翔,顾瑞霞,等.具有降胆固醇能力的人源乳酸菌筛选[J].现代食品科技,2014,30(3):114 ~ 120.
[3]杜金城,徐敏,李柏良,等.具有抑制大肠杆菌作用的乳酸菌的初步筛选及其益生潜能的研究[J].食品工业科技,2016,13:152~156.
[4]侯颖,王维宇,牛明福,等.自然发酵泡菜汁中植物乳杆菌的分离鉴定与体外益生特性研究[J].动物营养学报,2017,29(10):3611~3619.
[5]黄奕雯,刘悦欣,陶政,等.鸡源乳酸菌细菌素的分离筛选及鉴定[J].中国兽医杂志,2017,9:23 ~ 27.
[6]刘海鸿,陶柯衡,张国荣,等.卷曲乳酸杆菌对Hela细胞的黏附研究[J].中国微生态学杂,2017,29(1):19 ~ 21.
[7]吴凡,黄翠姬,刘昭明.植物乳杆菌LO1对人结肠癌细胞系Caco-2 的黏附性能 [J].食品与发酵工业,2015,41(12):59 ~ 63.
[8]向鑫玲,张英春,马放.乳酸杆菌的表面特性及其黏附能力的研究[J].食品工业科技,2016,37(7):126 ~ 130.
[9]杨红亚,崔红玉,闫帅,等.黑龙江散养鸡中一株乳酸菌的分离鉴定及益生特性和抗病毒特性研究 [J].中国预防兽医学报,2013,35(6):444 ~ 448.
[10]赵静,李向楠,王军.益生乳酸菌对奶牛阴道上皮细胞黏附作用的研究[J].中国预防兽医学报,2014,36(9):701 ~ 703.
[11]周建国,宋文斌,马威,等.阴道卷曲乳酸杆菌对阴道致病菌的体外生物拮抗作用[J].中国微生态学杂志,2014,26(3):274 ~275.
[12]Cameron-Veas K,Moreno MA,Fraile L,et al.Shedding of cephalosporin resistant Escherichia coli in pigs from conventional farms after early treatment with antimicrobials[J].Veterinary Journal,2016,211:21 ~ 25.
[13]García-Ruiz A,González d L D,Esteban-Fernández A,et al.Assessment of probiotic properties in lactic acid bacteria isolated from wine[J].food Microbiology,2014,44(6):220 ~ 225.
[14]Ohland C L,Macnaughton W K.Probiotic bacteria and intestinal epithelial barrier function[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2010,298 (6):G807 ~G819.
[15]Qiao J,Li H,Wang Z,et al.Effects of Lactobacillus acidophilus dietary supplementation on the performance,intestinal barrier function,rectal microflora and serum immune function in weaned piglets challenged with Escherichia coli lipopolysaccharide[J].Antonie Van Leeuwenhoek,2015,107(4):883 ~ 891.
[16]Ren D,LI C,Qin Y,et al.Evaluation of immunomodulatory activity of two potential probiotic Lactobacillus strains by in vivo test[J].Anaerobe,2015,35(Pt B):22 ~ 27.
[17]Valeriano V D,Parungao-Balolong M M,Kang D K.In vitro evaluation of the mucin-adhesion ability and probiotic potential of Lactobacillus mucosae LM1[J].Journal of Applied Microbiology,2014,117(2):485 ~ 497.
[18]Wang B,Chen J,Wang S,et al.Lactobacillus plantarum L9 but not Lactobacillus acidophilus LA reduces tumour necrosis factor induced bacterial translocation in Caco-2 cells[J].Beneficial Microbes,2017,8(3):497 ~ 505.
[19]Yang KM,Jiang ZY,Zheng CT,et al.Effect of Lactobacillus plantarum on diarrhea and intestinal barrier function of young piglets challenged with enterotoxigenic Escherichia coli K88[J].Journal of Animal Science,2014,92(4):1496 ~ 1503.
