酵母源生物饲料的菌种与功能
2018-07-05戴晋军胡骏鹏周小辉陈中平曾雨雷
聂 琴,戴晋军,胡骏鹏,周小辉,陈中平,曾雨雷
(安琪酵母股份有限公司,湖北宜昌 443003)
酵母属于真菌,是一类单细胞真核微生物的统称。酵母广泛分布于自然界,喜在糖分高、偏酸性的环境中生长;其形态多样,因种而异,常见的有球形、椭圆形、卵圆形、柠檬形等,细胞大小因种类差别很大,一般直径 1~5 μm,长 5~30 μm 或更长(于景芝,2005)。酵母具有繁殖快,生长周期短(一般每1.5~2 h增殖一代),代谢旺盛,且菌体营养丰富等特点(周德庆,2002);酵母是兼性微生物,在有氧呼吸或无氧发酵条件下都能生长,厌氧发酵可以获得代谢产物(如酒精、各种酒类、甘油、酶等),耗氧发酵可以获得酵母细胞或细胞组成成分(于景芝,2005);酵母菌生长繁殖所需的能量主要来自糖类的分解代谢,可以利用多种不同的单糖和低聚糖、非碳水化合物(如多元醇、石油裂解物)、工业生产的碳源(如糖质原料糖蜜、淀粉质原料玉米和大麦等谷物、含糖废液、亚硫酸盐废液)等。
目前发现超过1500种的酵母,已鉴定700多种,但只有一少部分在工业中使用。酵母菌具有优良的发酵特性和营养特性,在实际生产中可以根据对酵母细胞数量、细胞组成成分的需求,或者对酵母代谢产物的需求,按照不同目的来确定酵母发酵的生产工艺。工业上常用的酵母种类有酿酒酵母、异常汉逊氏酵母(李锐利,2011)、粟酒裂殖酵母(陈良强,2013)、黏红酵母(施安辉,2003)、热带假丝酵母(赵国群,2017)、产朊假丝酵母(郭照宙,2016)、解脂假丝酵母(卢翠文,2009)、巴斯德毕赤酵母(唐元家,2002)等。目前酵母及酵母衍生物已广泛应用于食品(酿酒、烘焙与中式发酵、调味品生产等)、医药和化工(即食营养酵母,酵母谷胱甘肽、核糖核酸、B族维生素、酵母多糖、麦角固醇等)、农业(单细胞蛋白饲料、农业肥料、益生菌等)、生物能源(燃料乙醇)、生物工程(基因工程的受体菌)等领域。
1 饲料工业中应用的酵母种类
以酵母为生物饲料或载体,利用现代生物技术,并结合微生物发酵而获得的一系列与酵母相关的具有特定营养或功能的、天然的、安全的饲料原料及饲料添加剂产品,统称为酵母源生物饲料。
欧盟饲料原料目录(EU)No 68/2013中规定,可以在饲料中使用的微生物、微生物发酵(副)产物、酿造生产副产物、生物燃料生产副产物,涉及11种酵母:酿酒酵母、卡氏酵母、乳酸克鲁维酵母、脆壁克鲁维酵母、戴尔有孢圆酵母、产朊假丝酵母、杰丁毕赤酵母、葡萄汁酵母、路德酵母、酒香酵母属、解脂耶氏酵母。在我国饲料原料目录(2013)和饲料添加剂目录(2013)中,对单细胞蛋白、微量元素、着色剂、多糖、微生物的5个类别,18种原料或添加剂所使用的酵母菌种进行了限定(表1)。目前由我国农业部批准,在饲料原料和添加剂中可以合法使用的酵母主要有酿酒酵母、产朊假丝酵母、红法夫酵母。

表1 我国饲料原料和添加剂开发应用的主要酵母菌种
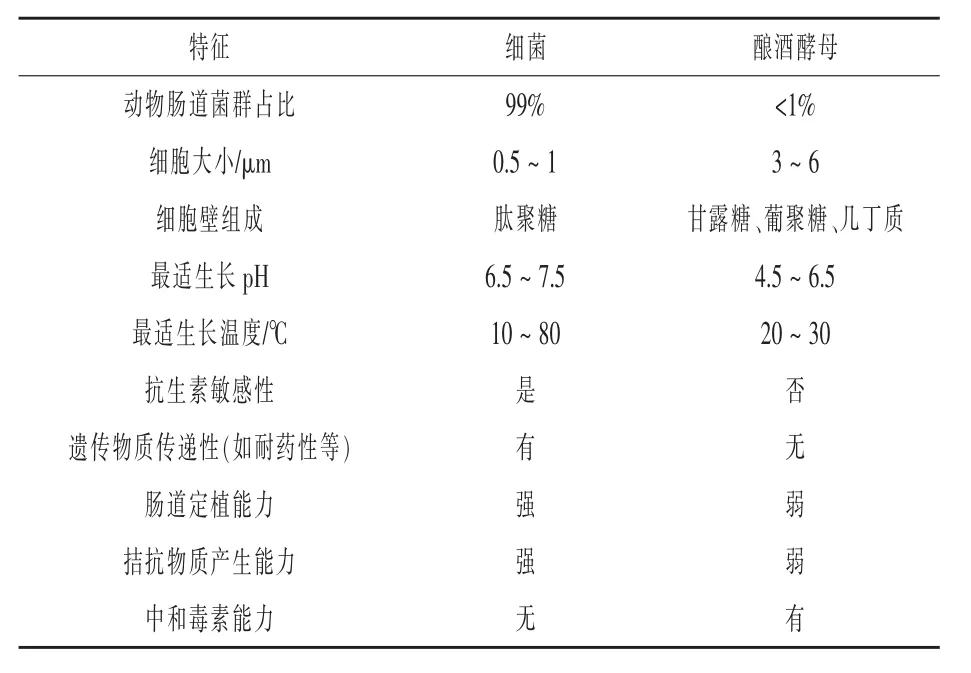
表2 酿酒酵母与细菌比较基本特征的差异
2 酿酒酵母菌株特性与功能
2.1 酿酒酵母菌株特性 酿酒酵母(Saccharomyces cerevisiae)分类地位属于真核域、真菌界、子囊菌门、半子囊菌纲、酵母目、酵母科、酵母属。生长在麦芽汁琼脂培养基上的酿酒酵母菌落为乳白色,有光泽、平坦、边缘整齐;细胞宽度2.5~10 μm,长度 4.5 ~ 21 μm,长与宽之比为 1 ~ 2,多为圆形、卵圆形或卵形;酿酒酵母多以营养体状态进行出芽繁殖,在特定的条件下进行有性繁殖。酿酒酵母与细菌相比,在细胞大小、细胞壁组成、生长温度等方面都有很大差异(表2)。
2.2 酿酒酵母菌株功能 基于酿酒酵母菌株特性,酿酒酵母活菌、非活性成分及细胞组成成分已广泛应用于饲料工业和畜牧养殖业,其功能主要体现在两大方面:(1)活菌可以作为益生菌或发酵菌剂使用;(2)酿酒酵母非活性形式和细胞组分,可以作为酵母有机微量元素、功能性蛋白原料、免疫增强剂、霉菌毒素吸附剂、抑菌促生长剂使用。
酿酒酵母属于兼性厌氧菌,在进入动物胃肠道后,可以消耗胃肠道的氧气,造成厌氧环境,从而促进有益菌群的繁殖,改善动物消化道微生态平衡(潘宝海,2010;王学东,2006)。体外试验研究表明,酿酒酵母还可以有效吸附肠道病原菌(鼠伤寒沙门氏菌)(Tiago,2012)。布拉迪酵母是属于酵母属、酿酒酵母亚种的一种酵母,大部分酿酒酵母最适生长和代谢温度为30℃,而布拉迪酵母菌株具有天然耐热性,在37℃生长良好。目前布拉迪酵母已作为一种非毒性酵母菌,在欧洲、南美、非洲等地区广泛应用于腹泻治疗(McCullough,1998)。 研究表明,布拉迪酵母菌株耐酸性能良好,pH 2条件下1h存活率达75%(Edwardsingram,2007)。布拉迪酵母可以分泌多胺物质(腐胺、精胺和亚精胺),促进动物肠道成熟,增强肠细胞对营养物质的吸收能力(Tovar-Ramaez,2004)。在妊娠和泌乳日粮中添加布拉迪酵母,降低了母猪后肠微生物菌群大肠杆菌和产气荚膜梭菌总数(龙广,2015)。
酿酒酵母可以作为发酵菌剂使用,或与其他益生菌配伍,用于饲用原料的发酵处理,提升原料价值。如利用酿酒酵母固态发酵白酒糟生产蛋白饲料(张轩,2012);利用酿酒酵母菌和植物乳杆菌混合发酵玉米加工副产物(史俊祥,2016);通过酿酒酵母对玉米浆中亚硫酸盐进行无机硫的转化,降低其亚硫酸盐含量(王楠,2015)。采用酿酒酵母(4%)和米曲霉(0.5%)复合菌种发酵豆粕,发酵豆粕中的粗蛋白质和酸溶蛋白分别提高21.27%、695.97%(史玉宁,2017)。
酿酒酵母通过对金属元素的细胞外富集、细胞表面吸附或络合、细胞内富集和转化,可以将金属无机形式转化为有机形式,已实现酵母铬、酵母硒、酵母铁、酵母锰、酵母铜的开发。作为有机微量元素,目前在畜牧养殖中应用最为广泛的是酵母硒。研究表明,与亚硒酸钠相比酵母硒能提高奶牛对养分的消化率以及受胎率,增强机体抗氧化能力,改善泌乳性能(张丽娟,2007)。与亚硒酸钠相比,在母猪饲料中添加酵母硒能显著提高仔猪初生窝重和个体重、断奶窝重和个体重,提高母猪乳汁、仔猪血液、肾脏、肝脏和肌肉中硒的存留量(岳增华,2012)。摄食含酵母硒的饲料,明显降低了猪肉贮藏期间的硫代巴比妥酸值(TBARS)、肌肉的滴水损失(Calvo,2017)。
酿酒酵母富含蛋白质、核酸、维生素、多糖等营养物质,且可以通过菌株筛选方式获得高营养成分的菌株,如高蛋白、高核酸酵母菌株的筛选(陈文明,2015)。将酵母细胞自溶、酶解,可以获得酵母水解物。大量研究表明,酵母水解物作为一种功能性蛋白原料在饲料中使用,在诱食、促生长效果方面作用明显,具有替代血浆蛋白粉、鱼粉的潜力(文超越,2016;郭小云,2015;陈中平,2014;应琳琳,2014)。
酿酒酵母的细胞壁呈三明治结构,内层为β-1,3/1,6-葡聚糖,形成细胞壁的刚性结构,中间层为蛋白质,与甘露聚糖共价结合形成复合物,外层为磷酸甘露聚糖,决定了酵母细胞壁的多孔性。酿酒酵母β-葡聚糖可以活化巨噬细胞、嗜中性粒细胞、自然杀伤细胞以及B、T淋巴细胞,增加细胞因子数量从而发挥免疫调节功能(Cross,2001)。酿酒酵母甘露聚糖具有一定的免疫原性,能够刺激机体产生免疫应答(Halas,2012)。另一方面,酵母细胞壁的特殊空间结构可以通过氢键、离子键和疏水作用力等对霉菌毒素 (如黄曲霉毒素和玉米赤霉烯酮)有效进行吸附(钱潘攀,2017;荣迪,2012)。目前,酵母细胞壁广泛应用于饲用霉菌毒素吸附剂产品开发。其他研究也表明,通过酿酒酵母菌株筛选、制备及提取工艺的优化,可以获得酵母葡聚糖及其衍生物,对金黄色葡萄球菌、沙门氏菌、大肠杆菌等均有抑制作用 (胡骏鹏,2017;Khan,2016;苏亚平,2012)。
3 产朊假丝酵母菌株特性与功能
3.1 产朊假丝酵母菌株特性 产朊假丝酵母(Candida utilis)与酿酒酵母同为农业部批准使用的酵母益生菌,其属于真菌界、真菌门、半知菌亚门、芽孢纲、隐球酵母目、隐球酵母科、假丝酵母属。产朊假丝酵母细胞呈圆形、椭圆形或腊肠形,大小一般为 3.5~ 4.5 μm×7.0~ 13.0 μm;用麦芽汁固体培养基培养的产朊假丝酵母菌落乳白色,表面光滑湿润,边缘整齐或呈菌丝状;以多边出芽方式,进行无性繁殖,形成假菌丝,无有性繁殖或有性孢子。产朊假丝酵母对碳源利用范围广,能利用五碳糖和六碳糖,既能利用糖蜜,还能利用造纸工业的亚硫酸纸浆废液、土豆淀粉废料、木材水解液等。
3.2 产朊假丝酵母菌株功能 产朊假丝酵母菌体蛋白质约占菌体干物质的32%~75%,其含量因菌种、培养条件不同而差异较大,此外还含有细胞壁、核酸、B族维生素、酶等成分。基于产朊假丝酵母菌种的特性,产朊假丝酵母在酵母工业中常被用于生产多种具有功能性的生物物质,例如生产谷胱甘肽(卫功元,2006)、尿酸酶(武文明,2008)。 在饲料工业中,产朊假丝酵母主要是以活菌形式,作益生菌和饲用发酵菌剂使用,或作为单细胞蛋白原料使用。研究表明,饲料中添加产朊假丝酵母,提高了仔鹅生长性能,优化了其盲肠菌群(王劲松,2009)。利用产朊假丝酵母对碳源具有广泛的利用能力,采用产朊假丝酵母与其他益生菌配伍,混合发酵农副产物,可以提高营养价值(其他益生菌将农副产品的结构性碳水化合物进行降解为单糖、双糖等简单糖类物质,产朊假丝酵母再利用这些物质良好地生长繁殖、产代谢产物)。豆渣经产朊假丝酵母与白地霉(75%:25%)混合发酵处理,去除了不良气味、降低了pH、提高粗蛋白质含量(张文佳,2015)。产朊假丝酵母具有丰富的蛋白质,研究表明,其作为单细胞蛋白原料替代40%鱼粉,对大西洋鲑生长性能无显著影响(фverland,2013)。
4 红法夫酵母菌株特性与功能
4.1 红法夫酵母菌株特性 红法夫酵母(Phaffia rhodozyma)是农业部批准的用于饲料添加剂开发的第3种酵母。20世纪70年代在北半球的高海拔和高纬度地区落叶树的渗出物中首先分离获得,其属于真菌界、真菌门、半知菌亚门、担子菌纲、隐球酵母科、法夫酵母属。红法夫酵母主要营养成分为粗蛋白质20%~30%、总碳水化合物40%、脂类17%,其中油酸与亚油酸是最主要的脂肪酸(Rose和 Harrison,1993)。红法夫酵母是一种发酵能产生类胡萝卜素的酵母,野生菌株产生的类胡萝卜素总量为200~500 μg/g干细胞,其中虾青素占40%~95%,虾青素含量的多少依菌种和培养条件不同而异(Andrewes,1976)。
4.2 红法夫酵母菌株功能 红法夫酵母作为虾青素的主要生物性来源,具有发酵周期短、代谢生产速度快、可大规模培养等特点。将红法夫酵母直接添加于饲料中使用,除了提供虾青素外,还可为养殖动物提供蛋白质、多糖、脂类物质等营养成分。研究表明,饲料中添加红法夫酵母,可以明显增加大西洋鲑肌肉色素沉积(Bjerkeng,2007),增加鸡蛋中色素沉积(Akiba,2008),提高猪肉品质(Lei,2014),等。
红法夫酵母具有很高的应用价值,2010年美国食品和药物管理局(FDA)增补红法夫酵母(21 CFR 73.355)用作动物饲料的添加剂。2013年,我国在饲料添加剂目录中,已批准虾青素、红法夫酵母作为水产养殖动物、观赏鱼的着色剂。由于红法夫酵母野生菌株虾青素含量较低,需要通过菌种改良、诱导物诱导、发酵条件优化等策略实现红法夫酵母高产虾青素的目的(吴伟,2011)。
5 展望
利用现代发酵工程,将酵母这一类微生物合理开发获得的饲料蛋白、功能性多糖、有机微量元素、霉菌毒素吸附剂和益生菌等产品,在饲料工业中得到了广泛的应用。总的而言,饲料工业中,对开发酵母源生物饲料所用的酵母菌种,主要有以下5个方面的要求:(1)菌种的安全性,对动物和人的健康无害;(2)菌种可实现生产性,可通过发酵条件的优化,进行大批次发酵培养,遗传性能稳定;(3)菌种具有功能性,菌株本身或代谢产物具有促进动物消化道中有益微生物活性的作用;(4)菌种可以耐受动物体温,并在生产过程中保持理想活性;(5)菌种能适应胃及肠道内较为广泛的酸碱度。
酵母在饲料工业未来的发展,一方面可以依托液态发酵技术,开发活酵母类益生菌产品,及酵母深加工产品(酵母水解物、酵母细胞壁、酵母硒等等);另一方面,可以依托固态发酵技术,将酵母、芽孢杆菌等微生物组合,进行原料发酵处理及粪污处理。未来,需要继续深入挖掘不同酵母菌株的特性,逐步赋予酵母源生物饲料更多的功能,实现酵母在饲料工业中无抗养殖、原料替代、环保减排、畜禽品质提升等方面的应用。
[1]陈良强,吴群,徐岩.酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J].工业微生物,2013,43(3):1 ~ 6.
[2]陈文明,郑国斌,姚娟,等.YE专用高蛋白高RNA酵母菌株的筛选及鉴定[J].食品科技,2015,4:2 ~ 6.
[3]陈中平,李彪.酵母水解物替代血浆蛋白粉对早期断奶仔猪生产性能的影响[J].国外畜牧学(猪与禽),2014,12:37 ~ 38.
[4]胡骏鹏,谢智文,周锋,等.β-葡聚糖抑菌活性及体外抑菌方法研究进展[J].中国饲料,2017,15:36 ~ 38.
[5]郭小云,吴信,谢春艳,等.酵母水解物对早期断奶仔猪生长性能、血清生理生化指标和激素水平以及肠道黏膜形态的影响[J].饲料工业,2015,36(8):61 ~ 64.
[6]郭照宙,许灵敏,宋建楼,等.产朊假丝酵母功能的探究及应用[J].饲料博览,2016,3:33 ~ 35.
[7]李锐利.高产乙酸乙酯酵母的选育及在清香型小曲酒中的应用研究[D].湖北工业大学,2011.
[8]龙广.妊娠和泌乳日粮中添加布拉迪酵母菌对母猪及仔猪性能的影响[D].华中农业大学,2015.
[9]卢翠文.解脂假丝酵母菌发酵条件的研究[J].安徽农业科学,2009,37(14):6337 ~ 6339.
[10]潘宝海,孙鸣,孙冬岩,等.酿酒酵母对仔猪生产性能和消化道微生物区系的影响[J].饲料研究,2010,1:68 ~ 69.
[11]钱潘攀,李红波,赵岩岩,等.双效型酵母细胞壁提取物及其对黄曲霉毒素 B1吸附特性研究[J].食品工业科技,2017,38(15):25 ~ 29.
[12]荣迪.酵母β-D-葡聚糖及衍生物对玉米赤霉烯酮吸附效果的研究[D].华中农业大学,2012.
[13]施安辉,周波.粘红酵母GLR_(513)生产油脂最佳小型工艺发酵条件的探讨[J].食品科学,2003,24(1):48 ~ 51.
[14]史俊祥,齐景伟,安晓萍,等.植物乳杆菌和酿酒酵母菌混合发酵玉米加工副产物的条件筛选[J].饲料研究,2016,2:37~41.
[15]史玉宁,赵鹏娟,陈如水,等.米曲霉和酿酒酵母复合菌种发酵豆粕的研究[J].现代畜牧兽医,2017,6:8 ~ 11.
[16]苏亚平.酵母葡聚糖生产工艺及生物活性研究[D].山东轻工业学院,2012.
[17]唐元家,余柏松.巴斯德毕赤酵母表达系统[J].国外医药(抗生素分册),2002,23(6):246 ~ 250.
[18]王劲松,陈志峰,马志刚,等.益生菌制剂对仔鹅生长性能、血清免疫球蛋白及免疫器官指数的影响 [J].东北农业大学学报,2009,40(11):81 ~ 85.
[19]王楠,许丽,李红宇,等.不同水平酿酒酵母处理玉米浆对玉米秸秆发酵品质的影响[J].中国畜牧杂志,2015,51(17):44 ~ 48.
[20]王学东,呙于明,姚娟,等.活性干酵母对生产母猪生产性能的影响[J].中国饲料,2006,17:57 ~ 57.
[21]卫功元,李寅,堵国成,等.产朊假丝酵母分批发酵生产谷胱甘肽的代谢通量分析[J].化工学报,2006,57(6):1410 ~ 1417.
[22]文超越,李勇,邢伟刚,等.酵母水解物与复合酶制剂或微生态制剂组合替代血浆蛋白粉对保育猪生长性能和血清生化指标的影响[J].动物营养学报,2016,28(12):3988 ~ 3995.
[23]武文明.产朊假丝酵母尿酸酶的纯化、特性研究及其基因扩增[D].重庆医科大学,2008.
[24]吴伟.红法夫酵母发酵生产虾青素过程关键技术的研究[D].华中科技大学,2011.
[25]应琳琳,张杨,陈中平,等.酵母水解物替代血浆蛋白粉对断奶仔猪生产性能的影响[J].中国饲料,2014,13:18 ~ 19.
[26]于景芝.酵母生产与应用手册[M].中国轻工业出版社,2005.
[27]岳增华.不同来源硒对母猪繁殖性能的影响 [J].中国猪业,2012,10:49 ~ 51.
[28]赵国群,刘红彦,刘金龙.高甾醇含量热带假丝酵母细胞的培养条件研究[J].中国酿造,2017,36(2):49 ~ 53.
[29]张轩,赵述淼,陈海燕,等.酿酒酵母固态发酵白酒糟生产蛋白饲料的研究[J].饲料工业,2012,19:27 ~ 31.
[30]张丽娟.酵母硒对奶牛消化、抗氧化和泌乳性能的影响[D].新疆农业大学,2007.
[31]张文佳.产朊假丝酵母和白地霉混合固态发酵豆渣生产反刍动物饲料的研究[D].东北农业大学,2015.
[32]周德庆.微生物学教程-第2版[M].高等教育出版社,2002.
[33]Akiba Y,Sato K,Takahashi K,et al.Pigmentation of egg yolk with yeast Phaffia rhodozyma containing high concentration of astaxanthin in laying hens fed on a low-carotenoid diet.[J].Japanese Poultry Science,2008,37(2):77 ~ 85.
[34]Andrewes A G,Phaff H J,Starr M P,et al.Carotenoids of Phaffia rhodozyma,a red-pigmented fermenting yeast[J].Phytochemistry,1976,15(6):1003 ~ 1007.
[35]Bjerkeng B,Peisker M,Schwartzenberg K V,et al.Digestibility and muscle retention of astaxanthin in Atlantic salmon,Salmo salar,fed diets with the red yeast Phaffia rhodozyma,in comparison with synthetic formulated astaxanthin[J].Aquaculture,2007,269(1 ~ 4):476~489.
[36]Calvo L,Toldrá F,Rodríguez A I,et al.Effect of dietary selenium source (organic vs.mineral) and musclepHon meat quality characteristics of pigs:[J].Food Science&Nutrition,2017,5(1):94 ~ 102.
[37]Cross G G,Jennings H J,Whitfield D M,et al.Immunostimulant oxidized β-glucan conjugates[J].International immunopharmacology,2001,1(3):539 ~ 550.
[38]Edwardsingram L,Gitsham P,Burton N,et al.Genotypic and Physiological Characterization of Saccharomyces boulardii,the Probiotic Strain of Saccharomyces cerevisiae[J].Appl Environ Microbiol,2007,73(8):2458 ~ 2467.
[39]Halas V,Nochta I.Mannan Oligosaccharides in Nursery Pig Nutrition and Their Potential Mode of Action[J].Animals An Open Access Journal from Mdpi,2012,2(2):261 ~ 274.
[40]Khan A A,Gani A,Masoodi F A,et al.Structural,thermal,functional,antioxidant&antimicrobial properties of β -D-glucan extracted from baker's yeast (Saccharomyces cereviseae)—Effect of γirradiation[J].Carbohydrate Polymers.2016,140:442 ~ 450.
[41]Lei Y,Kim I H.Effect of Phaffia rhodozyma on performance,nutrient digestibility,blood characteristics,and meat quality in finishing pigs[J].Journal of Animal Science,2014,92(1):171 ~ 176.
[42]McCullough M J,Clemons K V,McCusker J H,and D.A.Stevens.Species identification and virulence attributes ofSaccharomyces boulardii(nom.inval.)[J].J.Clin.Microbiol.1998,36:2613 ~ 2617.
[43]фverland M,Karlsson A,Mydland L T,et al.Evaluation of Candida utilis,Kluyveromyces marxianus,and Saccharomyces cerevisiae,yeasts as protein sources in diets for Atlantic salmon(Salmo salar)[J].Aquaculture,2013,s 402 ~ 403(14):1 ~ 7.
[44]Rose A H,Harrison J S.The yeasts.Volume 5:yeast technology.[M].1993.
[45]Tiago F C,Martins F S,Souza E L,et al.Adhesion to the yeast cell surface as a mechanism for trapping pathogenic bacteria by Saccharomyces probiotics[J].Journal of Medical Microbiology,2012,61(Pt 9):1194 ~ 1207.
[46]Tovar-RamíRez D,Infante J Z,Cahu C,et al.Influence of dietary live yeast on European sea bass(Dicentrarchus labrax)larval development[J].Aquaculture,2004,234(1):415 ~ 427.
