益生菌混合培养物对黄曲霉菌生长以及产毒效果的影响
2018-07-05隋明
隋 明
(1.四川工商职业技术学院,四川都江堰 611830;2.四川大学轻纺与食品学院,四川成都 610000)
黄曲霉毒素主要由曲霉属真菌中黄曲霉菌和寄生曲霉菌在生长过程中产生的一种次生代谢产物,广泛存在环境中的土壤、植物果实中,主要以发霉及污染的玉米和花生中含量较高,黄曲霉毒素对人和动物具有致畸、致癌、致突变作用(Zhou,2017;WU,2015)。黄曲霉毒素主要包括 B1、B2、G1等10多种,其中以黄曲霉毒素B1毒性最强,当食品和饲料中的黄曲霉毒素超标时,会引发人和动物发生急性中毒,给人和动物的健康造成严重的威胁(张焕,2017;刘晓玥,2017)。益生菌主要包括乳酸杆菌、枯草芽孢杆菌、尿肠球菌、双歧杆菌等多种,这些不同类型的益生菌主要存在于人和动物体内,这些不同类型的益生菌具有调整胃肠道内菌群动态平衡,抑制腐败菌生长,提高消化功能及免疫力作用(孙雯娟,2015)。许多研究表明,乳酸杆菌等多种益生菌对黄曲霉毒素B1有一定的吸附与抑制作用(吴珊,2016;尹胜利,2012)。目前关于富含硒乳酸杆菌、枯草芽孢杆菌抑制黄曲霉菌生长和产毒效果研究比较多,不同类型益生菌混合物对黄曲霉菌抑制作用研究较少。因此,本试验研究了乳酸杆菌、枯草芽孢杆菌、尿肠球菌3种益生菌的混合培养物对黄曲霉菌生长及产毒效果的影响,为进一步研发黄曲霉菌复合益生菌抑制剂提供依据。
1 材料
1.1 试验菌株 枯草芽孢杆菌菌株、乳酸杆菌菌株、尿肠球菌菌株、产毒黄曲霉菌CGMCC3.4408标准菌株均由四川大学轻纺与食品学院实验室保存。
1.2 试剂与仪器 MRS培养基、PDA培养基、察氏培养基、产毒培养基均购自北京奥星生物技术公司;AFB1检测试剂盒购自南京建成生物工程研究所。隔水式恒温培养箱由上海恒科学仪器有限公司生产;全波长酶标仪由德国Eppendour公司生产;常规试剂及仪器由本实验室提供。
2 方法
2.1 不同类型的益生菌培养与计数 乳酸杆菌种接种于MRS液体培养基中,37℃培养24~48 h,用MRS培养基调整菌液浓度为1×108cfu/mL;枯草芽孢杆菌菌株复苏后接种于LB液体培养基,37℃振荡培养12 h后,接种在MRS培养基中增殖3代后,进行计数,用MRS培养基调整菌液浓度为1×108cfu/mL;尿肠球菌菌株接种于MRS液体培养基,37℃静置培养14 h,连续增殖三代,用MRS液体培养基调整菌液浓度为1×108cfu/mL;将乳酸杆菌和枯草芽孢杆菌、乳酸杆菌和尿肠球菌均按照1∶1比例制成益生菌混合培养物。
2.2 黄曲霉菌孢子计数 黄曲霉菌CGMCC3.4408标准菌株接种于PDA培养基上,28℃培养4~8 d后,再进行扩大培养的黄曲霉菌培养基,加入一定量的无菌的PBST缓冲液,将黄曲霉菌菌落洗下,收集到离心管中,用无菌的PBST洗涤3次后(8000 r/min离心5 min),再用无菌纱布过滤3次除去黄曲霉菌孢子的菌丝,进行计数。用无菌的PBST调整黄曲霉菌孢子浓度为1×108cfu/mL备用。
2.3 黄曲霉菌菌落生长抑制率测定 取乳酸杆菌和枯草芽孢杆菌混合培养物、乳酸杆菌和尿肠球菌混合培养物各1 mL,分别涂布于PDA培养基上,空白对照组在PDA培养基上涂布乳酸杆菌,待完全被吸收后,在PDA培养基中心接种20 μL黄曲霉菌孢子悬液(1×108cfu/mL),28 ℃进行培养,分别在黄曲霉菌培养48、72、96 h后测量菌落大小。每种益生菌做10个重复,对10个重复结果的平均值进行统计,计算不同益生菌对霉菌生长的抑制率。
黄曲霉菌生长抑制率/%=(空白对照组菌落直径-试验组菌落直径)/空白对照组菌落直径×100。
2.4 黄曲霉菌孢子生长抑制率测定 取5 mL的察氏培养基分别加入等量的乳酸杆菌和枯草芽孢杆菌混合培养物、乳酸杆菌和尿肠球混合培养物,空白对照组加入等量的乳酸杆菌,分别接种500 μL的黄曲霉胞子孢液(1×108cfu/mL),每种益生菌做10个重复,28℃振荡培养,分别在培养 6、18、24 h后取出每种益生菌培养液各0.1 mL均匀涂布于PDA平板,28℃培养4~8 d后,对黄曲霉菌孢子进行计数。黄曲霉菌孢子生长抑制率计算公式为:
抑制率/%=(空白对照组孢子数-试验组孢子数)/空白对照组孢子数×100。
2.5 黄曲霉菌产毒量的测定 无菌的条件下,在产毒培养基中均匀涂布2 mL甘油水溶液,待液体完全被吸收,分别接种黄曲霉菌孢子生长抑制率试验中,将乳酸杆菌和枯草芽孢杆菌混合培养物、乳酸杆菌和尿肠球混合培养物培养6、18、24 h后的培养液0.1 mL分别接种于产毒培养基中,35℃恒温培养15~20 d;空白对照组,将无菌的生理盐水和黄曲霉胞子孢液(1×108cfu/mL)按照 1∶1 比例配合均匀后,取0.1 mL用同样方法接种于产毒培养基中,35℃恒温培养15~20 d。试验结束后提取黄曲霉菌,并按照AFB1检测试剂盒进行测定其产毒量。霉菌产毒量抑制率/%=(空白对照组产毒量-试验组产毒量)/空白对照组产毒量×100。
2.6 数据处理与分析 试验结果以 “平均值±标准差”表示,试验数据采用SPSS 19.0软件进行单因素方差分析,采用Duncan’s法进行均值比较,以P<0.05表示差异显著。
3 结果与分析
3.1 黄曲霉菌菌落生长抑制率测定结果 由表1可知,在培养48 h时,乳酸杆菌和尿肠球菌混合物组、乳酸杆菌和枯草芽孢杆菌混合物组黄曲霉菌菌落生长率均高于乳酸杆菌组,但是差异性不显著(P > 0.05);在培养 72、96 h 时,乳酸杆菌和尿肠球菌混合物组、乳酸杆菌和枯草芽孢杆菌混合物组黄曲霉菌菌落生长率均高于乳酸杆菌组,分别提高了 27.1%、49.6%、42.1%、61.6%(P <0.05),乳酸杆菌和尿肠球菌混合物组、乳酸杆菌和枯草芽孢杆菌混合物组相比较差异性不显著(P > 0.05)。
3.2 黄曲霉菌孢子生长抑制率测定结果 由表2可知,在培养6、18、24 h时,乳酸杆菌和尿肠球菌混合物组、乳酸杆菌和枯草芽孢杆菌混合物组黄曲霉菌孢子的抑制率均高于乳酸菌组,差异性不显著(P>0.05),乳酸杆菌和尿肠球菌混合物组与乳酸杆菌和枯草芽孢杆菌混合物组相比,差异性显著(P<0.05),乳酸杆菌和枯草芽孢杆菌混合物组与乳酸杆菌组相比,分别提高了35.4%、16.2%、21.1%。

表1 不同类型益生菌组黄曲霉菌菌落生长抑制率测定结果%

表2 不同类型益生菌组黄曲霉菌孢子生长抑制率测定结果%
3.3 黄曲霉菌产毒量的测定结果 由表3可知,在培养6 h时,乳酸杆菌和尿肠球菌混合物组与乳酸杆菌和枯草芽孢杆菌混合物组黄曲霉菌产毒量抑制率均高于乳酸菌组,差异性不显著(P>0.05),在培养18、24 h时,乳酸杆菌和尿肠球菌混合物组与乳酸杆菌和枯草芽孢杆菌混合物组黄曲霉菌产毒量抑制率均高于乳酸杆菌组,分别提高了24.5%、41.9%、55.2%、65.4%(P < 0.05), 乳酸杆菌和尿肠球菌混合物组与乳酸杆菌和枯草芽孢杆菌混合物组之间相比差异性不显著(P>0.05)。
4 讨论
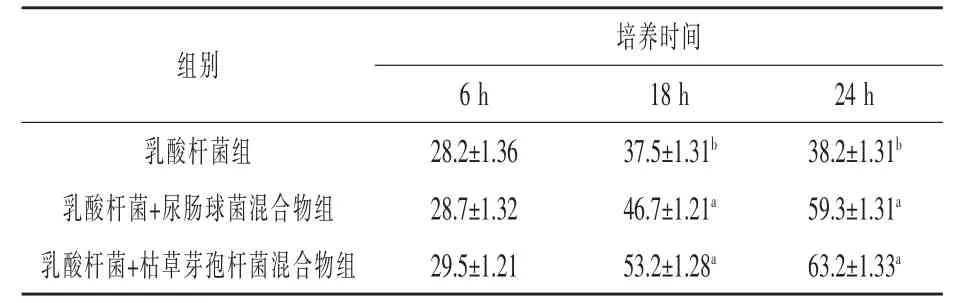
表3 不同类型益生菌黄曲霉菌产毒量测定结果%
益生菌是一种活的微生物,主要存在于人和动物消化道内,其中主要包括乳酸菌、芽孢杆菌、尿肠球菌、酵母菌和霉菌等,被广泛应用于人们食品和动物的饲料中(胡治铭,2016)。研究表明,益生菌具有改善人和动物体内菌群的平衡、提高动物的饲料利用率、促进动物的生长及净化养殖环境等多种优点,被广泛应用于畜禽的健康养殖中(Gold,2012)。动物的黄曲霉毒素中毒主要来源是饲料,在饲料生产中可能使用霉变饲料原料,当动物采食了霉变饲料,使动物呈现全身中毒的状态,严重者可导致死亡(张焕,2017)。
目前,黄曲霉毒素清除方法主要包括物理方法、化学方法和生物去毒法,其中生物去毒法被广泛应用(李庄悦,2017)。许多研究表明了益生菌对黄曲霉毒素具有一定吸附作用,其中乳酸杆菌研究比较多。Eraslan(2005)等研究表明,在黄曲霉菌培养过程中添加乳酸菌可以抑制黄曲霉菌生长。姚婉(2016)等报道,富硒乳酸菌对黄曲霉菌生长以及产毒具有很好抑制效果。枯草芽孢杆菌和屎肠球菌为动物肠道益生菌,这些益生菌可以合成或者分泌多种酶类物质,这些酶类物质不仅可以促进营养物质的吸收,还可以抑制肠道内条件致病菌生长,并且以黏附抗性和竞争排斥限制有害菌体和毒素(吴珊,2016;胡治铭,2016)。国内关于乳酸杆菌和枯草芽孢杆菌及尿肠球菌混合培养物对黄曲霉菌生长及产毒抑制鲜见报道。因此,本试验将将乳酸杆菌、枯草芽孢杆菌、尿肠球菌活化后进行培养,调整浓度为1×108cfu/mL,将乳酸杆菌和枯草芽孢杆菌、乳酸杆菌和尿肠球菌均按照1∶1比例制成益生菌混合培养物,并以乳酸杆菌作为对照,进一步探讨混合培养物对黄曲霉菌生长及产毒影响。结果显示,乳酸杆菌和枯草芽孢杆菌混合培养物组黄曲霉菌菌落生长抑制率、黄曲霉菌孢子生长抑制率及黄曲霉产毒量均高于乳酸杆菌组,差异性显著(P<0.05),因此,证实了乳酸杆菌和枯草芽孢杆菌混合培养物对黄曲霉菌具有很好的抑制作用,并且两种益生菌具有协同作用。可能由于枯草芽孢分泌的多种活性化学物质,可抑制黄曲霉菌的生长,分解黄曲霉菌所产生的毒素,因而提高了对黄曲霉菌菌落和生长抑制率及产毒量抑制率。本试验为食品及饲料中黄曲霉菌有效防控提供依据。
[1]胡治铭,梁丛丛,国洪旭,等.屎肠球菌和枯草芽孢杆菌混合培养条件的优化[J].食品与生物技术学报,2016,35(5):537 ~ 542.
[2]李庄悦,李宇.黄曲霉及其毒素污染的防控技术研究新进展[J].现代农业科技,2017,14:197 ~ 199+203.
[3]刘晓玥,侯亚楠,吕丽卿.饲料中黄曲霉毒素B1快速筛查胶体金免疫层析检测方法应用研究[J].吉林农业,2017,18:64~65.
[4]孙雯娟,张波,李大魁,等.益生菌制剂的发展现状与临床应用进展[J].中国医院药学杂志,2015,35(9):850 ~ 857.
[5]吴珊.含硒枯草芽孢杆菌特性研究和抗菌性应用[D].湖北工业大学,2016.
[6]姚婉,赵方红,刘丽娜,等.不同浓度硒含量的富硒乳酸菌抑制黄曲霉菌生长以及产毒效果的研究[J].中国饲料,2016,12:19~21+26.
[7]尹胜利,杜鉴,徐晨.乳酸菌的研究现状及其应用[J].食品科技,2012,37(9):25 ~ 29.
[8]岳晓禹,陈威风,邹健,等.黄曲霉毒素B1降解菌活性产物的提取及其应用性质研究[J].食品工业科技, 2017, 38(20):137 ~ 140+158.
[9]张焕,王加启,高亚男,等.霉菌毒素对畜禽的危害及其毒性降解研究进展[J].中国饲料, 2017,4:12 ~ 16.
[10]Eraslan G,Akdogan M,Yarsan E,et al.The effects of aflatoxin on oxidative stress in broiler chicks[J].Turkish Journal of Veterinary and Animal Sciences,2005,29:701 ~ 707.
[11]Gold M A,Brady W E,Lankes H A,et al.A phase II study of a urokinase-derived peptide(A6)in the treatment of persistent orrecurrent epithelial ovarian,fallopian tube,or primary peritoneal carcinoma:a gynecologic oncology group study[J].Gynecol Oncol,2012,125(3):635 ~ 639.
[12]WU F.Global impacts of aflatoxin in maize:Trade and Human Health[J].World Mycotoxin,2015,8:137 ~ 142.
[13]Zhou G,CHEN Y,KONG Q,et al.Detoxification of AflatoxZygosaccharomycesrouxii with Solid State Fermentation inPeanut Meal[J].Toxins.2017,9(1):42 ~ 51.
