汉防己甲素衍生物HL-27对BLM解旋酶生物学特性的影响
2018-07-04张望明葛章文晏文涛潘卫东焦彦朝刘杰麟
张望明,葛章文,晏文涛,潘卫东,焦彦朝,刘杰麟
(1.贵阳中医学院第一附属医院检验科,贵州 贵阳 550001;2.贵州省人民医院检验科,贵州 贵阳 550002;3.贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550002;4.贵州出入境检验检疫局综合技术中心,贵州 贵阳 550004;5.贵州医科大学组织工程与干细胞实验中心,贵州 贵阳 550004;6.贵州医科大学免疫学教研室,贵州 贵阳 550004)
RecQ解旋酶家族是解旋酶第二大超家族中最保守的一个家族,RecQ解旋酶家族在各种生物体遗传稳定性的维持中发挥着非常重要的作用[1]。RecQ解旋酶家族成员均具有相同的保守区,分别为解旋功能区、RecQ-C功能区、HRDC功能区。人体内存在着RecQl、BLM、WRN、RecQ4和RecQ5共5种RecQ解旋酶,其中3种编码基因BLM、WRN、RECQ4缺陷将会导致人类相应疾病的发生,分别为Bloom综合征、Wemer综合征、Rothmund-Thomson综合征。这些疾病的患者存在易患癌症的共同特征,Bloom综合征患者表现为一系列癌症的高发病率。在细胞周期中,RecQ解旋酶参与了复制、重组和修复等DNA代谢过程,而染色体数目和结构的改变是肿瘤细胞的一种非常重要的细胞遗传学表现。RECQ1的功能除了参与对基因调控,它也有助于肿瘤的发生和发展,也就是说它可以通过调控关键基因的表达来促进肿瘤细胞迁移和侵袭。沉默RecQ1的基因表达可以明显减少肿瘤细胞的增殖、迁移和侵袭[2]。Sanada等[3]研究发现,RecQ1在生长迅速的乳腺癌细胞中呈高表达,RecQ1-siRNA干扰后能抑制乳腺癌细胞生长。人BLM解旋酶表达在许多种淋巴细胞和上皮细胞来源的肿瘤中,在BLM表达活性和细胞增殖之间存在很强的关联性,在肿瘤中,BLM表达水平高于正常组织[4-5]。在食道鳞癌细胞中,BLM表达上调了2.927倍[6]。因此,以BLM解旋酶作为靶标来筛选抗肿瘤药物为癌症的治疗提供了新思路。
近年来,利用RecQ解旋酶活性抑制模型筛选具有潜在抗癌作用的小分子物质的研究已有报道,Monika等[7]发现,NSC 19630(1-丙氧基甲基马来酰亚胺)可以抑制WRN解旋酶活性。段丽霞等[8]发现,丙酸睾酮对大肠杆菌RecQ解旋酶活性有抑制作用。文献记载,双苄基异喹啉生物碱类具有抗肿瘤作用,现已作为候选抗癌药物进行研究开发。汉防己甲素属于双苄基异喹啉生物碱类,且临床观察表明,此药毒性低、副作用小,无其它抗肿瘤药物引起的骨髓抑制作用。周林云等[9]发现,汉防己甲素对乳腺癌MCF-7细胞增殖具有抑制作用。另有研究发现,汉防己甲素能够抑制结肠癌细胞的增殖[10-11]。本实验运用荧光偏振、自由磷检测、紫外光谱等技术,研究汉防己甲素衍生物HL-27对BLM解旋酶生物学特性的影响,对阐明汉防己甲素衍生物HL-27与BLM解旋酶作用的分子机制具有一定意义,为该小分子物质进行抗癌研究奠定基础。
1 材料与方法
1.1药物与试剂汉防己甲素衍生物HL-27:贵州省中国科学院天然产物化学重点实验室潘卫东研究员提供;45 nt单链DNA(single stranded DNA,ssDNA):5′-AATCCGTCGAGCAGAGTTAGGTTAGGTTAG GTTAGTTTTTTTTTT-3′)和用荧光素标记的21 nt单链DNA(3′-FAM-TTAGGCAGCTCGTCTCAATCC-5′)由北京鼎国昌盛生物技术有限责任公司合成,两条互补ssDNA在缓冲液(20 mmol·L-1Tris、100 mmol·L-1NaCl,pH 7.9)中等量混合,经85℃水浴5 min,缓慢冷却至室温,复性后的双链DNA(double stranded DNA,dsDNA)用作检测BLM解旋酶DNA结合活性和解链活性的底物;重组大肠杆菌pET-15b-BLM642-1290-BL21-CodonPlus,法国巴黎第十一大学居里研究所奚绪光主任研究员馈赠。实验所用化学试剂均为分析纯,整个实验过程所用超纯水由Milli-Q超纯水系统制备。
1.2仪器AKTA purifier 100蛋白质分离纯化系统(美国GE Healthcare公司);VCX-500超声波破碎仪(美国SONICS公司);Synergy 4多功能酶标仪(美国BIO-TEK公司);Beacon 2000 荧光偏振仪(美国PanVera公司);UV-3600紫外可见分光光度计(日本SHIMADZU公司); Milli-Q超纯水系统(美国Millipore Corp公司)。
1.3方法
1.3.1BLM642-1290解旋酶的表达、纯化 将重组大肠杆菌pET-15b-BLM642-1290-BL21-CodonPlus接种于LB培养基(含50 mg·L-1氨苄青霉素+30 mg·L-1氯霉素),37℃、190 r·min-1培养至OD600值达到0.5~0.6。18℃、190 r·min-1条件下经0.4 mmol·L-1IPTG诱导BLM解旋酶表达20 h,然后4℃、4 000 r·min-1离心20 min,收集菌体。超声破碎,4℃、13 000 r·min-1离心40 min,收集上清液,再经镍离子亲和层析柱和凝胶过滤层析柱分离纯化,获得可用于开展酶生物学特性研究的重组BLM642-1290解旋酶。
1.3.2HL-27对BLM642-1290解旋酶DNA结合活性影响的检测 利用荧光偏振法测定HL-27对DNA与BLM解旋酶结合活性的影响。取终浓度为2 nmol·L-1的荧光素标记DNA[dsDNA或ssDNA(21 nt)]于反应缓冲液(20 mmol·L-1Tris、25 mmol·L-1NaCl、3 mmol·L-1MgCl2、0.1 mmol·L-1DTT,pH 7.9)中,置于荧光偏振仪中检测荧光偏振值至稳定;然后加入不同终浓度(0~33.34 μmol·L-1)的HL-27,测定荧光偏振值至稳定;再加入终浓度为500 nmol·L-1的BLM解旋酶使DNA底物饱和,测定荧光偏振值至稳定。记录各反应体系的荧光偏振值。本实验中通过调节ddH2O的体积,使反应体系的总体积保持在150 μL。实验数据都经过3次重复实验确定无误。
1.3.3HL-27对BLM642-1290解旋酶解链活性影响的检测 利用荧光偏振法测定HL-27对BLM解旋酶解链活性的影响。取终浓度为2 nmol·L-1荧光标记dsDNA于反应缓冲液(20 mmol·L-1Tris、25 mmol·L-1NaCl、3 mmol·L-1MgCl2、0.1 mmol·L-1DTT,pH 7.9)中,置于荧光偏振仪中检测荧光偏振值至稳定;将终浓度为500 nmol·L-1的BLM解旋酶与不同终浓度(0~50 μmol·L-1)的HL-27混匀,室温孵育5 min,加入测定管中,测定荧光偏振值至稳定;再加入终浓度为0.2 mmol·L-1的ATP,测定荧光偏振值至稳定。记录荧光偏振值。实验中通过调节ddH2O的体积,保持反应体系总体积为150 μL。实验数据都经过3次重复实验确定无误。
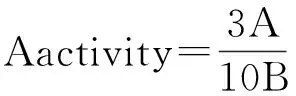
式中,A是根据标准曲线得出的磷酸盐浓度(μmol·L-1);B是反应时间(min)。相对ATPase活力=BLM解旋酶经过处理后的ATPase活力/未经处理的ATPase活力×100%。
1.3.5HL-27对BLM642-1290解旋酶紫外光谱影响的检测 保持BLM解旋酶终浓度为500 nmol·L-1与不同终浓度(0~50 μmol·L-1)的HL-27置于Tris-HCl缓冲液(pH 7.9)中,维持反应体系总体积为3 mL。置于紫外分光光度计测量室中,设定扫描波长间隔为0.5 nm,扫描速度为中等速度,于220~380 nm波段下进行波段扫描,每3 min扫描1次直至平衡。根据峰形和峰位的变化即可判定蛋白质的构象是否发生变化[12]。再用同样的方法扫描不同终浓度(0~50 μmol·L-1)的HL-27在缓冲液中的紫外吸收光谱。
2 结果
2.1HL-27对BLM642-1290解旋酶DNA结合活性的影响通过Fig 1A、1C可知,HL-27能够与dsDNA或ssDNA(21nt)结合并形成复合物。通过Fig 1B、1D可知,HL-27作用于dsDNA或ssDNA(21nt)后可以抑制其与BLM解旋酶的结合。当HL-27浓度达到33.34 μmol·L-1时,HL-27对dsDNA或ssDNA(21nt)与BLM解旋酶结合活性的抑制率分别达到41.35%、59.54%。HL-27对ssDNA(21nt)与BLM解旋酶结合活性的抑制要强于其对dsDNA与BLM解旋酶结合活性的抑制。
2.2HL-27对BLM642-1290解旋酶解链活性的影响通过Fig 2A、2B可知,HL-27可以强烈抑制BLM解旋酶的解链活性。当HL-27浓度达到50 μmol·L-1时,HL-27对BLM解旋酶解链活性的抑制率为78.68%。由Fig 2B还可知,HL-27对BLM解旋酶的解链速率亦有抑制作用。
2.3HL-27对BLM642-1290解旋酶ATPase活性的影响当HL-27的浓度达到100 μmol·L-1时,HL-27对BLM解旋酶ATPase活性的抑制率为43.8%(Fig 3)。
2.4HL-27对BLM642-1290解旋酶紫外光谱的影响通过Fig 4B、4C、4D可知,BLM解旋酶与HL-27作用后,在237 nm和277 nm两波长处所产生的紫外光吸收值明显高于HL-27、BLM解旋酶在237 nm和277 nm两波长处的紫外光吸收值之和(BLM解旋酶的生色基团被翻转到极性较大的区域[12])。通过Fig 4A可知,随着HL-27浓度的增加,BLM解旋酶与HL-27作用后237 nm与277 nm波长处所产生的紫外吸收峰值不断增大。综合以上结果可知,HL-27可以与BLM解旋酶结合,并使其构象发生改变。
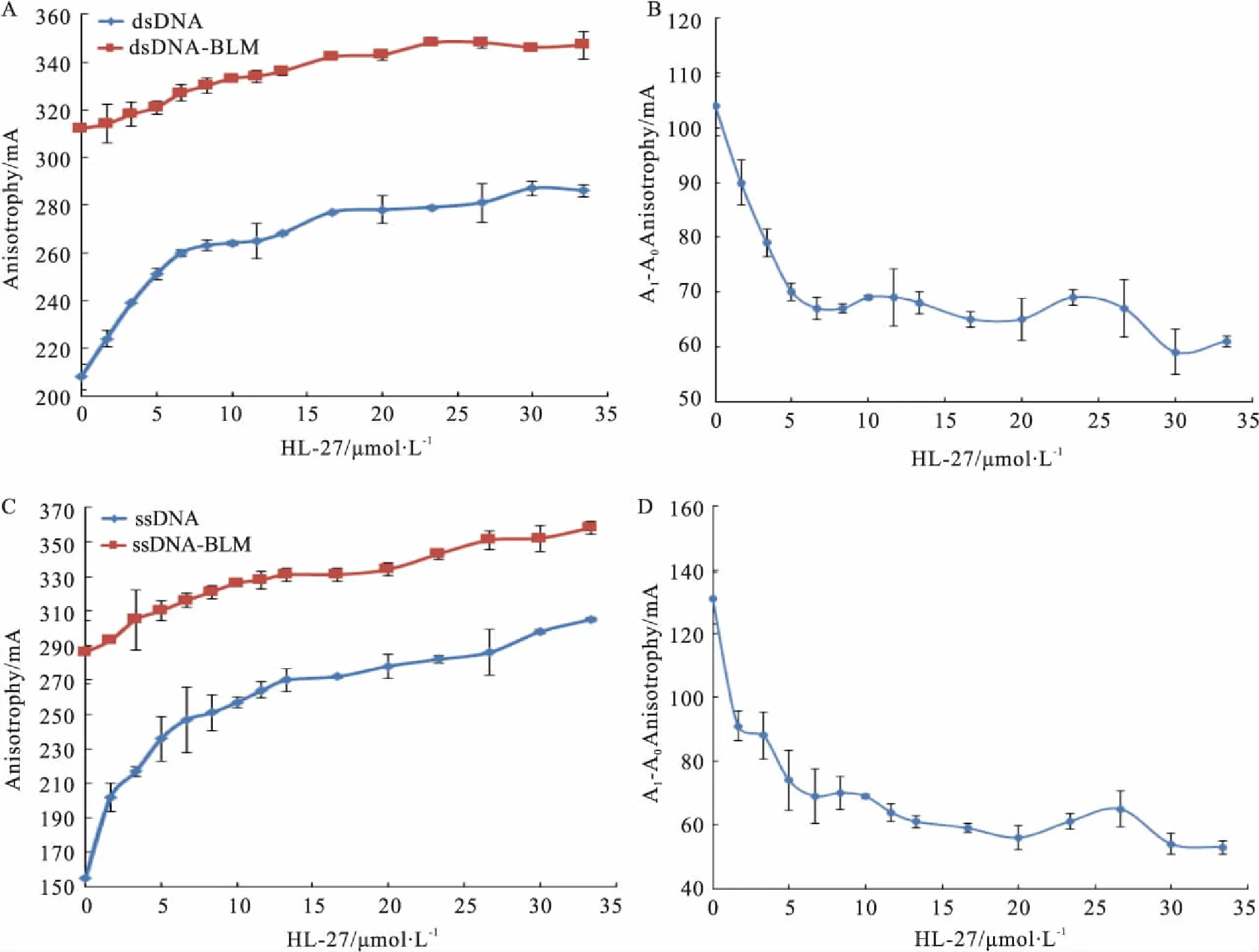
Fig 1 Effects of HL-27 on DNA-binding activity of BLM helicase
A:Effects of HL-27 on dsDNA and the fluorescence anisotrophy of complexes formed by BLM binding HL-27-dsDNA; B:Effects of HL-27 on the dsDNA-binding activity of BLM helicase; C:Effects of HL-27 on ssDNA(21 nt) and the fluorescence anisotrophy of complexes formed by BLM binding HL-27-ssDNA(21 nt); D:Effects of HL-27 on the ssDNA(21 nt)-binding activity of BLM helicase. A0is the fluorescence anisotrophy of DNA binding HL-27; A1is the fluorescence anisotrophy of complexes formed by BLM binding DNA and HL-27.
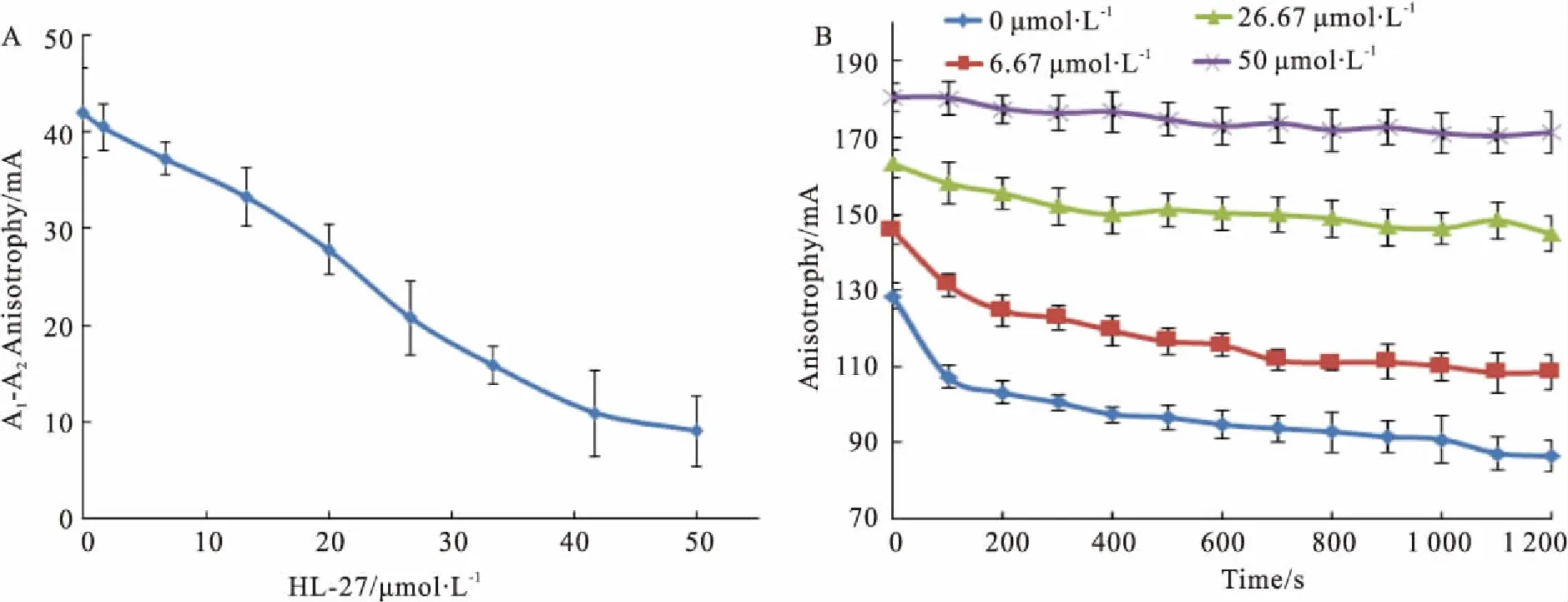
Fig 2 Effects of HL-27 on unwinding activity of BLM helicase
A:The effects of HL-27 on the unwinding activity of BLM helicase; B:The effects of 6.67, 26.67 and 50 μmol·L-1HL-27 on the unwinding time curve of BLM helicase. A1is the fluorescence anisotrophy of BLM binding DNA and HL-27; A2is the fluorescence anisotrophy after the addition of 0.2 mmol·L-1ATP.
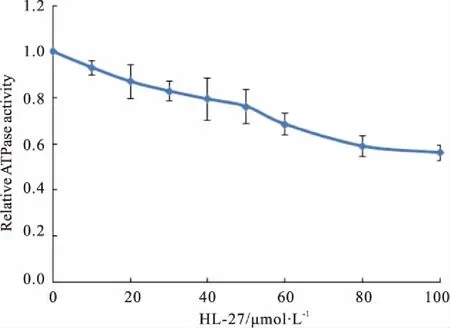
Fig 3 Effects of HL-27 on ATPase activity of BLM helicase
3 讨论
RecQ解旋酶在DNA的复制、转录、修复、重组以及端粒的维持等细胞代谢过程中都发挥着非常重要的作用[13]。解旋酶的生化活性是其能够发挥这些重要功能的基础,解旋酶与dsDNA结合是其发挥解链功能的第一步,在与DNA结合后解旋酶具有DNA依赖的ATP酶活性,能水解ATP产生能量,在此基础上解旋酶将dsDNA解开。
荧光偏振技术是本课题研究中所用到的最为重要的技术。Weber[14-15]发明了第一台荧光偏振仪器。Dandliker等[16]将荧光偏振技术应用到生物系统中,如抗原-抗体反应、激素-受体反应。Jolley等[17]将荧光偏振法应用于治疗药物的监测。目前,荧光偏振技术被广泛应用于荧光免疫分析、药物筛选、测定蛋白质-核酸及蛋白质-蛋白质的相互作用等领域。荧光偏振技术应用于该研究,能够实时跟踪检测药物分子与DNA的相互作用、DNA与药物分子作用后对BLM解旋酶结合DNA的影响,以及药物对BLM解旋酶解开dsDNA的影响。
本研究发现,汉防己甲素衍生物HL-27与荧光素标记的ssDNA、dsDNA均能发生结合。HL-27结合DNA后对DNA结构进行修饰,从而影响BLM解旋酶与之结合。当HL-27浓度为33.34 μmol·L-1时,其对BLM解旋酶结合dsDNA活性的抑制率为41.35%,而对BLM解旋酶结合ssDNA活性的抑制率达59.54%。说明HL-27对BLM解旋酶结合ssDNA的抑制作用要强于dsDNA。BLM解旋酶的ATPase活性依赖于其结合DNA的能力[18],因此,我们检测了HL-27对BLM解旋酶ATPase活性的影响。结果发现,HL-27对BLM解旋酶的ATPase活性有较强的抑制作用,这与其抑制BLM解旋酶结合DNA活性是相符的。BLM解旋酶依赖其ATPase活性水解ATP为其解链DNA提供能量[19],本研究发现,HL-27对BLM解旋酶的DNA解链活性亦有较强的抑制作用,这与其对BLM解旋酶ATPase活性的抑制亦是相符的。
本实验通过研究HL-27对 BLM解旋酶的紫外吸收光谱的影响发现,HL-27能与BLM解旋酶结合并使其构象发生改变。HL-27对BLM解旋酶构象变化的影响在HL-27浓度为0.1 μmol·L-1时就很明显,这与其对BLM解旋酶活性的抑制浓度范围存在较大差异。原因可能是HL-27在较低的浓度下虽可使BLM解旋酶构象发生一定程度的改变,但还不足以引起BLM解旋酶活性的变化。当HL-27达到较高浓度时,HL-27通过较大程度地改变BLM解旋酶的构象,才使得其结合DNA活性被抑制,进而抑制其ATPase活性与解链活性。
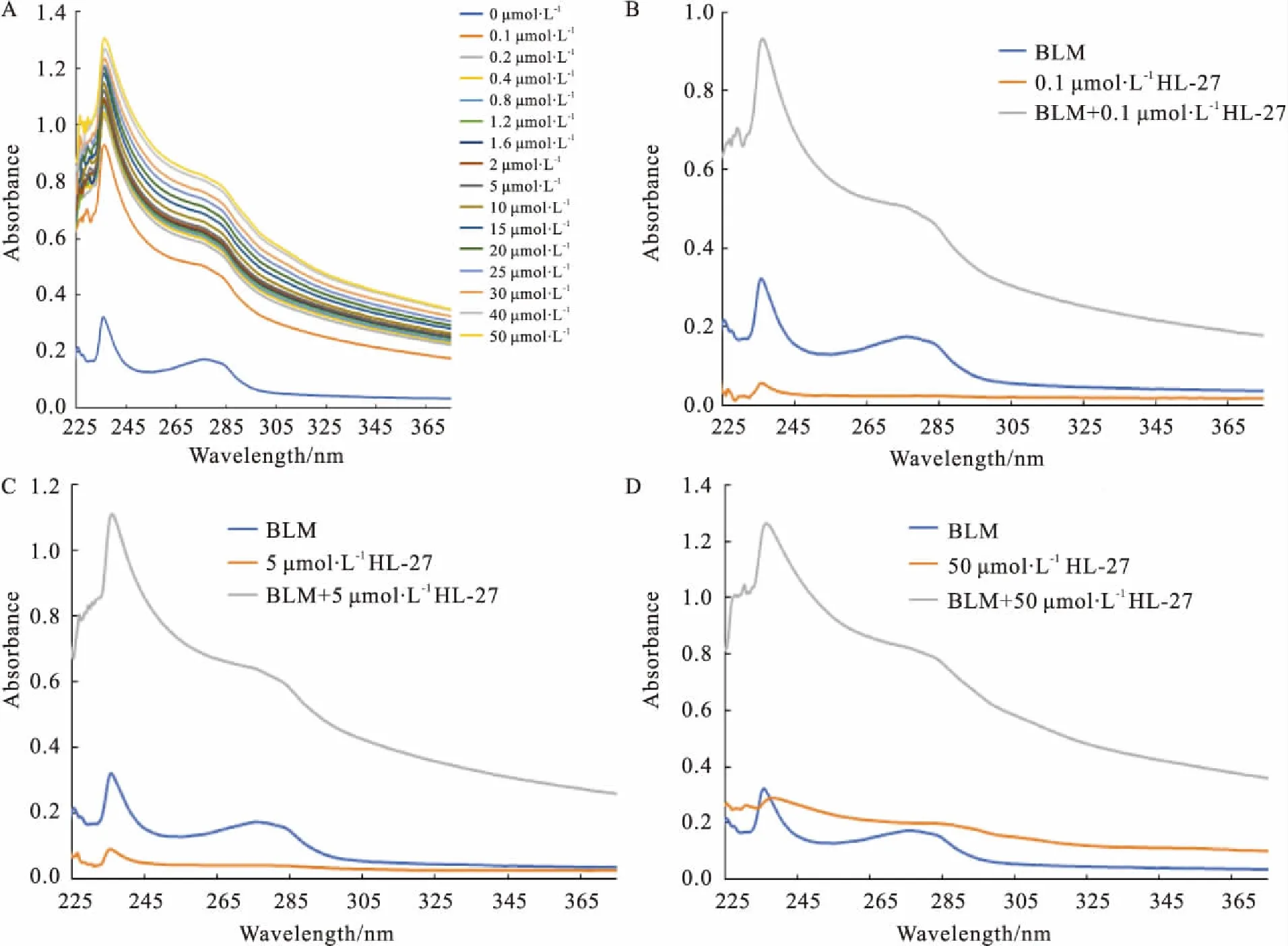
Fig 4 Effects of HL-27 on ultraviolet aborption spectrum of BLM helicase
A:Effects of different concentrations of HL-27 on the ultraviolet absorption spectrum of BLM helicase(500 nmol·L-1);B:Effects of HL-27 (0.1 μmol·L-1) on the ultraviolet absorption spectrum of BLM helicase(500 nmol·L-1);C:Effects of HL-27 (5 μmol·L-1) on the ultraviolet absorption spectrum of BLM helicase(500 nmol·L-1);D:Effects of HL-27 (50 μmol·L-1) on the ultraviolet absorption spectrum of BLM helicase(500 nmol·L-1).
综上所述,本实验研究了汉防己甲素衍生物HL-27对BLM解旋酶生物学特性的影响,对阐明其与BLM解旋酶的作用机制具有一定意义,为下一步应用该小分子物质进行抗癌研究奠定了一定的理论基础。
(致谢:本实验在贵州医科大学组织工程与干细胞实验中心完成,感谢对实验给予帮助的老师和同学!)
[1] Croteau D L, Popuri V, Opresko P L, et al. Human RecQ helicases in DNA repair, recombination, and replication[J].AnnuRevBiochem, 2014,83(1):519-52.
[2] Julia M S, Raymond J M Jr. Human RECQ helicases:roles in cancer, aging, and inherited disease[J].AdvGenomicsGenet, 2015,5(1):19-33.
[3] Sanada S, Futami K, Terada A, et al. RECQL1 DNA repair helicase:a potential therapeutic target and a proliferative marker against ovarian cancer[J].PLoSOne, 2013,8(8):e72820.
[4] Turley H, Wu L, Canamero M, et al. The distribution and expression of the Bloom’s syndrome gene product in normal and neoplastic human cells[J].BrJCancer, 2001,85(2):261-5.
[5] Wang X B, Hu L H. Protein expression of BLM gene and its apoptosis sensitivity in hematopoietic tumor cell strains[J].JHuazhongUnivSciTechnologMedSci, 2008,28(1):46-8.
[6] Yan W, Shih J H, Rodriguez-Canales J, et al. Identification of unique expression signatures and therapeutic targets in esophageal squamous cell carcinoma[J].BMCResNotes, 2012,5:73.doi:10.1186/1756-0500-5-73.
[7] Aggarwal M, Sommers J A, Shoemaker R H,et al. Inhibition of helicase activity by a small molecule impairs Werner syndrome helicase (WRN) function in the cellular response to DNA damage or replication stress[J].ProcNatlAcadSci, 2011,108(4):1525-30.
[8] 段丽霞, 许厚强, 陈 祥, 等. 丙酸睾酮对大肠杆菌RecQ解旋酶结构和功能的影响[J]. 中国药理学通报, 2011,27(4):467-72.
[8] Duan L X, Xu H Q, Chen X, et al. Effects of testosterone propionate on the structure and function of E.coliRecQ helicase[J].ChinPharmacolBull, 2011,27(4):467-72.
[9] 周林云, 任文艳, 廖云鹏, 等. IGFBP-5及p53与汉防己甲素抑制乳腺癌MCF-7细胞增殖的关系研究[J]. 中国药理学通报, 2018,34(1):38-43.
[9] Zhou L Y, Ren W Y, Liao Y P, et al. Study on relationship between IGFBP-5/p53 axis and anti-proliferation effect of tetrandrine in MCF-7 cells[J].ChinPharmacolBull, 2018,34(1):38-43.
[10] 王东旭, 袁霜雪, 伍秋香, 等. 胰岛素样生长因子结合蛋白5与汉防己甲素抑制人结肠癌细胞增殖的关系研究[J]. 中国药理学通报, 2015,31(10):1403-8.
[10] Wang D X, Yuan S X, Wu Q X, et al. Study on the relationship between insulin-like growth factor binding protein 5 and the anti-proliferation effect of tetrandrine in human colon cancer cells[J].ChinPharmacolBull, 2015,31(10):1403-8.
[11] 任文艳, 陈前昭, 周林云, 等. 汉防已甲素抑制人结肠癌细胞增殖与TGF-1的关联机制研究[J]. 中国药理学通报, 2017,33(9):1227-33.
[11] Ren W Y,Chen Q Z, Zhou L Y, et al. Study on the relationship between the anti-proliferation effect of tetrandrine and TGF-β1 in human colon cancer cells[J].ChinPharmacolBull, 2017,33(9):1227-33.
[12] 张根成, 范 苏. 光谱法研究铬(Ⅵ)与血红蛋白的相互作用[J]. 无机化学学报, 2009,25(7):1199-204.
[12] Zhang G C, Fan S. Interaction between chromium(Ⅵ) and hemoglobin:spectroscopic approach[J].ChinJInorgChem, 2009,25(7):1199-204.
[13] Bohr V A. Rising from the RecQ-age:the role of human RecQ helicases in genome maintenance[J].TrendsBiochemSci, 2008,33(12):609-20.
[14] Weber G. Polarization of the fluorescence of macromolecules. Ⅰ. Theory and experimental method[J].BiochemJ, 1952,51(2):145-55.
[15] Weber G. Polarization of the fluorescence of macromolecules. Ⅱ. Fluorescent conjugates of ovalbumin and bovine serum albumin[J].BiochemJ,1952,51(2):155-67.
[16] Dandliker W B, Feigen G A. Quantification of the antigen-antibody reaction by the polarization of fluorescence[J].BiochemBiophysResCommun,1961,26(5):299-304.
[17] Jolley M E, Stroupe S D, Wang C H, et al. Fluorescence polarization immunoassay. I. Monitoring aminoglycoside antibiotics in serum and plasma[J].ClinChem,1981,27(7):1190-7.
[18] Roychowdhury A, Szymanski M R, Jezewska M J, et al. Mechanism of NTP hydrolysis by the Escherichia coli primary replicative helicase DnaB Protein. Ⅱ. Nucleotide and nucleic acid specificities[J].Biochemistry, 2009,48(29):6730-46.
[19] Waksman G, Lanka E, Carazo JM. Helicases as nucleic acid unwinding machines[J].NatStructBiol, 2000,7(1):20-2.
