高内涵细胞成像系统在细胞增殖检测中的应用
2018-07-04胡珊珊周伟杰汪庆童
吴 莉, 邰 宇,胡珊珊, 王 瑞, 张 梅, 陶 娟, 周伟杰, 汪庆童, 魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽抗炎免疫药物协同创新中心,安徽 合肥 230032)
细胞增殖是多细胞生物体生长、发育、繁殖以及遗传的基础,是生物体的重要生命特征。检测细胞在培养基或组织中的生长速率,对于细胞生长和分化研究至关重要,在药物开发过程中也常被用于评估药物的毒性和对细胞生长的抑制情况。细胞增殖的检测是一定数量的细胞经过一段时间的分裂后所产生的细胞数量,反映细胞生长的速度。目前常用的细胞增殖检测方法有两种,一种是直接测定DNA含量的变化,经典方法为胸腺嘧啶核苷(3H-TdR)参入法;另一种是间接地检测细胞线粒体功能,通过细胞的代谢强弱反映增殖活跃度,常用检测方法为四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)法和细胞计数试剂盒-8(cell counting kit-8, CCK-8)等。3H-TdR参入法是将3H标记的DNA前体物质胸腺嘧啶核苷加入到细胞培养体系中,当细胞增殖时,DNA大量合成,3H-TdR即会参入到细胞的DNA分子中,对于放射量的检测可以判断3H-TdR参入量的多少,反映细胞增殖情况[1]。MTT为一种黄色染料,活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶解的蓝紫色甲臜结晶,并沉积在细胞中,而死细胞无此功能。用二甲基亚砜溶解甲臜,测定其光吸收值,可间接反映活细胞数量[2]。CCK-8的原理跟MTT相似,该试剂中主要成分是一种水溶性的四唑盐(WST-8), WST-8在电子载体(1-methoxy PMS)的作用下,被细胞中的脱氢酶还原为具有高度水溶性的黄色甲臜产物。生成的甲臜物的数量与活细胞数量成正比,可以利用这一特性直接进行细胞增殖和毒性分析,不同之处在于CCK-8法生成的甲臜是水溶性的,可以直接检测[3]。然而,如果能直接观察细胞增长的数量,则更为准确和简便。随着现代细胞学技术的发展,细胞拍摄速度和软件分析功能不断被提高,近年来出现的高内涵细胞成像分析系统由全自动高速显微成像、全自动图像分析、数据管理3个部分组成,可以实现高通量快速的细胞显微成像,短时间内完成96孔板的拍摄,再进行所有细胞的同步分析,可以精确地计算出细胞数量[4]。
滑膜细胞(fibroblast-like synoviocytes,FLSs)是贴壁生长的梭形细胞,类风湿关节炎(rheumatoid arthritis, RA)患者关节中,滑膜细胞在肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等促炎细胞因子的刺激下呈类肿瘤样过度增殖。甲氨蝶呤(methotrexate, MTX)等缓解病情的抗风湿药具有很强的免疫抑制作用,是临床上治疗RA的主要药物,可以明显抑制滑膜细胞增殖[5]。本实验运用高内涵细胞成像系统检测滑膜细胞增殖情况,并与传统的3H-TdR参入法、MTT法和CCK-8法进行比较,为细胞增殖检测提供新的方法。
1 材料与方法
1.1试剂与仪器DMEM(美国Gibco公司);胎牛血清(美国Hyclone公司);青霉素-链霉素溶液、台盼蓝、胰酶、Hoechst 33342(碧云天生物技术研究所);氚标记的胸腺嘧啶核苷(3H-TdR)(中国科学院上海应用物理研究所);2, 5-二苯基噁唑(PPO)、1, 4-双(5-苯基-2-噁唑基)苯(POPOP)、MTT和DMSO(美国Sigma公司);MTX注射液(25 g·L-1)(美国辉瑞制药有限公司);CCK-8试剂盒(日本同仁化学研究所);TNF-α(美国PeproTech公司)。Napco-6100型CO2细胞培养箱(美国杜邦公司);BioTek ELx808 酶标仪(美国BioTek公司);LS6500型液体闪烁计数仪(美国Beckman公司);Image Xpress Micro 4型高内涵细胞成像系统(美国Molecular Devcies公司)。
1.2方法
1.2.1大鼠FLSs的分离和培养 1.2 g·L-1新洁尔灭溶液浸泡消毒大鼠,超净台中剪开膝关节正中皮肤,暴露出膝关节位置,继续向下慢慢剪开筋膜组织,分离出平滑光亮的关节囊。用眼科剪剪断韧带,剥离暴露出完整的关节囊。沿着软骨面剪下关节软组织,剔除脂肪、纤维等,放入D-Hank’s液(不含Ca2+、Mg2+,含青霉素200 kU·L-1、链霉素200 mg·L-1)中反复漂洗,转入DMEM中,剪成1~2 mm3小块,用巴士吸管吸取组织均匀贴于培养瓶(预先用20%胎牛血清DMEM培养液湿润)底壁,加入2 mL培养液,瓶底朝上,37 ℃、5% CO2培养箱贴壁6 h后,轻轻翻转培养瓶,使培养液覆盖组织块,每隔2 d换液1次,当组织块四周爬满细胞后轻轻剔除组织,原瓶消化,继续培养传代,取第3~8代FLSs用于增殖检测。
1.2.23H-TdR参入法 0.25 g·L-1胰蛋白酶消化传代,用含5%胎牛血清的DMEM培养液稀释细胞至2×107·L-1,每孔100 μL接种至96孔培养板中,贴壁过夜,给予TNF-α(20 μg·L-1)刺激FLSs增殖,分别用不同浓度MTX(10-10、10-9、10-8、10-7、10-6、10-5mol·L-1)作用,加培养液至每孔终体积200 μL,培养48 h。终止培养前6 h,每孔加入20 μL3H-TdR(1 mCi·L-1),培养结束后,消化细胞,收集细胞至玻璃纤维滤纸上,生理盐水洗涤去游离的3H-TdR,自然晾干滤纸,加入4 mL闪烁液(4 g PPO和0.4 g POPOP溶于1 L二甲苯中,避光保存),用液闪仪测其放射性,每组设8个复孔,实验重复3次。
1.2.3MTT法 FLSs铺板给药方法同3H-TdR参入法,细胞培养48 h,终止培养前6 h,每孔加入5 g·L-1MTT 20 μL,培养结束后吸弃上清,每孔加入120 μL DMSO,震荡30 s,在酶标仪570 nm处检测吸光度(absorbance,A)值,每组设8个复孔,实验重复3次。
1.2.4CCK-8法 FLSs铺板给药方法同3H-TdR参入法,细胞培养48 h,终止培养前4 h,每孔加CCK试剂10 μL,避光,在细胞培养箱中继续培养,期间随时利用酶标仪检测450 nm处吸光度A值,每组设8个复孔,实验重复3次。
1.2.5高内涵细胞成像 FLSs铺板给药方法同3H-TdR参入法,细胞培养48 h,用生理盐水清洗细胞2遍,每孔加50 μL的台盼蓝溶液染色3 min,倒置显微镜观察拍照,计算死亡细胞百分比,洗弃台盼蓝液体,每孔加50 μL的Hoechst 33342(10 mg·L-1)避光染色10 min后弃去,加入PBS后用高内涵细胞成像系统拍照,物镜选择10倍,像素选择2,每孔拍摄16张图片,可以完整记录整孔细胞。细胞数量分析:测量视野中最大和最小的细胞核直径,设定软件识别细胞的直径范围,挑选荧光最强和最弱的细胞,测量荧光强度值,减去背景荧光强度,设定荧光强度的检测范围,通过调整此两个参数圈出所有细胞,选择模块分析细胞总数,导出结果至Excel表格。
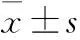
2 结果
2.13H-TdR参入法检测MTX对TNF-α诱导FLSs增殖的抑制作用96孔板接种FLSs数量为2×103个,给予TNF-α(20 μg·L-1)刺激细胞增殖,不同浓度MTX(10-10、10-9、10-8、10-7、10-6、10-5mol·L-1)抑制细胞增殖,在核医学教研室专用超净台中每孔细胞中加入3H-TdR,培养结束消化细胞,用抽滤泵将细胞收集在玻璃纤维滤纸片上,晾干后加入闪烁液上机计数,测定放射性cpm值)。如Fig 1所示,与文献报道相符,TNF-α明显升高细胞的cpm值,未刺激对照细胞cpm值为(3 139±1 663),TNF-α组细胞cpm值为(9 900±3 228),MTX体外给药组的cpm值分别为(9 426±4 108)、(7 430±2 723)、(6 798±2 295)、(4 875±2 289)、(3 237±1 478)、(2 684±1 647)。1 nmol·L-1MTX即可观察到明显增殖抑制作用(P<0.05),提示3H-TdR参入法检测增殖敏感性高,但是数据离散程度较大,标准差达到均值的32.61%~61.36%,可能与细胞消化和转移至滤纸是否充分、抽滤过程中游离3H-TdR洗脱程度差异、在闪烁液中的溶解情况不同等有关。

Fig 1 3H-TdR incorporation assay detects inhibitory effect of MTX on proliferation of FLSs induced by TNF-α
##P<0.01vscontrol group;*P<0.05,**P<0.01vsTNF-α group
2.2MTT法检测MTX对TNF-α诱导FLSs增殖的抑制作用96孔板细胞体外刺激给药后,加入MTT,线粒体将MTT还原成甲臜,用DMSO溶解后检测A值。Fig 2结果显示,阴性对照组细胞A值为(0.913±0.163),TNF-α促进甲臜的产生,A值为(1.235±0.178),MTX体外给药组的A值分别为(1.180±0.168)、(1.123±0.156)、(1.071±0.136)、(1.044±0.145)、(0.932±0.157)、(0.914±0.109)。10 nmol·L-1MTX可观察到明显增殖抑制作用(P<0.01),提示MTT法检测的敏感性较3H-TdR参入法低,但是数据离散程度较小,标准差为均值的11.9%~17.8%。
2.3CCK-8法检测MTX对TNF-α诱导FLSs增殖的抑制作用CCK-8法在MTT的基础上进行了改进,产生的甲臜不用DMSO溶解,而可以直接检测,对细胞影响较少,可以反复检测不同时间的A值。实验发现,加入CCK-8 4 h后,对照细胞孔检测得到的A值为(0.574±0.142),TNF-α刺激孔细胞的A值升高至(1.206±0.209), MTX浓度从低至高体外给药分别使FLSs的A值为(1.192±0.260)、(1.112±0.191)、(1.017±0.243)、(0.958±0.210)、(0.798±0.179)和(0.677±0.223),各组A值大小均在CCK-8试剂盒的检测灵敏范围内(Fig 3)。此方法检测到10 nmol·L-1MTX对炎性FLSs增殖的抑制作用,灵敏度与MTT法相似,A值标准差在17.15%~32.88%之间。

Fig 2 MTT assay detects inhibitory effect of MTX on proliferation of FLSs induced by TNF-α
##P<0.01vscontrol group;**P<0.01vsTNF-α group

Fig 3 CCK-8 kits assay detects inhibitory effect of MTX on proliferation of FLSs induced by TNF-α
##P<0.01vscontrol group;*P<0.05,**P<0.01vsTNF-α group
2.4高内涵细胞成像法检测MTX对TNF-α诱导FLSs增殖的抑制作用细胞给药处理48 h后进行台盼蓝染色,高内涵细胞成像系统拍照,算出各孔死细胞数量(死细胞呈蓝色),台盼蓝染色见Fig 4,正常细胞、TNF-α刺激的细胞和MTX 10-10mol·L-1给药组细胞死亡率较少,其他给药组有少量细胞死亡。洗去台盼蓝染料,再进行Hoechst 33342染色,细胞核染上蓝色荧光,高内涵细胞成像系统拍照,如Fig 5所示,用软件分析出每孔的细胞总数,减去台盼蓝染色细胞数,即为活细胞数量。根据测量和调整,最后设定FLSs细胞核大小为8~20 μm,荧光强度高于局部背景荧光2000graylevels,通过A图和B图的对比,确定所有细胞均选中(Fig 6),选择模块,分析细胞数量。结果显示,96孔板每孔接种2 000个FLSs,在含5%胎牛血清的DMEM体系中培养48 h,对照组细胞增长为(2 910±772.2)个,TNF-α刺激组每孔细胞为(6 063±1 011)个,MTX给药组细胞数分别为(5 428±687.0)、(5 331±786.8)、(5 188±859.3)、(3 714±762.4)、(2 623±640.7)和(1 995±479.7)个。与3H-TdR参入法相似,1 nmol·L-1MTX即可检测到明显的增殖抑制作用(P<0.05,Fig 7),灵敏度较高,且组内数据的离散程度较小,标准差为均值的12.66%~26.54%。

Fig 4 FLSs trypan blue staining
A: Control; B: TNF-α; C: TNF-α +MTX 0.1 nmol·L-1; D: TNF-α +MTX 1 nmol·L-1; E: TNF-α +MTX 10 nmol·L-1; F: TNF-α+MTX 0.1 μmol·L-1; G: TNF-α+ MTX 1 μmol·L-1; H: TNF-α+ MTX 10 μmol·L-1. Arrows indicate trypan blue staining cells, implying the death of cells.

Fig 5 High content cell imaging system images 96-well of FLSs
A:Control;B: TNF-α;C: TNF-α+MTX;D: TNF-α+MTX 1 nmol·L-1;E:TNF-α+MTX 10 nmol·L-1;F:TNF-α+MTX;G: TNF-α+MTX 1 μmol·L-1;H:TNF-α+MTX 10 μmol·L-1. The nuclei were stained with Hoechst 33342 in blue. 16 photographs were taken with 20× objective lens each well. The cells were observed after stacking and counted by software.

Fig 6 The appropriate parameters set to select all cells for analysis
A: The (×10) objective lens photographed cell photos; B: All the objects that would be analyzed after setting the test parameters. All cells could be selected when the size of FLSs was measured between 8 μm to 20 μm while fluorescence intensity was higher than background fluorescence 2000 graylevel.

Fig 7 High content cell imaging detects inhibitory effect of MTX on proliferation of FLSs induced by TNF-α
##P<0.01vscontrol group;*P<0.05,**P<0.01vsTNF-α group
3 讨论
细胞增殖检测广泛应用于分子生物学、遗传学、肿瘤生物学、免疫学、药理和药代动力学等研究领域。细胞增殖是细胞经过DNA复制倍增、RNA转录和蛋白质合成,而进行的分裂系列过程,主要是细胞数量发生了变化。寻找简单准确的增殖检测方法尤为重要。本实验以FLSs贴壁细胞为研究对象,比较了几种常用的细胞增殖检测方法。目前,主要有两种用于检测细胞增殖能力的方法:一种是直接的方法,通过直接测定进行分裂的细胞数来评价细胞的增殖能力。另一种是间接的方法,即细胞活力检测方法,通过检测样品中健康细胞的数目来评价细胞的增殖能力。显然,细胞活力检测法并不能最终证明检测样品中的细胞是否在增殖。
用于检测细胞增殖能力最经典的方法是用3H-TdR处理细胞,再检测DNA链中氚含量。若细胞具有增殖能力,DNA合成过程中将会采用3H-TdR作为合成原料,因此,检测细胞DNA链内标记核苷酸的量可判断细胞是否进行DNA的合成。3H-TdR参入法较客观、敏感度强、细胞用量少、结果可靠,但所用试剂含有同位素,具有放射性,3H-TdR因为其生物学活性,一旦进入人体会被细胞用于DNA合成,造成内辐射,从而对实验人员具有一定的危害。细胞抽滤至玻璃纤维滤纸上后需要彻底洗去游离的3H-TdR,否则影响最终检测值。滤纸需要晾干后加入闪烁液上机检测,该方法操作复杂,耗时较长[6]。并且目前放射性试剂管制严格,不易购买,此方法难以开展。BrdU和EdU等也为胸腺嘧啶核苷类似物,能够在细胞增殖时期代替胸腺嘧啶渗入正在复制的DNA分子,通过检测EdU标记反映细胞的增殖情况。
在一定细胞数范围内,MTT形成的结晶量与细胞数成正比,从而可以对细胞的活力、增殖与凋亡情况进行检测。该法所用试剂少,仪器简单,耗时少,出结果快。然而多个研究报道,细胞内MTT的代谢除依赖于线粒体功能以外,也与非线粒体酶、溶酶体和核内体有关[7]。一些药物可以直接与MTT相互作用,例如维生素C和维生素A,多种植物提取物如多酚类的白藜芦醇和黄酮类的槲皮素、毛地黄黄酮和山柰酚等,影响实验结果。还有一些药物可以影响线粒体脱氢酶活性,例如氯喹和干扰素等可以抑制酶活性,因而造成实验结果的假阴性,相反,染料木黄酮可以促进酶活性而造成实验结果假阳性。此外,阿霉素等可以使细胞产生大量自由基,促进MTT转化。甲臜颗粒不易溶解,导致敏感性低于同位素法,因此MTT在检测细胞活力时存在一定的局限性[8]。
CCK-8被线粒体脱氢酶转化成可溶性甲臜,不需要吸出培养液再加入有机溶剂溶解,可以减少步骤和误差,其重复性优于MTT,对细胞毒性较小,检测后细胞还可重复利用,具有很好的实用性,尤其适用于悬浮细胞,高通量药物筛选。然而CCK-8形成甲臜的量随时间延长而增多,测出的A值不断升高,因此在实验操作时,反应时间必须严格控制,生成甲臜的量太多,可能会超出酶标仪的读数范围,甲臜的量太少,则不能充分反映细胞的活力。由于CCK-8也是由线粒体脱氢酶代谢,因此任何与CCK-8本身或线粒体脱氢酶有作用的药物均影响检测结果[9]。CCK-8试剂价格较为昂贵,成本高,所以更适于灵敏度要求高、分离纯化不易、样品量少的天然产物提取物的活性检测。相同原理的方法还有MTS和WST-1法等。
直接计数给药后细胞数量是检测增殖程度的标准,但是,普通倒置显微镜很难对整个细胞培养板进行拍照和分析。高内涵分析技术是一种基于成像的单细胞水平的多参数细胞分析方法。高内涵细胞成像系统具有磁悬浮自动载物台,可以对整板细胞进行快速成像。对细胞核进行荧光染色后清楚地标记出所有细胞核,且应用细胞毒性小的活细胞染料如Hoechst 33342等,可动态观察细胞增殖分裂情况。后继的分析系统具有细胞计数等模块,可以方便准确的选中所有细胞进行多参数分析,包括细胞数量、细胞核面积大小、细胞核荧光染色强度,以及分裂增殖后细胞的形态和表型等,是在保持细胞结构和功能完整性的前提下,同时检测被筛样品对细胞形态、生长、分化、迁移、凋亡、毒性、代谢途径及信号转导各个环节的影响,在单一实验中获取大量与基因、蛋白及其他细胞成分相关的信息,确定待测药物生物活性和潜在毒性的过程。此方法准确度高,数据可靠,实验步骤方便,细胞核荧光染料价格低廉,在药物活性的高通量筛选中运用逐渐增多[10]。然而,由于细胞成像的限制,对于贴壁细胞的检测优于悬浮细胞。该系统设备昂贵,也局限了其在细胞增殖检测中的应用。
上述细胞增殖和活力的检测方法都得到了验证,选择何种检测方法取决于实验条件、待测药物的性状、细胞的特点和检测目的等。高内涵细胞成像检测方法为一种更准确的新型检测细胞增殖实验方法,有望在细胞动力学和药物活性分析中得到更为广泛的关注。
[1] 杨思民, 汪庆童, 刘亢亢, 等. 重组TACI-Ig融合蛋白抑制抗CD3抗体诱导T淋巴细胞增殖与活化[J]. 安徽医科大学学报, 2016,51(7): 919-25.
[1] Yang S M, Wang Q T, Liu K K, et al. Inhibitory effect of rhTACI-Ig on anti-CD3 antibody induced T lymphocytes proliferation and activation[J].ActaUnivMedAnhui, 2016,51(7): 919-25.
[2] Wang Y J, Zhou S M, Xu G, Gao Y Q. Interference of phenylethanoid glycosides from Cistanche tubulosa with the MTT assay[J].Molecules, 2015,20(5):8060-71.
[3] Wang Q, Wang L, Wu L, et al. Paroxetine alleviates T lymphocyte activation and infiltration to joints of collagen-induced arthritis[J].SciRep, 2017,7:45364.
[4] Gelles J D, Edward Chipuk J. Robust high-throughput kinetic analysis of apoptosis with real-time high-content live-cell imaging[J].CellDeathDis, 2016,7(12):e2493.
[5] Wu H, Chen J, Wang Q, et al. Ginsenoside metabolite compound K attenuates inflammatory responses of adjuvant-induced arthritis rats[J].ImmunopharmacolImmunotoxicol, 2014,36(2): 124-9.
[6] Straume T, Raabe O G, Walsh K J, Wiley L M. Transmitted proliferation disadvantage from mouse oocytes labeled in vivo with [3H]thymidine: radiosensitive target considerations[J].MutatRes, 1997,374(1):11-9.
[7] 岳晓莉,李 萍,六 欣,等.黄芪多糖对过氧化氢刺激皮肤成纤维细胞中线粒体和溶酶体的保护作用[J]. 中国病理生理杂志,2008,24(4):777-82.
[7] Yue X L,Li P,Liu X,et al. Protective effect of astragalus polysaccharide on mitochondria and lysosome in H2O2stressed skin fibroblasts[J].ChinJPathophysiol,2008,24(4):777-82.
[8] Jaszczyszyn A, Gasiorowski K. Limitations of the MTT assay in cell viability testing[J].AdvClinExpMed,2008,17(5): 525-9.
[9] 佟 丽,辛增辉,陈育尧,等.Mtb诱导的SD大鼠佐剂性关节炎模型的建立及评价[J].中国药理学通报,2009,25(2):259-63.
[9] Tong L, Xin Z H, Chen Y Y, et al. Establishment and evalution of adjuvant induced arthritis animal model by Mtb in Sprague-Dawley rats[J].ChinPharmacolBull,2009,25(2):259-63.
[10] Sieprath T, Corne T, Robijns J, et al. Cellular redox profiling using high-content microscopy[J].JVisExp,2017,(123). doi:10.3791/55449.
