姜黄素联合阿糖胞苷对人急性髓系白血病细胞KG1a增殖、自噬及凋亡的影响
2018-07-04陈雅琳白天鸽
马 翠,陈雅琳,白天鸽,魏 虹
(石河子大学医学院组织胚胎学教研室,新疆 石河子 832002)
白血病是一类起源于造血干细胞的克隆性恶性血液疾病,其中急性白血病比慢性白血病多见(约5.5 ∶1),我国白血病发病率为2.76/10万,呈逐年上升趋势。阿糖胞苷(cytosine arabinoside,Ara-C)属于细胞S增殖期的嘧啶类抗代谢药物,通过抑制细胞DNA的合成,干扰细胞的增殖,是目前国际公认的抗急性髓系白血病的标准治疗之一。由于其骨髓抑制、血液不良反应、肝脏损害等毒副作用及耐药性的出现,使得高剂量化疗药物的使用受限,而且单一化疗也已经不能满足临床需要。肿瘤的发生、发展千变万化,是多因素、多基因参与的复杂过程,综合多方面治疗是目前肿瘤治疗的主要研究方向。
姜黄素(curcumin,CUR)因其具有选择性杀伤肿瘤细胞、对正常细胞毒副作用小的优点,近年来越来越受到肿瘤治疗领域的重视。尽管已有研究表明,CUR及其衍生物能诱导白血病细胞发生凋亡[1-2]、自噬[3]、抑制白血病细胞的浸润、转移[4]及逆转多药耐药[5],且CUR既能逆转非小细胞肺癌分子靶向药物耐药作用[6],也可联合5-氟尿嘧啶优化结直肠癌细胞的治疗[7],以及协同白消安诱导提高KG1a细胞凋亡作用[8]。但目前并无CUR联合Ara-C用于急性髓系白血病KG1a细胞的研究。本实验通过CUR诱导KG1a细胞自噬、凋亡,并与小剂量化疗药物Ara-C联合,观察对KG1a细胞增殖、自噬、凋亡的影响,进一步探讨自噬与凋亡之间的联系,以期减少Ara-C在临床应用中的不良影响,为临床白血病的联合治疗提供实验依据。
1 材料与方法
1.1材料
1.1.1试剂 RPMI 1640培养基(美国Gibco公司);胎牛血清、碘化丙啶、吖啶橙、CUR、Ara-C均购自美国Sigma公司;3-甲基腺嘌呤(3-methyladenine,3-MA)购自美国APE×BIO公司;Annexin V-FITC/PI凋亡检测试剂盒(Solarbio公司);细胞周期试剂盒(Beyotime公司);PrimeScriptTMRT reagent Kit逆转录试剂盒(TaKaRa公司);β-actin鼠单抗、caspase-3兔单抗、LC3A/B兔单抗、Bcl-2兔单抗、Beclin1兔单抗,均购自美国Cell Signaling Technology公司。CUR和3-MA用DMSO配制成储存液,Ara-C用PBS配制成储存液于-20℃冰箱保存,应用时RPMI 1640培养基稀释到相应终浓度。
1.1.2细胞株 人急性髓系白血病细胞株KG1a购自广州赛库生物技术有限公司。KG1a细胞用含10%胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素的RPMI 1640培养液,置于37℃、5% CO2培养箱中培养,2 d更换1次培养液。
1.1.3仪器 全光栅酶标仪(美国Thermo Fisher);实时定量PCR仪(杭州安杰思公司);超微量核酸蛋白测定仪(北京凯奥公司);流式细胞仪(Mindray公司)。
1.2方法
1.2.1MTT法检测急性髓系白血病KG1a细胞增殖 将5×105个处于对数生长期的KG1a细胞接种于96孔板,每孔180 μL。按照实验分组(CUR:20、40、60、80 μmol·L-1; Ara-C:0.02、0.1、0.5、2.5 μmol·L-1)进行操作,每组设3个复孔,20 μL的5 g·L-1MTT溶液避光在37℃、5% CO2培养箱中孵育4 h后,终止培养,弃上清。每孔加入150 μL DMSO,震荡10 min,使结晶物充分溶解,490 nm检测各孔的OD值。计算各组细胞增殖抑制率(inhibition rate,IR):IR=[(OD值阴性对照组-OD值空白对照组)-(OD值实验组-OD值空白对照组)]/(OD值阴性对照组-OD值空白对照组)×100%。
1.2.2吖啶橙法观察自噬泡的形成 1×106个细胞接种至24孔板,药物处理后,置37℃、5% CO2及饱和湿度的恒温培养箱中悬浮培养,孵育后,在24、48 h分别取出细胞,PBS洗涤,加1 μL的吖啶橙染液,避光染色20 min后,荧光显微镜下观察并拍照。
1.2.3流式细胞仪检测细胞凋亡率和细胞周期 取对数生长期的细胞,以1×106个细胞接种于24孔板中,药物处理48 h后收集细胞,PBS洗涤1遍后,每组各加100 μL结合液、2 μL FITC、2 μL PI,避光反应20 min后,上流式细胞仪检测。同理在24 h后收集上述各实验组的细胞,按照周期检测试剂盒说明书进行操作,检测细胞周期。
1.2.4实时荧光定量PCR提取各组细胞总RNA,使用逆转录试剂盒操作说明书获得cDNA,PCR反应体系:10.0 μL SYBR Select Master Mix (2×),2.0 μL cDNA模板,上、下游引物各0.8 μL,加水至总体积为20.0 μL。95℃ 1 min;95℃ 10 s,60℃ 34 s,35循环;60℃ 1 min。引物序列见Tab 1。以2-△△Ct法计算基因相对表达量。

Tab 1 Sequences of primers
1.2.5Western blot检测凋亡及自噬蛋白表达 取对数生长期的KG1a细胞,细胞分组,在37℃、5% CO2环境中培养48 h后,RIPA裂解液提取总蛋白,每个泳道上蛋白样品30 μg,经10% SDS-PAGE电泳后,利用湿转法将蛋白转移至PVDF膜上,用含5% BSA的PBST温箱中封闭1 h,洗涤1次后,分别加入对应一抗(β-actin、caspase-3、LC3A/B、Bcl-2、Beclin-1,均1 ∶1 000稀释),4℃孵育过夜,PBST洗涤3次,每次10 min;加入山羊抗兔IgG抗体孵育1 h。曝光拍照分析。

2 结果
2.1CUR和Ara-C对细胞生长的影响如Fig 1所示,CUR在48 h的IC50为42.01 μmol·L-1,在不同的处理时间上,随着CUR浓度的增加,其对KG1a细胞的抑制作用明显增强(P<0.01),即抑制率与剂量呈明显正相关(R=0.723)。随着CUR处理细胞时间的延长(24~72 h),其对细胞的抑制作用明显增加(P<0.05),即抑制率与时间呈正相关(R=0.573)。表明CUR对KG1a细胞有一定的时间、剂量依赖性。同时Ara-C也对KG1a细胞有一定的时间、剂量依赖性。在此选择CUR 40 μmol·L-1与Ara-C 0.5 μmol·L-1联用,在处理细胞48 h后,如Fig 2所示,联用组细胞抑制率高于各单药组,经3-MA预处理的各组细胞抑制率明显增加且高于各自单用组,差异有显著性(P<0.01)。各组均与对照组有明显差异(P<0.01)。
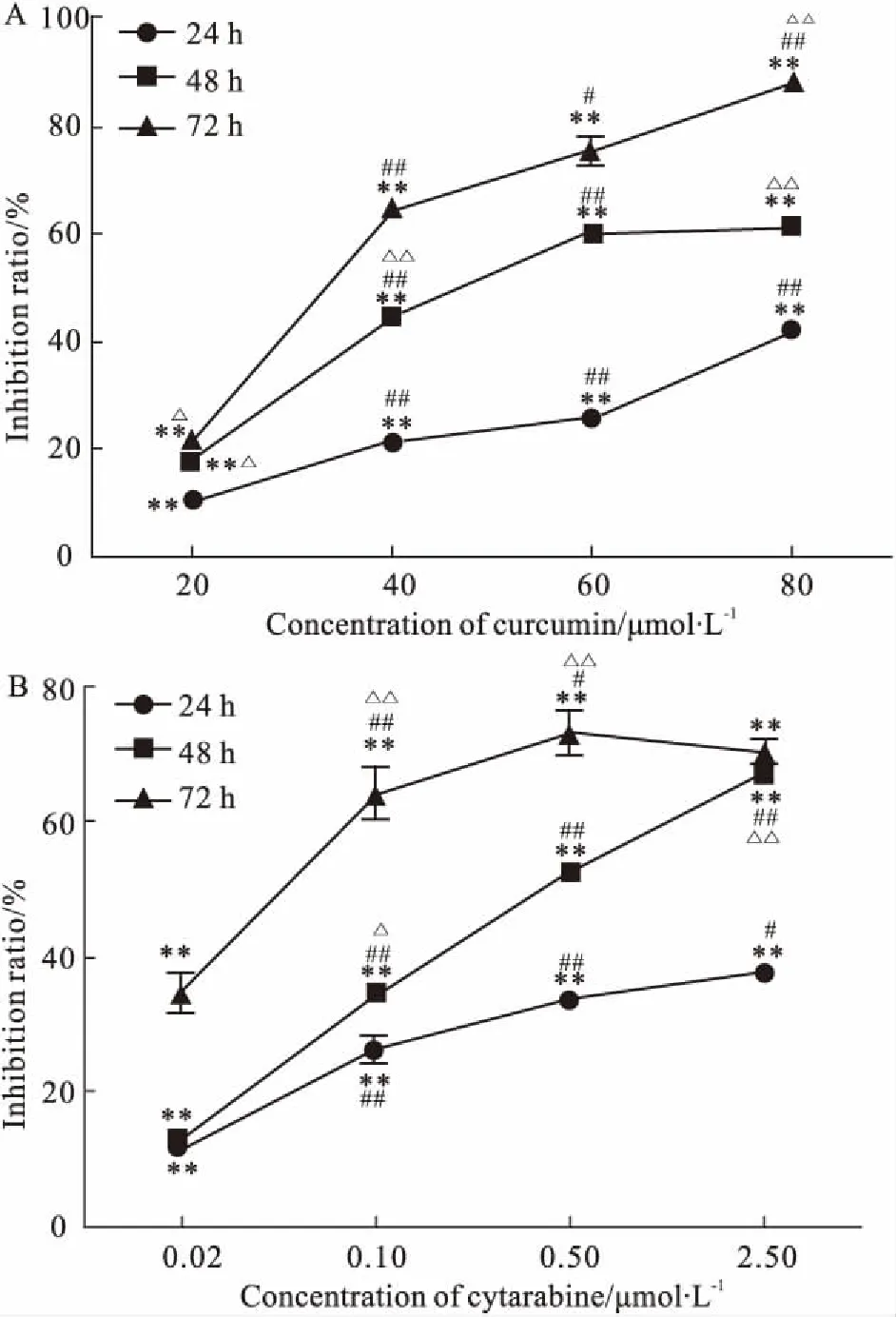
Fig 1 Anti-proliferation effect of CUR(A) and Ara-C(B) on KG1a cells by MTT
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsadjacent low concentrations at the same time;△P<0.05,△△P<0.01vstime (24 hvs48 h, 48 hvs72 h)
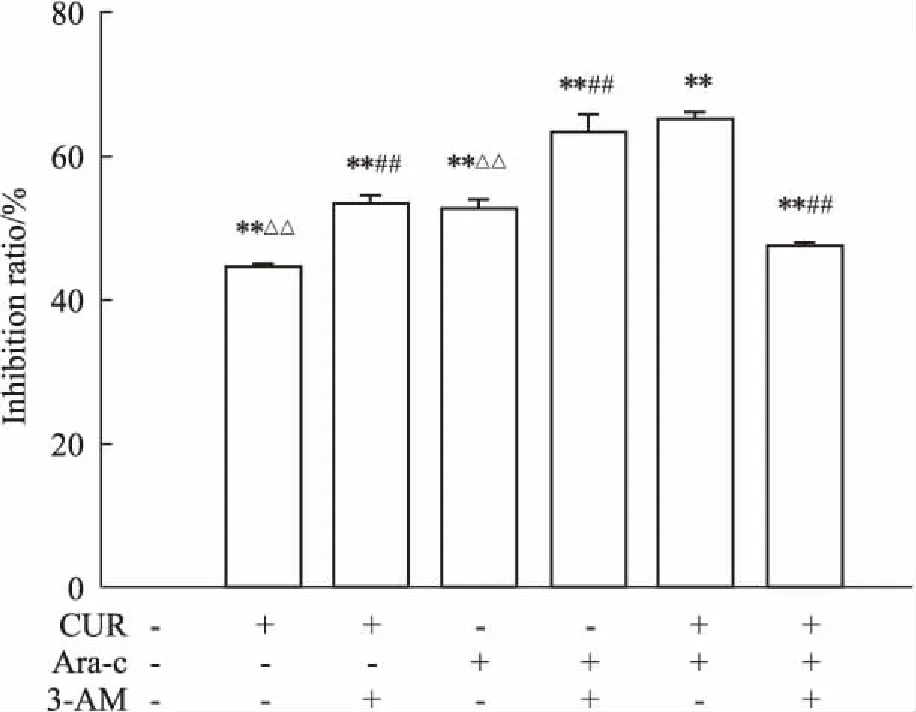
Fig 2 Effect of different drug groups on the growth of KG1a cells after 48
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vs3-MA 10 mmol·L-1pretreatment group;△P<0.05,△△P<0.01vs40 μmol·L-1CUR+0.5 μmol·L-1Ara-C group
2.23-MA抑制姜黄素诱导的KG1a细胞自噬如Fig 3所示,阳性实验组(饥饿组)细胞质中出现大量酸性囊泡,在药物作用24、48 h后,与对照组相比,细胞质中的酸性囊泡不断增加,且含自噬囊泡的细胞也在增加,同时细胞形态也发生了改变。CUR 40 μmol·L-1与Ara-C 0.5 μmol·L-1联合处理细胞后的含酸性囊泡细胞个数及单个细胞中酸性囊泡数均明显增多,但在3-MA预处理下,每组细胞内的自噬囊泡相对减少。
2.33-MA增强CUR、Ara-C或合用组对KG1a细胞的凋亡诱导作用药物处理48 h后,联合处理组较CUR和Ara-C组凋亡率明显升高,均高于对照组(P<0.05,除了CUR组与对照组没有显著性差异)。3-MA预处理后的联合处理组、CUR或Ara-C组的细胞凋亡明显上升,均分别高于其单用组,差异有显著性(P<0.01)。自噬抑制剂3-MA单独处理细胞凋亡率达到(16.48±0.06)%,明显高于对照组(Fig 4、5)。
2.4细胞周期分布情况如Fig 6所示,CUR和Ara-C分别作用细胞24 h后,细胞主要被阻滞在G0/G1期。0.5 μmol·L-1Ara-C组细胞与空白组比较,G0/G1期细胞明显增多(P<0.01),G2期细胞则明显减少(P<0.01);40 μmol·L-1CUR组与空白组比较,G0/G1期增多、S期和G2期则明显减少(P<0.05)。
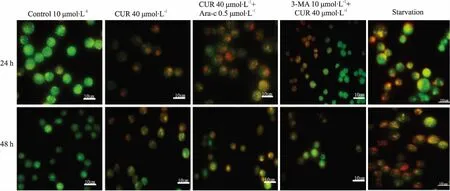
Fig 3 Acridine orange detecting the autophagy after the drug treatment of 24, 48 h(×400)

Fig 4 Comparison of apoptosis rate of KG1a cells in different treatment groups
A:Control; B:CUR 40 μmol·L-1+Ara-C 0.5 μmol·L-1; C: CUR 40 μmol·L-1; D: Ara-C 0.5 μmol·L-1; E: 3-MA 10 mmol·L-1; F: 3-MA 10 mmol·L-1+CUR 40 μmol·L-1; G: 3-MA 10 mmol·L-1+Ara-C 0.5 μmol·L-1; H: 3-MA 10 mmol·L-1+CUR 40 μmol·L-1+Ara-C 0.5 μmol·L-1.
2.5凋亡及自噬蛋白的表达如Fig 7所示,KG1a细胞经处理48 h后,联合组的caspase-3和裂解片段的相对表达量均高于单独作用组,且与对照组相比差异有显著性(P<0.01);经3-MA预处理的40 μmol·L-1CUR组caspase-3表达低于CUR单用组(P<0.01)。抗凋亡蛋白Bcl-2因表达量过低未检测出。联合组自噬标志蛋白Beclin-1表达高于单药组,且较对照组明显升高,LC3-Ⅰ向LC3-Ⅱ转化上升,0.5 μmol·L-1Ara-C与40 μmol·L-1CUR的联合处理组出现明显的自噬反应。在3-MA预处理后,40 μmol·L-1CUR组Beclin-1和LC3蛋白的表达明显降低(P<0.01)。
2.6CUR与Ara-C联合对caspase-3、Bcl-2、LC3、Beclin-1基因表达的影响如Fig 8所示,药物处理48 h后,各实验组细胞Bcl-2基因的表达水平明显低于对照组(P<0.01),CUR+Ara-C组Bcl-2 mRNA低于单独组(P<0.01),在3-MA预处理下,CUR组Bcl-2 mRNA较单独CUR组降低(P<0.05)。caspase-3与Bcl-2基因表达变化正好相反,联用组高于单用组,3-MA预处理组高于CUR单独组(P<0.05)。Beclin-1和LC3的基因表达水平均与对照组有明显差异(P<0.05),CUR+Ara-C组Beclin-1 mRNA表达量明显高于单用组,经3-MA预处理后的CUR组明显降低(P<0.05)。而LC3的基因表达变化没有显著性差异。
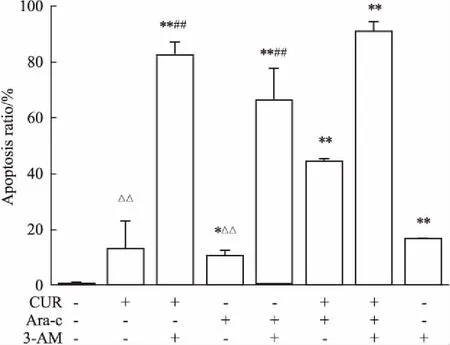
Fig 5 Effect of drugs on KG1a cell 8)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vs3-MA 10 mmol·L-1pretreatment group;△P<0.05,△△P<0.01 vs 40 μmol·L-1CUR+0.5 μmol·L-1Ara-C group

Fig 6 Effects of CUR and Ara-C on cell cycle distribution of the acute myeloid leukemia KG1a
*P<0.05,**P<0.01vscontrol;##P<0.01vsAra-C G0/G1phase;△△P<0.01vsCUR G0/G1phase
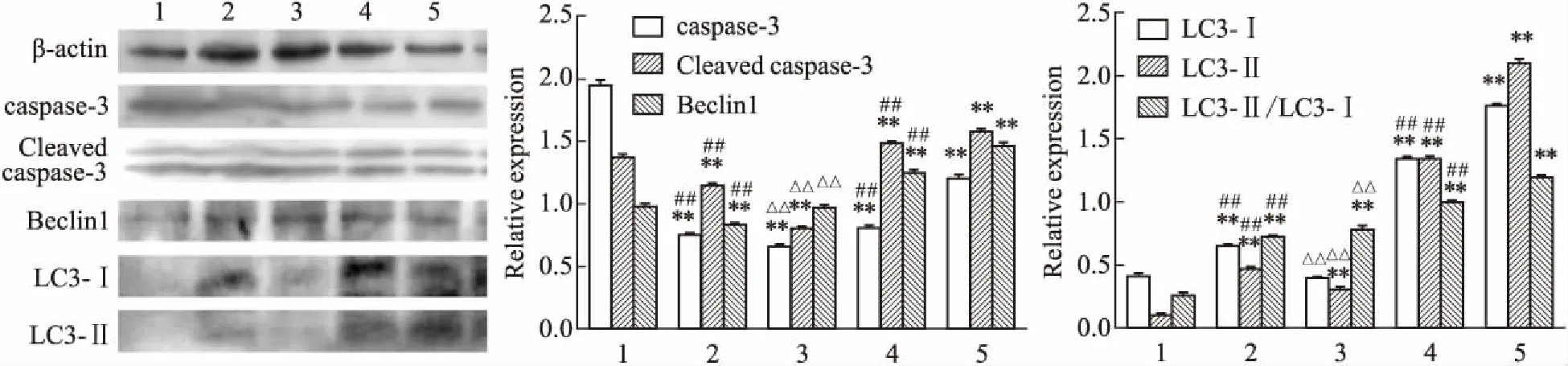
Fig 7 KG1a cells were treated with CUR and Ara-C for 48 h, and the expression of Beclin-1, caspase-3 and LC3 proteins were analyzed by Western
1:Control 0 μmol·L-1; 2: Ara-C 0.5 μmol·L-1; 3: CUR 40 μmol·L-1+3-MA 10 mmol·L-1; 4: CUR 40 μmol·L-1; 5: Ara-C 0.5 μmol·L-1+ CUR 40 μmol·L-1.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsAra-C+CUR group;△P<0.05,△△P<0.01 vs CUR 40 μmol·L-1.

Fig 8 The mRNA expression of caspase-3, Bcl-2, Beclin-1 and LC3 in KG1a cells treated with CUR and Ara-C for 48
1:Control; 2:Ara-C 0.5 μmol·L-1; 3: CUR 40 μmol·L-1+3-MA 10 mmol·L-1; 4:CUR 40 μmol·L-1; 5:Ara-C 0.5 μmol·L-1+CUR 40 μmol·L-1.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsAra-C+CUR group;△P<0.05,△△P<0.01vsCUR 40 μmol·L-1.
3 讨论
急性髓系白血病是常见恶性肿瘤之一,治疗主要依靠骨髓移植,但化疗是其常见的辅助治疗手段,由于Ara-c等化疗药物的不良反应及其耐药性,导致治疗效果不理想,影响患者预后。因此,如何能在减少化疗药物的剂量和机体伤害的情况下,提高化疗药物的疗效是许多研究的目标。国内外研究发现,CUR既能逆转非小细胞肺癌分子靶向药物耐药作用[6],也可诱导结直肠癌细胞[7]、KG1a细胞[8]、白血病K562细胞[3]等凋亡与自噬。
肿瘤的发生过程受多种因素影响,不同药物对不同肿瘤的抗肿瘤活性不同。当细胞发生自噬时,一方面自噬使细胞免受恶劣环境的伤害,另一方面是一种有别于凋亡的Ⅱ型程序性死亡或自噬性死亡[9]。细胞自噬是一个极其复杂的过程,在生长因子、DNA损伤等条件下,均可诱导细胞自噬的发生。Beclin-1、LC3是参与自噬过程的两个主要蛋白,CUR联合Ara-C处理发现Beclin-1和LC3均比单一处理组表达量明显升高,说明CUR能上调Ara-c对细胞的自噬活性。自噬抑制剂3-MA能够抑制CUR诱导的KG1a细胞自噬。细胞凋亡是生物体发生、发展过程中的自然现象,它是由相关基因主导的程序性死亡方式。本实验中CUR联合Ara-C处理组的caspase-3和激活片段的表达量高于CUR单独处理组,而抗凋亡基因Bcl-2则相反。流式细胞仪检测呈现相似的结果,3-MA抑制自噬促进细胞凋亡。这与有关报道一致,如在白血病细胞株中,抑制自噬能达到更好的药物效果[10-12],细胞自噬也能引起白血病细胞的抗药性[13]。
Beclin-1蛋白的BH3结构域能与Bcl-2蛋白结合,抑制其促进自噬的活性[14],Bcl-2的减少同时也减少了与Beclin-1的结合,削弱抑制自噬的作用,因此增加了细胞自噬的活性和凋亡的发生。Beclin-1不仅参与自噬的起始,而且能与Bcl-2通过相互作用,介导凋亡的发生。CUR联合Ara-c处理组中的Bcl-2明显低于单一组,代表自噬激活的Beclin-1和LC3基因表达上升,然而Bcl-2基因的下调代表凋亡率的增加,在3-MA存在的情况下,Beclin-1和Bcl-2的下调代表自噬活性的降低,并诱发凋亡的产生。自噬和凋亡的关系复杂多变,已有过他们关系的研究[15]。但对KG1a细胞的研究发现,3-MA预处理后的细胞凋亡率明显增高,但3-MA预处理组的蛋白实验又显示其凋亡相关蛋白caspase-3的表达量并不高于CUR单用组,这可能是3-MA造成的半胱天冬酶依赖性死亡,其功能与它对自噬的抑制无关。在本研究中我们发现,CUR能够增加KG1a细胞对Ara-C的敏感性和凋亡,也会诱导自噬的产生。但是此自噬作用起到部分保护细胞免受化疗药物损伤的作用,我们可以将自噬抑制剂与凋亡诱导剂联用,抑制肿瘤细胞的生长,为以后临床用药提供理论基础。
总之,CUR能明显提高KG1a细胞对Ara-C的敏感性,促进细胞凋亡,并诱导细胞产生自噬,通过自噬产生耐药,3-MA抑制自噬能够增强药物抗肿瘤的疗效与促凋亡作用。联合使用自噬抑制剂与凋亡诱导剂可能是治疗白血病用药的新方向。
(致谢:对石河子大学组织胚胎教研室、新疆地方与民族高发病重点实验室的全体老师和工作人员的全力支持表示衷心的感谢。)
[1] 吴 莺, 陈瑞家, 吴丽贤,等. 姜黄素衍生物C085对K562细胞的作用及机制研究[J]. 中国药理学通报,2015,31(6):870-5.
[1] Wu Y, Chen Y J, Wu L X, et al. Effects of curcumin derivatives C085 on K562 cells and its mechanism[J].ChinPharmacolBull,2015,31(6):870-5.
[2] Tima S, Ichikawa H, Ampasavate C, et al. Inhibitory effect of turmeric curcuminoids on FLT3 expression and cell cycle arrest in the FLT3-overexpressing EoL-1 leukemic cell line[J].JNatProd, 2014,77(4):948-54.
[3] Jia Y L, Li J, Qin Z H, et al. Autophagic and apoptotic mechanisms of curcumin-induced death in K562 cells[J].JAsianNatProdRes, 2009,11(11):918-28.
[4] Zhu G H, Dai H P, Shen Q, et al. Curcumin induces apoptosis and suppresses invasion through MAPK and MMP signaling in human monocytic leukemia SHI-1 cells[J].PharmBiol, 2016,54(8):1303-11.
[5] Wu L X, Ying W, Chen R J, et al. Curcumin derivative C817 inhibits proliferation of imatinib-resistant chronic myeloid leukemia cells with wild-type or mutant Bcr-Ablinvitro[J].ActaPharmacolSin, 2014,35(3):401-9.
[6] 于梦迪, 王明霞, 王海东.姜黄素逆转非小细胞肺癌分子靶向药物耐药的研究进展[J].中国药理学通报,2017,33(12):1633-7.
[6] Yu M D,Wang M X,Wang H D, et al. Research progress of reversion molecular targeted drug resistance in non-small cell lung cancer by curcumin[J].ChinPharmacolBull,2017,33(12):1633-7.
[7] Shakibaei M, Mobasheri A, Lueders C, et al. Curcumin enhances the effect of chemotherapy against colorectal cancer cells by inhibition of NF-κB and Src protein kinase signaling pathways[J].PLoSOne,2013,8(2):e57218.
[8] 翁光样, 杜 萌, 胡亮杉, 等.姜黄素对CD34+CD38-KG1a细胞增殖和凋亡的影响及其与白消安的协同效应[J].西安交通大学学报(医学版),2014,35(3):405-10.
[8] Weng G X, Tu M, Hu L S, et al. Effects of curcumin on proliferation and apoptosis of CD34+CD38-KG1a cells and its synergetic effect with busulfan[J].JXi'anJiaotongUniv(MedSci),2014,35(3):405-10.
[9] 刘 艳,刘中洋,袭荣刚,等.自噬与人类疾病最新研究进展[J].临床与实验病理学杂志,2014,30(7):771-4.
[9] Liu Y, Liu Z Y, Xi R G, et al. New research on autophagy and human diseases [J].JClinExpPathol, 2014,30(7):771-4.
[10] 邢丽娜,任金海,王 颖,等. 氯喹抑制的自噬对地西他滨促进髓性白血病细胞凋亡的影响[J]. 吉林大学学报(医学版),2017,43(5):937-42.
[10] Xing L N, Ren J H, Wang Y, et al. Influence of autophagy inhibited by chloroquine in apoptosis of myelogenous leukemia cells promoted by decitabine[J].JJilinUniv(MedEd),2017,43(5):937-42.
[11] Piya S, Kornblau S M, Ruvolo V R, et al. Atg7 suppression enhances chemotherapeutic agent sensitivity and overcomes stroma-mediated chemoresistance in acute myeloid leukemia[J].Blood, 2016,128(9):1260-9.
[12] Piya S, Andreeff M, Borthakur G. Targeting autophagy to overcome chemoresistance in acute myleogenous leukemia[J].Autophagy, 2017,13(1):214-5.
[13] 蒋卉男,胡 荣,刘卓刚.自噬与白血病治疗研究最新进展[J].中国实验血液学杂志,2015,23(1):290-4.
[13] Jiang H M, Hu R, Liu Z G. Latest advances of research on autophagy and leukemia treatment—review [J].ChinJExpHematol, 2015,23(1):290-4.
[14] Erlich S, Mizrachy L, Segev O, et al. Differential interactions between Beclin1 and Bcl-2 family members[J].Autophagy,2007,3(6):561-8.
[15] 叶 挺,邵增务. Bcl-2/Beclin1复合体在自噬中的调节作用[J]. 中国生物化学与分子生物学报,2013,29(6):513-9.
[15] Ye T, Shao Z W. The regulating effect of Bcl-2/Beclin1 complex in autophagy [J].ChinJBiochemMolBiol, 2013,29(6):513-9.
