化合物W3D通过调控TLR4-MyD88-NF-κB通路抑制LPS诱导的RAW264.7细胞炎症因子的释放
2018-07-04罗捷然李青山
罗捷然,赵 蓓,唐 莉,葛 睿,李青山,2
(1. 山西医科大学药学院,山西 太原030001 ;2. 山西中医药大学中药学院,山西 太原 030024)
炎症是机体受到外界刺激时所产生的损伤和抗损伤的双重反应,过度或持续的炎症反应可引起组织损伤和机能障碍[1-2],如癌症、动脉粥样硬化、神经退行性疾病、慢性炎性肠病、银屑病等[3-4]。目前,临床使用的抗炎药物主要有非甾体类抗炎药和甾体类抗炎药两大类,但服用后的不良反应不容忽视[5-6]。因此,发现活性更高、副作用更小的新型抗炎药物仍是该领域的研究热点。
苯并噁唑酮是一种具有抗炎、镇痛、抗肿瘤、抗菌、抗病毒、抗HIV和骨骼肌松弛等多种生物活性的天然物质[7-8]。课题组以苯并噁唑酮为母环进行了结构优化,并获得了一系列新型苯并噁唑酮衍生物[9-10],然而,该类化合物的抗炎作用靶点未知,作用机制尚不明确,严重制约了其进一步的合理设计与药理活性的深入研究。4-(5′-二甲氨基)-萘磺酰氧基苯并噁唑酮(W3D)为课题组设计合成的新型苯并噁唑酮衍生物,其命名及结构见Tab 1,前期活性筛选呈现出较好的体内抗炎活性,且较相同剂量阳性药塞来昔布无明显差别,然而其抗炎作用机制尚不明确。因此,本研究拟以化合物W3D为小分子探针,采用脂多糖(lipopolysaccharide, LPS)诱导的小鼠单核巨噬细胞RAW264.7作为体外炎症模型,通过测定炎症因子的表达评价其体外抗炎活性,并运用Western blot和RT-PCR技术,从信号通路的调控方面阐述其抗炎作用机制,为该类化合物的进一步合理设计提供依据。
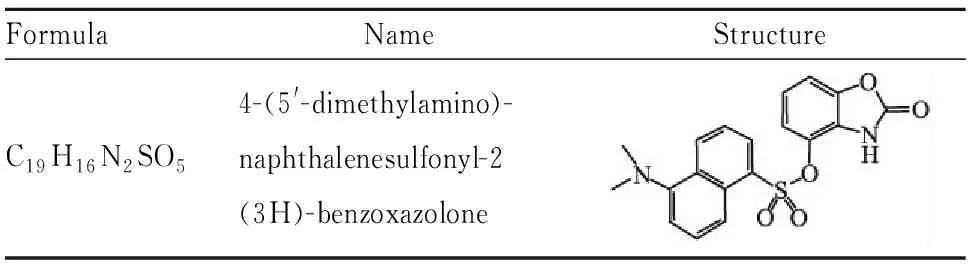
Tab 1 Name and structure of the compound W3D
1 材料
1.1细胞株小鼠单核巨噬细胞RAW264.7细胞株购自武汉博士德生物工程有限公司。
1.2药品与试剂化合物W3D由课题组合成,其结构经过确证,纯度≥98%,用于细胞实验的W3D均用DMSO溶液配制;DMEM高糖培养基、标准胎牛血清、小鼠肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白介素1β(interleukin 1β,IL-1β)、白介素6(interleukin 6,IL-6) ELISA检测试剂盒、胞核胞质蛋白提取试剂盒、辣根过氧化物酶标记二抗(武汉博士德生物工程有限公司);环氧合酶2(cyclooxygenase 2,COX-2) ELISA检测试剂盒(上海西塘生物可以有限公司);LPS(美国Sigma公司);Toll样受体4(Toll-like receptor 4,TLR4)、磷酸化白细胞介素1受体相关激酶4(phosphorylated interleukin-1 receptor-associated kinase 4,p-IRAK4)、髓样分化因子88(myeloid differentiation factor 88,MyD88)、核因子κB(nuclear factor κB,NF-κB)一抗(CST公司);RNAiso plus mRNA抽提试剂、荧光实时定量PCR逆转录试剂盒(TaKaRa公司)。
1.3仪器全波长多功能酶标仪、FQ-PCR仪(赛默飞世尔科技有限公司),光学倒置显微镜(重庆奥特光学仪器有限责任公司),二氧化碳培养箱(上海力申科学仪器有限责任公司)。
2 方法
2.1细胞培养将RAW264.7细胞置于含有10%胎牛血清的DMEM高糖培养液中,于37℃、5% CO2细胞培养孵箱中培养,取对数期细胞进行实验。
2.2MTT法检测化合物W3D对细胞活力的影响待细胞生长至90%,分别加入培养液、溶剂(DMSO)、W3D(6.25、12.5、25、50、100 μmol·L-1),继续培养24 h后弃去细胞上清液,每孔加入0.1 mL MTT(5 g·L-1),于37℃继续培养4 h,弃去上清后,每孔加入0.1 mL DMSO,振荡, 490 nm处检测吸光度,并计算细胞存活率。
2.3ELISA法检测细胞上清液中TNF-α、IL-6、IL-1β、COX-2的含量将对数期细胞接种于24孔板,待细胞密度长至70%~80%,随机分为空白对照组、模型组(1 mg·L-1LPS)、阳性药物组(25 μmol·L-1塞来昔布与LPS共同作用)、化合物组(6.25、12.5、25、50、100 μmol·L-1W3D与LPS共同作用),培养24 h后,吸取上清,采用ELISA法,检测TNF-α、IL-6、IL-1β、COX-2的含量,并计算其IC50值。
2.4Westernbolt法检测IL-6、TLR4、MYD88、p-IRAK4和NF-κB的蛋白表达分别收集空白对照组,模型组(1 mg·L-1LPS),化合物组(12.5、25、50 μmol·L-1W3D与LPS共同作用)细胞,PBS冲洗后,离心,收集细胞,用含有1% PMSF的RIPA高效细胞裂解液提取细胞蛋白, BCA法进行蛋白定量。于SDS-PAGE电泳进行蛋白分离,半干转膜仪转膜,5%脱脂奶粉封闭2~3 h,一抗孵育,4℃过夜,二抗孵育1 h,ECL超敏显影液显影,检测IL-6、TLR4、MyD88、p-IRAK4的蛋白表达。依照上述方法,采用胞质、胞核蛋白提取试剂,分别提取胞质与胞核蛋白,并进行SDS-PAGE、转膜、封闭、一抗、二抗和显影,检测胞质、胞核中NF-κB的蛋白表达。以β-actin为内参,并用灰度值计算目标蛋白的相对表达量。
2.5实时荧光定量PCR检测TLR4、MyD88、IL-6mRNA的表达将对数期细胞接种至6孔板,24 h后随机分为空白对照组、模型组(1 mg·L-1LPS)、化合物组(12.5、25、50 μmol·L-1W3D与LPS共同作用),继续培养24 h,弃去培养液,RNAiso plus mRNA抽提试剂抽提细胞总RNA,按照试剂盒说明步骤去除DNA杂质,进行反转录和扩增。采用实时荧光定量PCR方法,以GAPDH为参照基因,检测细胞中TLR4、MyD88、IL-6基因的相对表达。所有引物均由上海生工生物工程公司合成,引物序列见Tab 2。
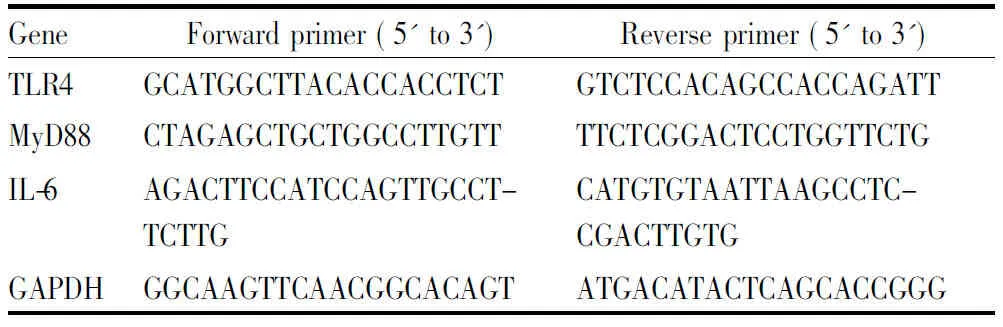
Tab 2 Primer sequence of quantitative real-time PCR

3 结果
3.1化合物W3D对RAW264.7细胞活力的影响如Fig 1所示,化合物W3D在0~100 μmol·L-1浓度下对RAW264.7细胞无明显毒性,其细胞活力与空白对照组相比差异无显著性。

Fig 1 Effects of W3D on viability of RAW264.7
3.2W3D对LPS诱导的RAW264.7细胞释放TNF-α、IL-6、IL-1β、COX-2的影响如Fig 2所示,

Fig 2 Effects of W3D on the release amount of IL-6(A), TNF-α (B), IL-1β(C) and COX-2(D) in RAW264. 7 cells stimulated by LPS ##P<0.01 vs control group; *P<0.05, **P<0.01 vs LPS group
化合物W3D对细胞培养上清液中TNF-α、IL-6、IL-1β有明显的抑制作用,且呈现一定的剂量依赖性,其中对IL-1β的抑制作用(IC50为20.07 μmol·L-1)与阳性药塞来昔布(IC50为17.94 μmol·L-1)比较差异无显著性,对IL-6的抑制作用(IC50为8.686 μmol·L-1)明显高于塞来昔布(IC50为36.31 μmol·L-1),呈现出较好的抗炎活性。但其对LPS所诱导的COX-2上调并无明显抑制作用。
3.3W3D对LPS诱导的RAW264.7细胞中IL-6、TLR4、MyD88、p-IRAK4和NF-κB蛋白表达的影响如Fig 3所示,与空白对照组相比,LPS可明显上调RAW264.7细胞中炎症效应蛋白IL-6和TLR4-NF-κB信号通路蛋白TLR4、p-IRAK4、MyD88的表达。化合物W3D的干预则可抑制IL-6、TLR4、MyD88的表达,抑制IRAK4的磷酸化,同时可抑制NF-κB的入核活化,且呈现良好的剂量关系。
3.4W3D对LPS诱导的RAW264.7细胞中TLR4、MyD88、IL-6mRNA表达的影响如Fig 4所示,LPS可明显上调RAW264.7细胞TLR4、MyD88、IL-6 mRNA的表达,而化合物W3D则对TLR4、MyD88、IL-6 mRNA的表达有明显的抑制作用,且呈现良好的剂量依赖性。
4 讨论
炎症因子在炎症的发生、发展中发挥着重要的作用,其中最为关键的炎症因子有TNF-α、IL-1β和IL-6。TNF-α是炎症反应过程中出现最早的炎性介质,可影响其他炎性因子的合成与释放,对机体组织代谢也具有重要的调节作用[11]。IL-1β与IL-6则参与机体的免疫应答,是炎性反应的促发剂。因此,抑制炎症因子的表达则可实现抗炎作用。实验结果表明,W3D可明显抑制小鼠RAW264.7巨噬细胞炎症因子TNF-α、IL-1β、IL-6的表达,尤其对IL-6的抑制活性明显优于阳性药塞来昔布,但该化合物对COX-2却没有抑制作用,因此,探究其抗炎作用机制并发现作用靶点将为该类药物的进一步研究提供重要依据。
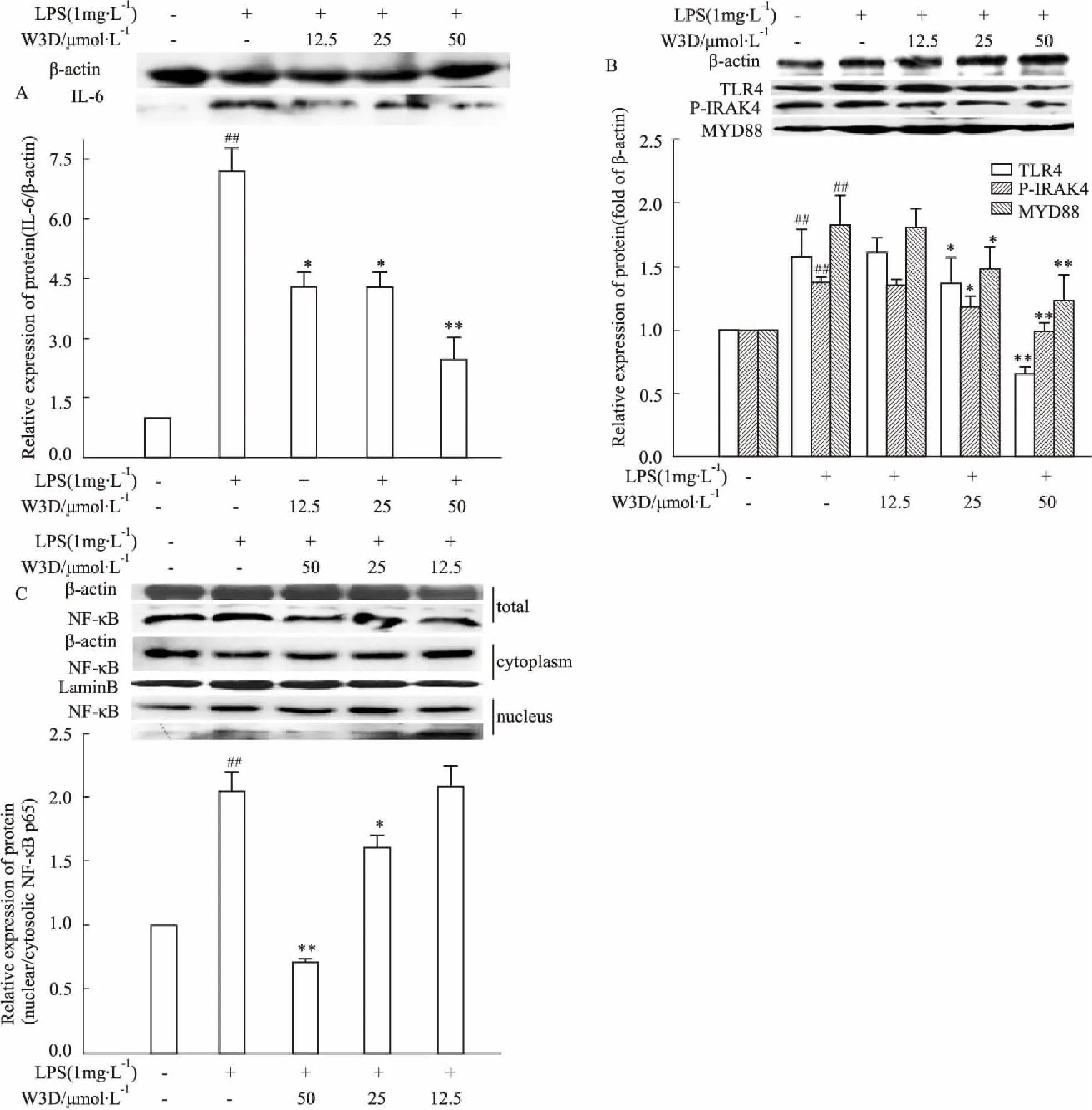

A: The protein levels of IL-6 in LPS-induced RAW264.7 cells treated with W3D; B: The protein levels of TLR4, p-IRAK4 and MyD88 in LPS-induced RAW264.7 cells treated with W3D; C: The protein levels of total cellular NF-κB, nucleus and cytoplasm NF-κB in LPS-induced RAW264.7 cells treated with W3D in LPS-induced RAW264.7 cells treated with W3D.##P<0.01vscontrol group;*P<0.05,**P<0.01vsLPS group.

Fig 4 Effects of W3D on the mRNA expression of TLR4, MyD88 and IL-6 on RAW264. 7 cells
##P<0.01vscontrol group;*P<0.05,**P<0.01vsLPS group
核转录因子NF-κB在炎症中发挥重要作用,IL-6、IL-1β、TNF-α等在炎症反应中发挥关键作用,细胞因子的转录表达都可以由激活的NF-κB调控[12-13],而TLR4则是激活NF-κB最主要的跨膜信号转运蛋白。本实验结果显示,化合物W3D可明显降低TLR4 的蛋白与mRNA表达水平,同时可抑制NF-κB的入核活化,因此,该化合物主要通过对TLR4-NF-κB信号通路的调控而发挥抗炎作用。
TLR4 可通过髓化分子(MyD88)途径与非髓化分子途径来实现对NF-κB调控作用,其中TLR4-MyD88-IRAK4-NF-κB信号通路是最为重要的炎症信号通路。TLR4可识别外界(LPS)炎性刺激,将胞外炎性信号转移至胞内重要衔接蛋白MyD88,接受到信号的MyD88可募集IRAK4,致使IRAK4磷酸化激活,通过下游一系列信号传递,最终使核转录因子NF-κB发生磷酸化修饰活化入核,进而启动炎性因子的转录,使得炎性因子大量产生与释放,从而促进炎症反应的发生与发展[14-15]。本实验结果显示,化合物W3D可以明显降低MyD88的蛋白与mRNA的表达,抑制IRAK4的磷酸化激活和NF-κB蛋白的入核活化,进而减少炎症因子TNF-α、IL-1β、IL-6的释放,发挥抗炎活性。因此,化合物W3D可能是通过对TLR4-MyD88-IRAK4-NF-κB信号通路的调控而发挥抗炎活性。
综上所述,化合物W3D可以通过调控LPS所激活的TLR4-MyD88-IRAK4-NF-κB炎症信号通路,抑制炎症因子IL-6、IL-1β、TNF-α的表达,从而发挥抗炎活性,且其对IL-6的抑制作用明显强于塞来昔布,呈现出较好的开发前景,但其抗炎作用机制还需进行更深入的研究。
(致谢:本文所有实验均在山西医科大学药学院药物化学实验室进行,在此对实验参加人员表示衷心的感谢!)
[1] 杜臻雁, 唐福林. 糖皮质激素抗炎作用机制的研究进展[J]. 中华医学杂志, 2006,86(35): 2512-5.
[1] Du Z Y, Tang F L. The progress and advances in studies on the anti-inflammatory mechanisms of glucocorticoid [J].NatlMedJChina, 2006,86(35): 2512-5.
[2] Qin J J, Wang W, Zhang R W. Novel natural product therapeutics targeting both inflammation and cancer [J].ChinJNatMed, 2017,15(6): 401-16.
[3] 于水莲, 陶 怡, 王羿升, 等. 炎症因素与早期类风湿关节炎心血管病变相关性研究[J]. 中华风湿病学杂志, 2016,20(11): 739-45.
[3] Yu S L, Tao Y, Wang Y S, et al. The correlation between inflammatory burden with cardiovascular diseases in patients with early rheumatoid arthritis [J].ChinJRheumatol, 2016,20(11): 739-45.
[4] Kim Y, Ahn C, Je J. Anti-inflammatory action of high molecular weight Mytilus edulis hydrolysates fraction in LPS-induced RAW264.7 macrophage via NF-κB and MAPK pathways [J].FoodChem, 2016,202:9-14.
[5] A Martelli, L Testai, M Anzini, et al. The novel a-inflammatory agent VA694, endowed with both NO-releasing and COX2-selective inhibiting properties, exhibits NO-mediated positive effects on blood pressure, coronary flow and endothelium in an experimental model of hypertension and endothelial dysfunction [J].PharmacolRes, 2013,78: 1-9.
[6] Elsaman T, Aldeeb O A A, Aboul-Fadl T, et al. Synthesis, characterization and pharmacological evaluation of certain enzymatically cleavable NSAIDs amide prodrugs [J].BioorgChem, 2017,70: 144-52.
[7] Deng B L, Cullen M D, Zhou Z G, et al. Synthesis and anti-HIV activity of new alkenyldiaryl-methane(ADAM)non-nucleoside reverse transcriptase inhibitors(NNRTIs) incorporating benzoxazolone and benzisoxazole rings [J].BioorgMedChem, 2006,14(7): 2366-74.
[8] Tang L, Ma W, Ma Y, et al. Synthesis and biological activity of 4-substituted benzoxazolone derivatives as a new class of sEH inhibitors with high anti-inflammatory activity in vivo [J].BioorgMedChemLett, 2013,23(8): 2380-3.
[9] 唐 莉, 班树荣, 林文瀚, 等. 天然产物4-O-B-D-葡萄糖-苯并噁唑酮及4-取代苯并噁唑酮类衍生物的合成与其活性研究[J]. 中国药物化学杂志, 2009,19(1): 31-5.
[9] Tang L, Ban S R, Lin W H, et al. Synthesis and activities of natural product 4-O-β-D-glucopyranosyl-benzoxazolin-2(3H)-one and derivatives of 4-substituted benzoxazolone [J].ChinJMedChem, 2009,19(1): 31-5.
[10] 罗捷然, 唐 莉, 葛 睿, 等, 新型苯并噁唑酮类衍生物4-邻甲基苯磺酰氧基-苯并噁唑酮(MBB)抗炎作用的研究[A]. 中国药学会第十三届青年药学科研成果交流会论文集[C]. 2016: 5.
[10] Luo J R, Tang L, Ge R, et al. Study on anti-inflammatory effect of 4-(2-methylphenylsulfonyloxy)-2(3H)-benzoxazolone(MBB) [A]. Conference proceedings of the thirteenth session of National youth pharmaceutical scientific research achievement exchange of China pharmaceutical association[C]. 2016: 5.
[11] 陈焕琦, 张子恒, 周 磊, 等. OSAHS 患者围手术期应用西吡氯铵含片的疗效研究[J]. 临床耳鼻咽喉头颈外科杂志, 2017,31(14): 1123-6.
[11] Chen H Q, Zhang Z H, Zhou L, et al. Effect of cetylpyridinium chloride Buccal tablets on perioperative application of OSAHS patients [J].JClinOtorhinolarynglolgyHeadNeckSurg, 2017,31(14): 1123-6.
[12] Suzuki A, Hanada T, Mitsuyama K, et al. CIS3/SOCS3/SSI3 plays a negative regulatory role in STAT3 activation and intestinal inflammation [J].JExpMed, 2001,193(4): 471-81.
[13] 李德川, 鲍秀琦, 张德武, 等. 去氢丹参新酮对神经炎症的抑制作用及机制研究[J]. 中国药理学通报, 2016,32(2): 177-83.
[13] Li D C, Bao X Q, Zhang D W, et al. The anti-neuroinflammatory effects of dehydromiltirone and related mechanisms [J].ChinPharmacolBull, 2016,32(2): 177-83.
[14] Woo H J, Lee J Y, Park H S, et al. Anti-inflammatory action of 2-carbomethoxy-2, 3-epoxy-3-prenyl-1, 4-naphthoquinone (CMEP-NQ) suppresses both the MyD88-dependent and TRIF-dependent pathways of TLR4 signaling in LPS-stimulated RAW264. 7 cells [J].JEthnopharmacol, 2017,205: 103-15.
[15] 雷升萍, 王 靓, 龙子江, 等. 黄精多糖通过 TLR4-MyD88-NF-κB 通路抑制缺氧/复氧 H9c2 心肌细胞炎性因子释放[J]. 中国药理学通报, 2017,33(2), 255-60.
[15] Lei S P, Wang L, Long Z J, et al. Inhibitory effect of polygonatum sibiricum polysaccharides release of inflammatory cytokines of anoxia/reoxygenation H9c2 myocardial cells through TLR4-MyD88-NFκB signaling pathway [J].ChinPharmacolBull, 2017,33(2), 255-60.
