黄花乌头多糖对TGF-β诱导内皮间质转化的保护作用及机制研究
2018-07-04李亚青蒋嘉烨李汉清刘佳琪干仲元
李亚青,可 燕,蒋嘉烨,李汉清,刘佳琪,栗 源,干仲元
(上海中医药大学教学实验中心,上海 201203)
内皮间质转化(endothelial-mesenchymal transition,EndMT)是内皮细胞在特殊生理或病理条件下失去内皮细胞特征,表达间质细胞特征的过程,属于上皮间质转化(epithelial-mesenchymal transition,EMT)的一种。其主要特性是细胞骨架发生变化,内皮细胞间黏附力逐渐降低直至失去,内皮细胞标志蛋白减少,间质细胞标志蛋白及纤维细胞特异性蛋白增多[1]。近年来,越来越多的研究表明,多种疾病的发生、发展进程都涉及到EndMT,如动脉粥样硬化[2]、心肌纤维化[3]、肺动脉高血压[4]等各种心血管疾病。因此,寻找以EndMT为靶点的天然药物具有非常重要的意义。
黄花乌头[Aconitumcoreanum(H.Lév.)Raipaics]是毛茛科乌头属植物,块根入药,中药名为关白附、白附子、竹节白附,具有祛风痰、逐寒湿、止痛的功效[5]。20世纪60年代至今,黄花乌头的有效成分分离及药理研究主要集中在生物碱如盐酸关附甲素方面[6-7],关于其多糖成分的研究很少。本课题组首次从黄花乌头中分离并鉴定出1种均一多糖(Aconitum coreanum polysaccharides,ACP),其结构见Fig 1A。并且已验证ACP在脂多糖诱导的巨噬细胞RAW炎症模型中,可通过NF-κB信号途径剂量依赖性地抑制炎症因子TNF-α、IL-1β、iNOS和IL-6的表达[8]。本研究拟通过建立转化生长因子-β(transforming growth factor-β,TGF-β)诱导人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)EndMT模型,观察ACP 抑制EndMT的作用及相关机制。
1 材料
1.1细胞系HUVEC购自ATCC(ATCC-CRL-1730TM)。
1.2药物与试剂黄花乌头药材(批号:150910),购于上海康桥中药饮片有限公司;ACP为本课题组自制。TGF-β购于Peprotech公司;内皮细胞生长因子(endothelial cell growth supplement,ECGS)购于Sciencell公司;肝素购于Biosharp公司;RIPA、PMSF,购于上海威奥生物科技有限公司;CD31抗体(ab64543)购自Abcam公司;α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)抗体(23081-1-AP)购自Proteintech公司;Smad2抗体(D43B4)、p-Smad2抗体(D27F4)、Smad3抗体、p-Smad3抗体(C25A9),均购自美国Cell Signaling Technology公司;CCK-8检测试剂盒购自碧云天生物技术研究所;DMEM培养基(SH30021.01)购于HyClone公司;DPBS、胎牛血清(FBS)、胰酶,均购自美国Gibco公司。
1.3仪器超净台(苏净安泰);显微镜(日本Olympus公司);Galaxy 170S CO2培养箱(Eppendorf公司);电泳仪(美国Bio-Rad公司);化学发光成像系统(上海天能科技有限公司);Cellometer Mini细胞计数仪(Nexcelom);酶标仪(Molecular devices)。
2 方法
2.1ACP的制备ACP的制备方法参见文献[8],经高效液相测定含量为98%。用DPBS作为溶剂,超声溶解,配制成10 g·L-1的母液,加药前用DMEM培养基分别稀释成所需浓度。
2.2HUVEC的培养HUVEC细胞复苏,培养条件为37℃、95%湿度、5% CO2的细胞培养箱,培养基为含10% FBS、肝素、ECGS的DMEM培养基,3~5 d后细胞融合度到80%~90%时,采用胰酶进行消化、离心、混悬操作,按照1 ∶3比例传代。
2.3细胞分组与给药模型建立:HUVEC分为5组,用浓度为0、1、5、10、20 μg·L-1的TGF-β刺激细胞,孵育72 h。药物干预:HUVEC分为5组,为空白对照组(DMEM培养基)、模型组(10 μg·L-1TGF-β)、给药组[10 μg·L-1TGF-β+ ACP(50、100、200 mg·L-1)]。孵育72 h。
2.4CCK-8细胞增殖毒性实验将HUVEC消化、离心、混悬,加入到96孔板中,每孔100 μL,密度控制在每孔5×103个细胞,每个浓度设3个复孔,培养24 h,采用不同浓度的ACP分别干预HUVEC,36 h后加入CCK-8试剂,每孔10 μL,孵育4 h,450 nm处测定吸光度。
2.5划痕实验当HUVEC融合度到80%~90%时,接种到12孔板,贴壁培养12 h后,采用20 μL枪头在12孔板内垂直划痕,用DPBS轻洗3次,按照“2.3”项下方法分组,无血清给药处理24 h后,每组随机选择4个平行标记点,于显微镜下观察细胞迁移情况,并计算细胞迁移距离:迁移距离d=(0 h划痕的平均面积-24 h划痕的平均面积)/划痕长度。
2.6Westernblot实验将培养皿中的培养基弃去,用DPBS轻洗2遍,加入蛋白裂解液(RIPA ∶PMSF=50 ∶1)100 μL,冰上裂解5 min,刮板刮下蛋白收集到离心管中,超声,离心,取上清液,考马斯亮蓝法蛋白定量,并由制备的标准曲线求出各样本蛋白的最终浓度,调整总蛋白含量一致后,加入4×蛋白上样缓冲液混合,95℃加热10 min使充分变性。配胶,每孔15 μL进行10% SDS-PAGE凝胶电泳(80 V,30 min;120 V,1.5 h),将蛋白以250 mA、2 h转移到PVDF膜上,奶粉封闭1 h,相应一抗4℃孵育过夜,TBST洗膜。相应二抗孵育1 h,TBST洗膜后显影,使用图像分析软件检测各组蛋白的相对密度(以GAPDH为内参)。
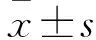
3 结果
3.1ACP含量测定ACP的提取率为0.05%,经高效液相测定含量为98%(Fig 1)。

Fig 1 Structure (A) and HPLC (B) of ACP
3.2ACP对HUVEC生长活性的影响Fig 2的CCK-8检测结果显示,与空白对照组相比,不同浓度ACP干预HUVEC 36 h后,细胞活性明显增加(P<0.05),提示ACP对HUVEC细胞的生长有促进作用。
3.3TGF-β诱导HUVECEndMT模型以不同浓度TGF-β诱导HUVEC EndMT发生(Fig 3),当TGF-β浓度≥10 μg·L-1时,内皮特异性标志物CD31蛋白表达明显下降(P<0.05),间质细胞特异性标志物α-SMA蛋白表达明显增加(P<0.05)。故选用TGF-β(10 μg·L-1)刺激72 h为造模条件。
3.4ACP对TGF-β诱导HUVEC迁移能力的影响Fig 4划痕实验结果显示,模型组在给予10 μg·L-1TGF-β处理后,24 h内细胞迁移率明显增高,表明TGF-β可以促进细胞迁移;与模型组相比,ACP(50、100、200 mg·L-1)处理24 h内细胞迁移率明显降低,表明ACP可以抑制由TGF-β引起的细胞迁移增强,并有剂量依赖性。
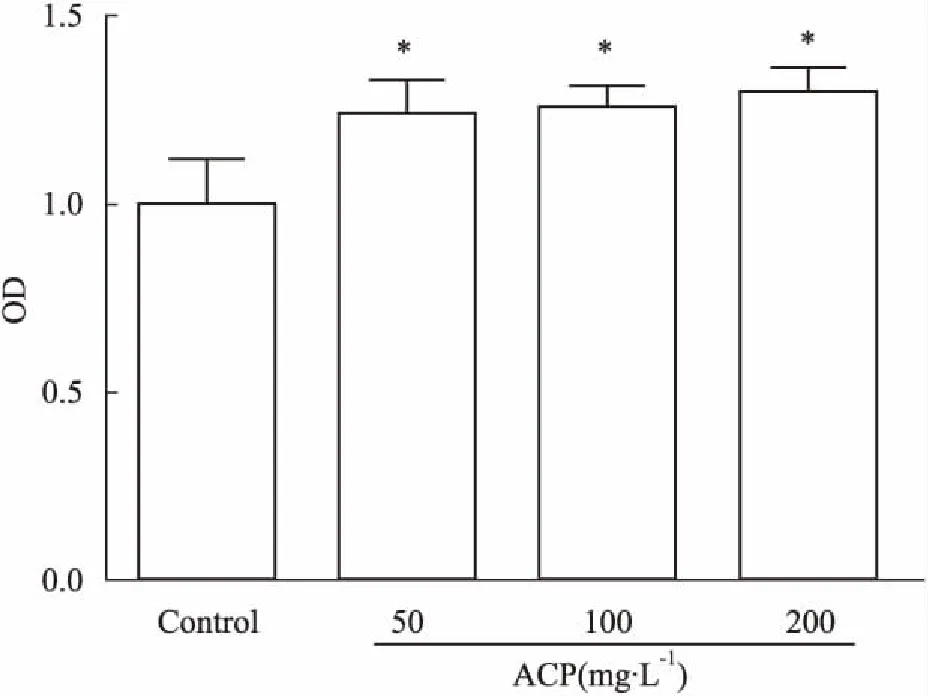
Fig 2 Effects of ACP at various concentrations
*P<0.05vscontrol group
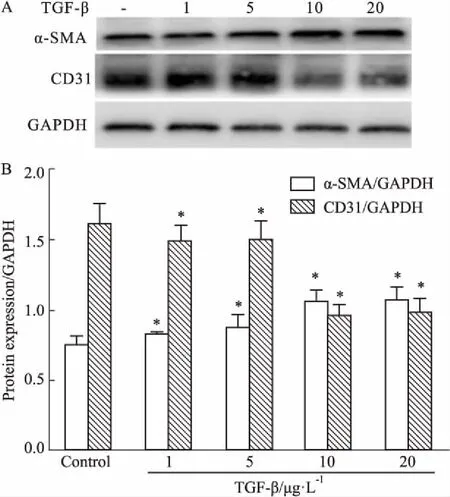
Fig 3 Effects of TGF-β on protein levels of CD31,
A:α-SMA, CD31 expressions were detected by Western blot; B: Density analysis of protein expression.*P<0.05vscontrol group.
3.5ACP对HUVECEndMT相关蛋白表达的影响TGF-β刺激HUVEC后,内皮特异性标志物CD31蛋白表达明显下降(P<0.05),间质细胞特异性标志物α-SMA蛋白表达明显增强(P<0.05)。与模型组相比,TGF-β与ACP共培养可明显抑制这种情况,且具有剂量依赖性(Fig 5)。
Fig 4 Effects of ACP on cell mobility tested by wound
A:ACP suppressed the transfer ability induced by TGF-β; B:Distance migrated of HUVECs.*P<0.05vscontrol group;#P<0.05vsTGF-β-treated cells.
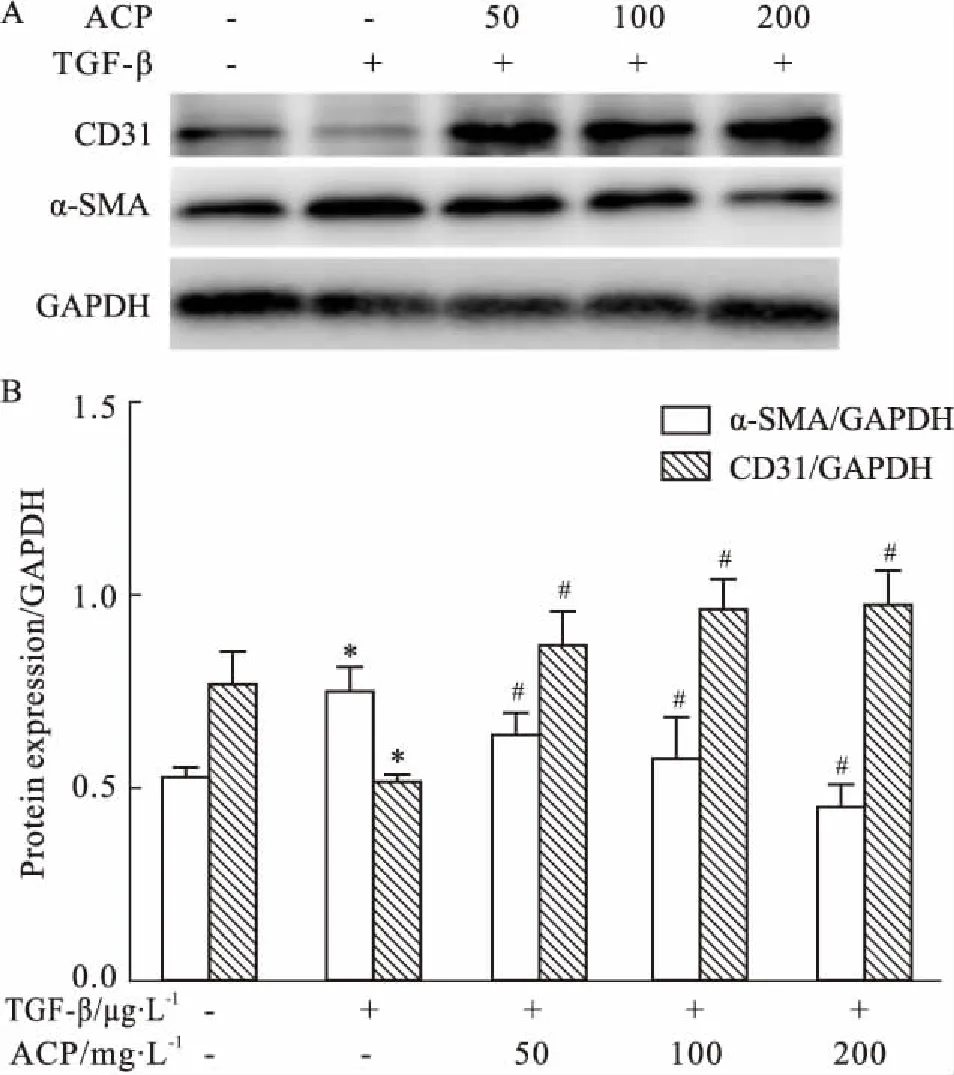
Fig 5 Effects of ACP on expression of CD31, α-SMA in HUVECs induced by
A:ACP inhibited expression of CD31, α-SMA induced by TGF-β; B: Density analysis of CD31 and α-SMA.*P<0.05vscontrol group;#P<0.05vsTGF-β-treated cells.
3.6ACP对TGF-β/Smad2/3信号通路的影响为进一步探讨ACP抑制EndMT的机制,测定了TGF-β诱导下Smad2/3及磷酸化Smad2/3的蛋白表达。Fig 6的Western blot 结果表明,HUVEC经TGF-β诱导后,p-Smad2、p-Smad3表达明显增强(P<0.05);经ACP处理后,p-Smad2、p-Smad3水平相比于模型组明显下降(P<0.05),提示ACP通过TGF-β/ Smad2/3途径抑制EndMT。

Fig 6 Effects of ACP on expression of p-Smad2, p-Smad3 in HUVECs induced by
A: Western blot for protein levels of p-Smad2/3 and Smad2/3; B:Quantification of protein levels of p-Smad2/3 normalized to Smad2/3.*P<0.05vscontrol group;#P<0.05vsTGF-β-treated cells.
4 讨论
心血管疾病是目前人类致残、致死的主要原因之一,器官纤维化则是多种心血管疾病不断进展导致的终末阶段,可引发严重并发症,导致器官损伤,是目前临床面临的治疗难关[9]。因此,抑制器官纤维化的发生、发展是治疗心血管疾病的重要环节,对降低心血管疾病的致死风险具有重要意义。近年来研究表明,EndMT和心血管疾病的发生、发展关系密切,EndMT可促进内皮细胞向纤维样细胞转化,形成器官纤维化[10],最终导致动脉粥样硬化、高血压、糖尿病等心血管疾病的发生、发展[11]。因此,寻找以EndMT为靶点的天然药物可能为防治心脑血管疾病提供新的临床治疗思路。
多糖是具有抗病毒、免疫调节、抗肿瘤、抗氧化等多种生物学活性的天然高分子聚合物,广泛存在于动植物和微生物中,是近几年药物领域研究的热点。黄花乌头多糖有抗氧化、抗癌作用,我们前期从中分离纯化的多糖ACP具有较好的抗炎作用。在此基础上,本研究建立TGF-β诱导的HUVEC EndMT模型,考察ACP对EndMT过程的干预作用。结果显示,TGF-β诱导能明显增加细胞迁移能力,降低内皮细胞特异性标志蛋白CD31表达,增加间质细胞特异性标志蛋白α-SMA的表达,ACP能明显逆转这一过程,且具有剂量依赖性。
EndMT过程涉及了多个调节因子,其中TGF-β被认为是诱导EndMT发生的最明确的信号因子[12]。首先,TGF-β配体与内皮细胞膜上的TGF-β Ⅱ型丝氨酸/苏氨酸受体(TβRⅡ)结合形成异四聚体,活化跨膜I型受体使其磷酸化,激活TGF-β/Smad信号通路,使其下游细胞质中Smads家族的Smad2 和Smad3蛋白磷酸化形成p-Smad2/3,随后p-Smad2/3与通用型Smad4 形成复合物,转位到核内,这些杂聚肽Smad 复合体入核后,通过与其他转录因子协同作用来调节Snail、Twist1 和Slug核内特异靶基因的转录应答[13]。本研究结果表明,经 TGF-β诱导细胞72 h后,p-Smad2/3表达明显上调,ACP干预后可明显抑制p-Smad2/3表达。提示ACP对TGF-β诱导EndMT 有保护作用,其机制可能与抑制Smad2、Smad3磷酸化激活有关,关于Snail、Twist1 和Slug等核内靶基因指标的表达情况还有待进一步研究。
此外,既往研究证实,炎症和EndMT有紧密联系,Mahler等[14]的研究证明,炎性细胞因子可通过Akt/NF-κB通路,诱导胚胎和成年瓣膜内皮细胞间质转化。张利霞等[15]研究提示,高糖诱导小鼠肾小管上皮细胞EMT可能是通过激活NLRP3炎症小体,从而增加IL-1β分泌实现的。本课题组已经在体外证实了黄花乌头均一多糖ACP良好的抗炎效果,下一步我们也将对ACP是否能抑制炎症诱导的EndMT进行深入研究。
综上所述,本实验对ACP的研究为心血管疾病的新药开发或者辅助药物开发提供了一定的实验依据,为研究心脑血管疾病的发生、发展机制提供了一些新思路。
[1] Pinto M T,Covas D T,Kashima S,et al.Endothelial mesenchymal transition:comparative analysis of different induction methods[J].BiolProcedOnline,2016,18(1):10-8.
[2] 李红蓉,秘红英,孙 颖,等.内皮间质转分化在动脉粥样硬化中的研究进展[J].中国药理学通报,2017,33(10):1338-41.
[2] Li H R,Mi H Y,Sun Y,et al.Research progress of endothelial mesenchymal transition in atherosclerosis[J].ChinPharmacolBull,2017,33(10):1338-41.
[3] Zhou X,Chen X,Cai J J,et al.Relaxin inhibits cardiac fibrosis and endothelial-mesenchymal transition via the Notch pathway[J].DrugDesDevTher,2017,11:1159-71.
[4] 张卫芳,熊爱珍,吴卫华,等.肺动脉高压时肺血管内皮间质转化相关miRNAs网络调控的生物信息学分析[J].中国药理学通报,2016,32(9):1294-300.
[4] Zhang W F,Xiong A Z,Wu W H,et al.MicroRNAs integrates pathogenic signaling to control endothelial-mesenchymal transition in pulmonary hypertension: results of a network bioinformatic approach[J].ChinPharmacolBull,2016,32(9):1294-300.
[5] 国家中医药管理局《中华本草》编辑委员会.中华本草(精选本):上册[M].上海:上海科学技术出版社,1996.
[5] The state administration of traditional Chinese medicine《Chinese materia medica》editorial board. Chinese materia medica(JingXuanBen):volume one[M].Shanghai: Shanghai publisher of Science and Technology,1996.
[6] 杨萌萌,范新荣,蔡 琳,等.盐酸关附甲素抗心律失常研究进展[J].心血管病学进展,2013,34(5):660-4.
[6] Yang M M,Fan X R, Cai L, et al. Research progress of Guanfu base A about antiarrhythmia[J].AdvCardiovascDis,2013,34(5):660-4.
[7] 陆家凤,可 燕,蒋嘉烨, 等.盐酸关附甲素对大鼠血管舒缩功能的影响及其机制[J].中国药理学通报,2012,28(7):952-5.
[7] Lu J F,K Y,Jiang J Y,et al.Effects and machanisms of Guanfu base-A on vasomotion of rats[J].ChinPharmacolBull,2012,28(7):952-5.
[8] Li X J,Jiang J Y,Shi S S,et al. ARG-II type polysaccharide purified from Aconitum coreanum alleviates lipopolysaccharide-induced inflammation by inhibiting the NF-kB signal pathway[J].PLoSOne,2014,9(6):e99697-711.
[9] Chaturvedi R R,Herron T,Simmons R,et al.Passive stiffness of myocardium from congenital heart disease and implications for diastole[J].Circulation,2010,121(8):979-88.
[10] Bao M H,Feng X,Zhang Y W,et al.Let-7 in cardiovascular diseases, heart development and cardiovascular differentiation from stem cells[J].IntJMolSci,2013,14(11):23086-102.
[11] Favero G,Paganelli C,Buffoli B,et al. Endothelium and its alterations in cardiovascular diseases: life style intervention[J].BiomedResInt,2014,2014(2):801896-924.
[12] Leask A. Getting to the heart of the matter[J].CircRes,2015,116(7):1269-76.
[13] Ji Y,Dou Y N,Zhao Q W,et al.Paeoniflorin suppresses TGF-beta mediated epithelial-mesenchymal transition in pulmonary fibrosis through a Smad-dependent pathway[J].ActaPharmacolSin,2016,37(6):794-804.
[14] Mahler G J,Farrar E J,Butcher J T. Inflammatory cytokines promote mesenchymal transformation in embryonic and adult valve endothelial cells[J].ArteriosclThromVas,2013,33(1):121-30.
[15] 张利霞,弓晓丽,刘 虹.NLRP3炎症小体在高糖诱导小鼠肾小管上皮细胞EMT中的作用[J].长治医学院学报,2017,31(1):16-9.
[15] Zhang L X,Gong X L,Liu H.Role of NLRP3 inflammsome in epithelial-mesenchymal transition induced by high glucose in mouse renal tubular epithelial cell[J].JChangzhiMedColl,2017,31(1):16-9.
