碳源、生长素及诱导子对木豆不定根生长和次生代谢产物合成的影响
2018-06-23范艳敏党士坤王文杰王慧梅
范艳敏 党士坤 王文杰 王慧梅
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
木豆(Cajanuscajan(Linn.) Millsp.)为豆科(Leguminosae)蝶形花亚科(Papilionaceae)木豆属(Cajanus)植物,具有广泛的食用及药用价值。已有研究表明,黄酮类化合物(Flavonoids)及芪类化合物(Stilbenes)为木豆的主要药用活性成分,其中具有2-苯基色原酮(flavone)结构化合物的黄酮类化合物是一类存在于自然界的一类低分子天然植物成分,具有降血压、抗炎、抗过敏、解痉、利尿的作用,此外,还具有抗菌、抗病毒、抗肿瘤、抗感染、抗氧化和清除自由基等作用。次生代谢产物染料木素、芹菜素、牡荆苷、异牡荆苷及荭草苷是木豆根中主要的黄酮类化合物,其中染料木素为异黄酮结构化合物,芹菜素为黄酮结构化合物,因两者均具有很强的药理活性,附加值高、市场需求大,故成为药品、保健品和食品添加剂的重要原料[1~4]。
许多物种的不定根培养具有稳定合成次生代谢物质的能力[5~6]。由于遗传和生物合成的稳定性,利用不定根培养生产次生代谢产物非常具有吸引力[5]。近年来,国内外通过培养不定根生产有用的次生代谢产物的研究日益活跃,此技术已在人参等多种药用植物中得以成功应用[7~10]。不定根的生长及次生代谢产物的合成受许多理化因子的影响[11~12]。培养基的初始蔗糖浓度对不定根的生长有很大的影响,蔗糖的浓度过低或过高都不利于不定根的生长,而且蔗糖浓度对不定根的次生代谢产物合成也有重要影响[13~14]。植物生长素对不定根的诱导及增殖起着关键的作用[15],IBA对大多数植物的不定根诱导和生长有很好的效果[5]。通过植物组织培养生产次生代谢产物时,往往添加诱导子来改变细胞的代谢途径和代谢强度,从而提高植物组织培养中有用次生代谢产物的积累,近年来被得到了广泛地应用[16~17]。
迄今为止,尚未有关于木豆不定根培养的相关研究,本实验以木豆无菌苗的不定根为实验材料,初步研究不同理化因子对木豆不定根生物量和次生代谢产物合成的影响,为木豆不定根的大规模培养奠定基础。
1 研究材料与方法
1.1 研究材料
木豆不定根的获得:剪取苗龄15 d左右的木豆无菌苗的不定根,培养在1/2MS+20 g·L-1蔗糖的液体培养基(pH=5.8)中,培养10 d后,收集不定根,用于实验。
1.2 研究方法
1.2.1不同蔗糖浓度对木豆不定根生长及次生代谢产物的影响
剪取木豆不定根鲜重0.5 g,接种于100 mL分别添加了10、20、30、40 g·L-1蔗糖的1/2MS液体培养基中,3次重复,于第25 d时收集样品测定木豆不定根的鲜重、干重并测定染料木素和芹菜素的含量。
1.2.2不同IBA浓度对木豆不定根生长及次生代谢产物的影响
剪取木豆不定根鲜重0.5 g,接种于100 mL分别添加了0.1、0.3、0.5、1.0 mg·L-1IBA的1/2MS+30 g·L-1蔗糖的液体培养基中,3次重复,于第25 d时收集样品测定木豆不定根的鲜重、干重并测定染料木素和芹菜素的含量。
1.2.3不同浓度的MJ对木豆不定根生长及次生代谢产物的影响
剪取木豆不定根鲜重0.5 g,接种于100 mL的1/2MS+30 g·L-1蔗糖的液体培养基中,于第15 d添加不同浓度的MJ(0,50,100,200 μmol·L-1),3次重复,培养10 d收集样品,测定木豆不定根的鲜重、干重并测定染料木素和芹菜素的含量。
1.2.4不同浓度的SA对木豆不定根生长及次生代谢产物的影响
剪取木豆不定根鲜重0.5 g,接种于100 mL的1/2MS+30 g·L-1蔗糖的液体培养基中,于第15 d添加不同浓度的SA(0,50,100,200 μmol·L-1),3次重复,培养10 d收样,测定木豆不定根的鲜重、干重并测定染料木素和芹菜素的含量。
1.2.5木豆不定根中染料木素和芹菜素含量的测定方法
染料木素和芹菜素的提取方法(超声提取法)将收集的的木豆不定根样品于60℃烘干,用研钵研磨成粉末,称取一定量的样品粉末于10 mL离心管中,按液料比40∶1加入70%乙醇,在60℃下超声提取,在5 000 r·min-1下离心15 min,将沉淀物再次按照上述方法处理两次,合并上清液,将上清液在70℃水浴条件下将其浓缩至一定体积,最后将提取液用0.45 μm的微孔滤膜过滤后用于HPLC检测。
使用的HPLC系统由Waters 1525二元高效液相色谱仪、Waters 2478检测器和Waters Sun Fire C18色谱柱(250 nm×4.6 mm,5 μm)组成。流动相为甲醇∶水∶甲酸=65∶34.935∶0.065(V∶V∶V),流速为1 mL·min-1,进样量为10 μL,柱温30℃,检测波长260 nm。测得的标准品的标准曲线方程如表1,通过标准曲线的方程来计算染料木素和芹菜素的含量。
表1标准品标准曲线方程
Table1Standardcurveequationsofreferencecompounds

次生代谢产物Secondary metabolite标准品—标准曲线Standard-standard curveR2值R2 value染料木素Genisteiny=105418.87x+132163.530.9998芹菜素Apigeniny=37105x-8447.20.9991
注:x.标准品的浓度;y标准品的峰面积
Note:x.Concentration of the standard product;y. Peak area of the standard product
1.2.6 木豆不定根鲜重及干重测定
不定根鲜重的测定:将木豆不定根从液体培养基中取出,用蒸馏水冲洗后,用滤纸吸干水分后进行称量,即为鲜重。
不定根干重的测定:将木豆不定根从液体培养基中取出,用蒸馏水冲洗后,用滤纸吸干水分,放入40℃的烘箱中,烘干至恒重,即为干重。
1.3 数据分析
实验结果采用SPSS 17.0统计软件进行数学统计分析,多重比较采用Duncan法。
2 结果与分析
2.1 不同浓度蔗糖对木豆不定根的影响
2.1.1 不同浓度蔗糖对木豆不定根生物量的影响
由表2可知,蔗糖浓度为10 g·L-1时,不定根分化少,生长极其缓慢;蔗糖浓度分别为20和30 g·L-1时,不定根生长状况好,不定根分化多,生长旺盛,蔗糖浓度为30 g·L-1时,不定根鲜重为2.12 g和干重为0.30 g,均达到最大值。蔗糖浓度为40 g·L-1时,不定根出现玻璃化现象,生长速度缓慢,分支少,这表明蔗糖浓度过高会抑制不定根的生长。因此,30 g·L-1蔗糖为木豆不定根培养的最佳碳源。
表2不同浓度蔗糖对木豆不定根生物量的影响
Table2EffectsofdifferentcontentsofsucroseonthebiomassofadventitiousrootsofC.cajan(Linn.)Millsp.
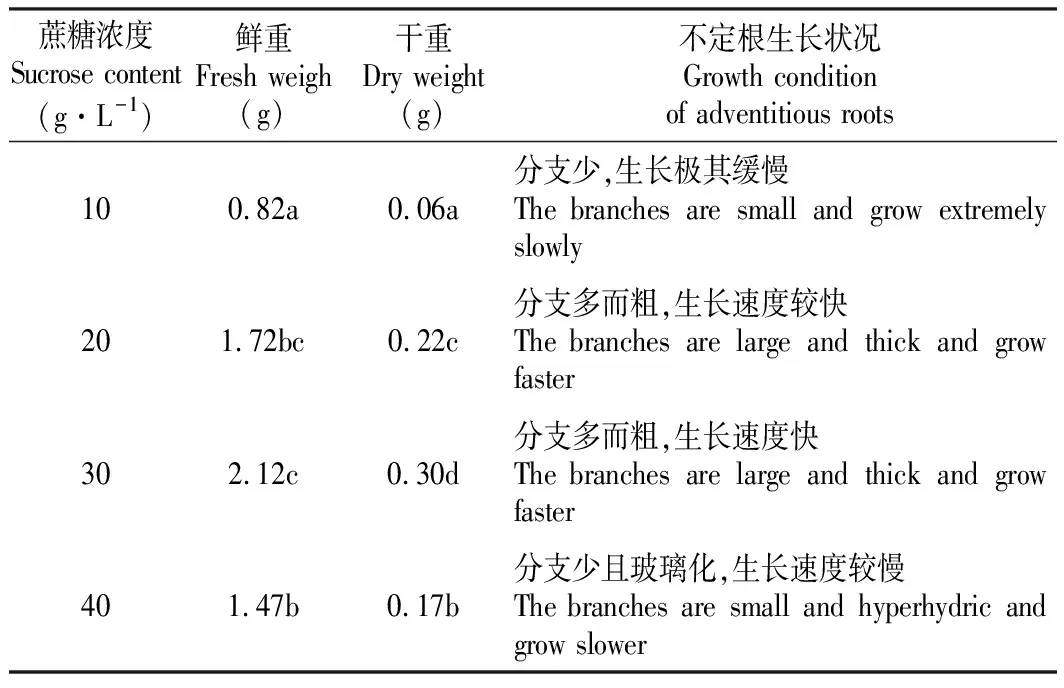
蔗糖浓度Sucrose content(g·L-1)鲜重Fresh weigh(g)干重Dry weight(g)不定根生长状况Growth condition of adventitious roots100.82a0.06a分支少,生长极其缓慢The branches are small and grow extremely slowly201.72bc0.22c分支多而粗,生长速度较快The branches are large and thick and grow faster302.12c0.30d分支多而粗,生长速度快The branches are large and thick and grow faster401.47b0.17b分支少且玻璃化,生长速度较慢The branches are small and hyperhydric and grow slower
注:同列不同小写字母表示在0.05水平上差异显著,下同。
Note:Different letters within the same column indicates significant difference at 0.05 level,the same as below.
2.1.2不同浓度蔗糖对木豆不定根染料木素和芹菜素含量的影响
从图1可以看出,染料木素的含量在蔗糖浓度10~30 g·L-1范围内,随着蔗糖浓度的提高而增加。蔗糖浓度为30 g·L-1时,其含量达到最大值为0.64 mg·g-1。蔗糖浓度为40 g·L-1时,染料木素的含量降低,这说明蔗糖浓度过高会抑制染料木素的合成;低浓度蔗糖有利于芹菜素的积累,蔗糖浓度为10 g·L-1时,芹菜素的含量为最大值0.07 mg·g-1,是蔗糖浓度为40 g·L-1时芹菜素含量的3.6倍,表明高浓度的蔗糖对芹菜素的合成起到抑制作用。
2.2 不同浓度IBA对木豆不定根影响
2.2.1 不同浓度IBA对木豆不定根生物量的影响
从表3数据及不定根的生长状态可以看出,IBA浓度在0.1~1.0 mg·L-1范围内,有利于木豆不定根的生长,并且IBA浓度为0.1 mg·L-1时,不定根的鲜重和干重均达到最大值,分别为5.42和0.67 g。当IBA浓度大于0.1 mg·L-1时,不定根的生长状况均不良,不定根的生物量有所降低。因此得出低浓度IBA促进不定根生长,高浓度IBA抑制不定根生长,适合木豆不定根生长的IBA的最佳浓度为0.1 mg·L-1。

图1 不同浓度蔗糖对木豆不定根染料木素和芹菜素含量的影响Fig.1 Effects of different contents of sucrose on the contents of genistein and apigenin
Table3EffectsofdifferentcontentsofIBAonthebiomassofadventitiousrootsofC.cajan(Linn.)Millsp.

IBA浓度IBA content(mg·L-1)鲜重Fresh weigh(g)干重Dry weigh(g)不定根生长状况Growth condition of adventitious roots0.15.42b0.67c分支多而粗,生长速度快The branches are large and thick and grow faster0.33.87ab0.47b分支少且玻璃化,生长速度慢The branches are small and hyper-hydric and grow slower 0.54.34ab0.51b分支少且玻璃化,生长速度慢The branches are small and hyper-hydric and grow slower1.03.54a0.35a分支少且玻璃化, 生长速度慢The branches are small and hyper-hydric and grow slower

图2 不同IBA浓度对木豆不定根染料木素和芹菜素含量的影响Fig.2 Effects of different contents of IBA on the contents of genistein and apigenin
2.2.2不同IBA浓度对木豆不定根染料木素和芹菜素含量的影响
如图2可知,IBA浓度在0.1~1.0 mg·L-1时,染料木素的含量随着IBA浓度的增加而降低,说明较高浓度的IBA对染料木素的合成表现出抑制作用。当IBA浓度为0.1 mg·L-1时,染料木素含量达到最大值1.31 mg·g-1。当IBA浓度为0.3 mg·L-1时,芹菜素含量最高,为0.12 mg·g-1,但与IBA浓度为0.1 mg·L-1时的芹菜素含量无显著性差异,且当IBA浓度大于0.3 mg·L-1时,芹菜素的合成降低,这说明高浓度的IBA对芹菜素的合成表现出抑制作用。
2.3 不同浓度的MJ对木豆不定根的影响
2.3.1不同浓度的MJ对木豆不定根生物量的影响
从表4可以看出,不同浓度的MJ处理中,木豆不定根生物量的累积无显著差异(P>0.05),木豆不定根分支多而粗,生长速度快,这表明在0~200 μmol浓度范围内,MJ对木豆不定根生物量几乎无影响。
2.3.2不同浓度的MJ对木豆不定根染料木素和芹菜素含量的影响
图3表明,MJ浓度的范围在0~200 μmol·L-1时,染料木素和芹菜素的含量随着MJ浓度的增加呈先增加后降低的趋势,并且两者都在MJ浓度为100 μmol·L-1时,含量达到最大值,染料木素为0.83 mg·g-1,芹菜素为0.15 mg·g-1。这表明当MJ浓度高于100 μmol·L-1时,会抑制木豆不定根次生代谢产物染料木素和芹菜素的合成。
2.4 不同浓度的SA对木豆不定根的影响
2.4.1 不同浓度的SA对木豆不定根生物量的影响
表4不同MJ浓度对木豆不定根生物量的影响
Table4EffectsofdifferentcontentsofMJonthebiomassofadventitiousrootsofC.cajan(Linn.)Millsp.
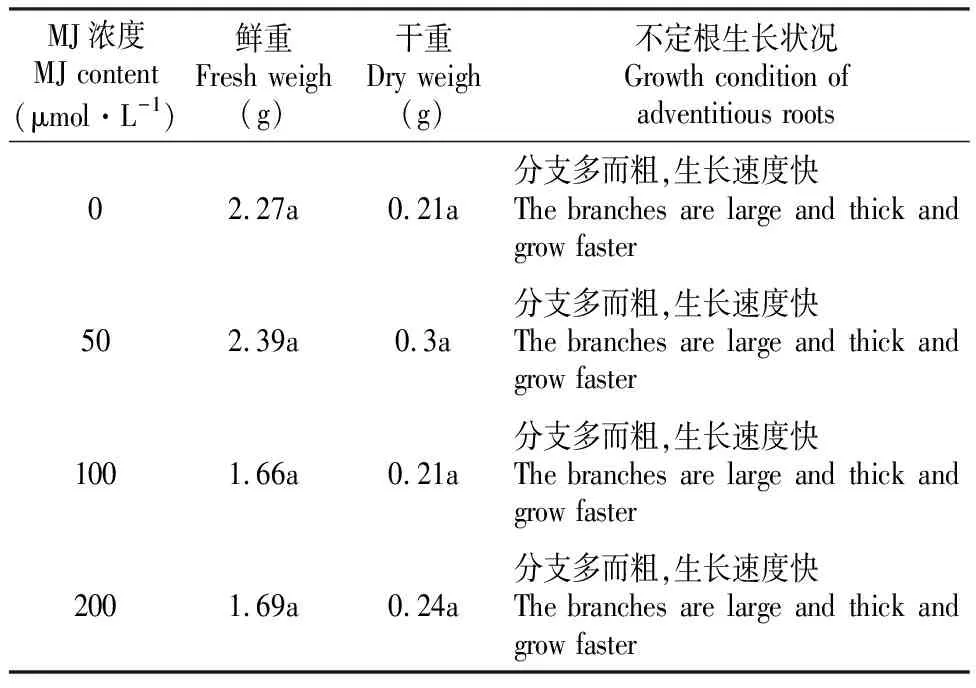
MJ浓度MJ content(μmol·L-1)鲜重Fresh weigh(g)干重Dry weigh(g)不定根生长状况Growth condition of adventitious roots02.27a0.21a分支多而粗,生长速度快The branches are large and thick and grow faster502.39a0.3a分支多而粗,生长速度快The branches are large and thick and grow faster1001.66a0.21a分支多而粗,生长速度快The branches are large and thick and grow faster2001.69a0.24a分支多而粗,生长速度快The branches are large and thick and grow faster

图3 不同浓度的MJ对木豆不定根染料木素和芹菜素含量的影响Fig.3 Effects of different contents of MJ on the content of genistein and apigenin
从表5可以看出,SA浓度的范围在0~200μmol·L-1时,木豆不定根的鲜重和干重在不添加SA的处理中均为最大值,分别为2.0和0.21 g。经过SA处理过的不定根的生物量有所下降并且通过不定根的生长状况可以看出,SA不仅抑制不定根的生长,而且影响生长状态,不定根出现末端膨大,生长缓慢的现象。
表5不同SA浓度对木豆不定根生物量的影响
Table5EffectsofdifferentcontentsofSAonthebiomassofadventitiousrootsofC.cajan(Linn.)Millsp.
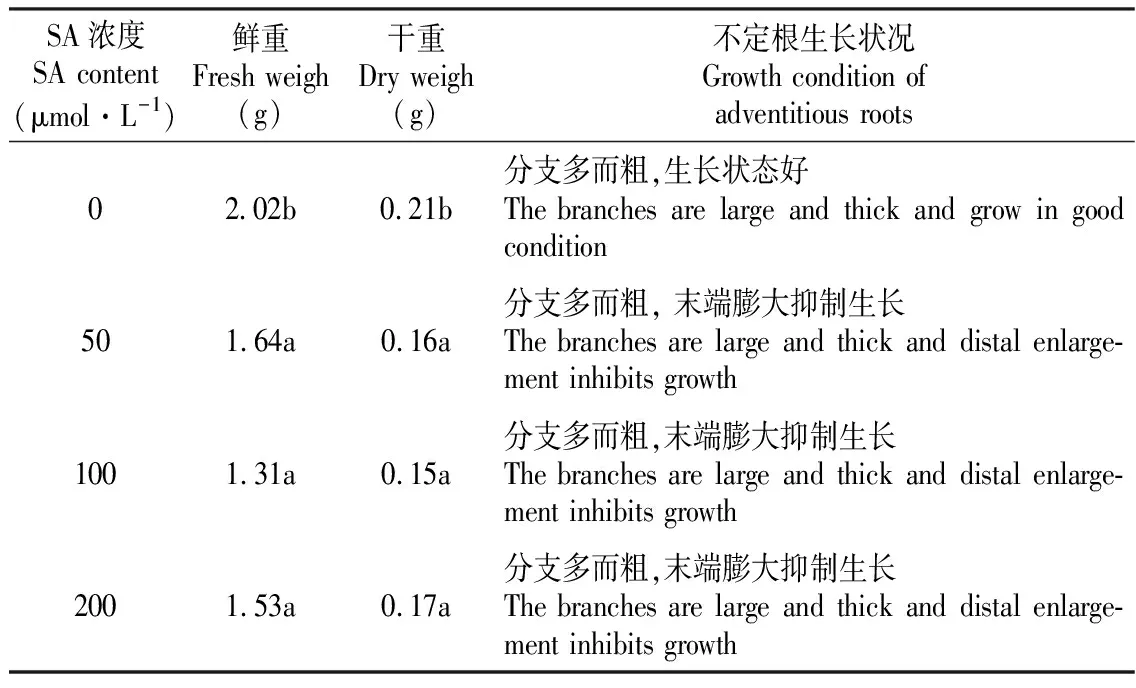
SA浓度SA content(μmol·L-1)鲜重Fresh weigh(g)干重Dry weigh(g) 不定根生长状况Growth condition of adventitious roots02.02b0.21b分支多而粗,生长状态好The branches are large and thick and grow in good condition501.64a0.16a分支多而粗, 末端膨大抑制生长The branches are large and thick and distal enlarge-ment inhibits growth1001.31a0.15a分支多而粗,末端膨大抑制生长The branches are large and thick and distal enlarge-ment inhibits growth2001.53a0.17a分支多而粗,末端膨大抑制生长The branches are large and thick and distal enlarge-ment inhibits growth

图4 不同浓度的SA对木豆不定根染料木素和芹菜素含量的影响Fig.4 Effects of different contents of SA on the content of genistein and apigenin
2.4.2不同浓度的SA对木豆不定根染料木素和芹菜素含量的影响
如图4,SA的浓度范围在0~200 μmol·L-1时,染料木素含量随着SA浓度的增加而降低,即未经SA处理的木豆不定根,染料木素的含量为最大值0.18 mg·g-1。芹菜素的含量在SA浓度为100 μmol·L-1时,其含量达到最大值0.03 mg·g-1,是未经SA处理的1.5倍,可见SA明显提高了木豆不定根中芹菜素的含量。
3 讨论
本研究以1/2MS为基本培养基,筛选出了最佳蔗糖浓度,并在此基础上分别研究了植物激素IBA、诱导子MJ及SA对木豆不定根生长和次级代谢产物染料木素、芹菜素合成的影响。
蔗糖作为植物组织培养中最常用的碳源,能支持绝大多数植物离体培养物的生长,一直被作为植物组织培养的标准碳源而广泛应用,蔗糖的用量不仅影响着培养物的生长速度和生长量,还影响其次生代谢产物的合成[18]。在低浓度蔗糖的培养基中,由于不定根得不到足够的碳源,生长缓慢。然而蔗糖浓度过高会引起渗透压过高从而导致细胞失水,使体细胞成熟,停止生长。郭肖红研究发现培养基以30 g·L-1蔗糖为碳源且培养20 d时,丹参不定根增殖倍数最高;蔗糖浓度为60 g·L-1时,最适合丹参酮IIA合成,蔗糖浓度对原儿茶醛合成的量没有显著的影响[19]。培养基中蔗糖浓度为50 g·L-1时可使黄芩不定根生物量达到对照组(30 g·L-1)的1.62倍,黄芩苷的含量达到对照组的1.71倍[20]。在本研究中发现,30 g·L-1蔗糖明显促进了木豆不定根生长和次生代谢产物合成,但当蔗糖浓度达到40 g·L-1时,对木豆不定根的生长和次生代谢产物的合成表现出明显地抑制作用。这说明蔗糖对不定根的生长和次生代谢产物合成的影响因物种的不同而产生差异,不同的物种应分别加以研究。
植物激素是培养基中重要的组成成分,不仅影响细胞生长,而且影响细胞次生代谢产物的合成。IBA是植物激素中天然合成的生长素,主要被用作诱导刺激细胞分裂和根的分化。IBA在根的诱导与生长上作用强烈,作用时间长,诱发的根多而长[21]。在人参的不定根研究中发现,IBA对不定根的生长和次生代谢产物的合成表现出明显地促进作用[22]。本研究结果表明,当IBA的浓度大于0.1 mg·L-1时,对木豆不定根的生长表现出明显抑制作用,而且高浓度的IBA对染料木素和芹菜素的合成也表现出明显抑制作用。0.1 mg·L-1的IBA对木豆不定根的生长和次生代谢产物的合成起到明显促进作用,可见IBA的浓度对木豆不定根的生长和次生代谢产物的合成具有重要影响。
MJ和SA均可作为植物防御反应的信号分子,诱导植物中与抗逆有关的多种次生代谢物的合成。MJ和SA是两种非常有效的诱导子,已在多种药用植物细胞培养中使用,且效果显著[23~24]。研究表明丹参毛状根培养18 d后,再用MJ处理9 d,丹参酮的含量为28.21 mg·L-1,是空白对照的4.9倍[25]。Shilpha等人研究表明,4 μmol·L-1MJ处理Solanum trilobatum毛状根2周后,总黄酮含量显著提高,达到(521.09 mg·g-1DW)[16]。朱葵荣等人研究发现一定范围内添加茉莉酸甲酯可以有效促进黄芩不定根中黄芩苷的合成,且随着茉莉酸甲酯浓度的增加,黄芩苷的含量逐渐提高。但是黄芩不定根的增长率随着茉莉酸甲酯浓度的不断增大持续降低,这表明茉莉酸甲酯对黄芩不定根的生长产生抑制作用,浓度越大,抑制作用越强。他们还研究发现低浓度水杨酸对黄芩不定根生长及黄芩苷合成均起到促进作用,当其浓度为4 mg·L-1时,不定根的生物量及黄芩苷含量均达到最大[20]。本实验结果表明,MJ浓度的范围在0~200 μmol·L-1时,对木豆不定根的生长几乎无影响,但当MJ的浓度大于100 μmol·L-1时,对次生代谢产物的合成表现出抑制作用。SA对木豆不定根生长表现出抑制作用,对芹菜素的合成表现出一定促进作用,但对染料木素的合成表现出抑制作用。可见诱导子处理刺激培养物合成次生代谢产物的效果受诱导子种类及浓度等因素的影响,对于不同的培养体系,应进行深入研究。
已有文献研究表明,不同外源调节物质的联合使用与单一调节物质使用相比,具有作用强、产量高,底物选择性强等特点[26]。崔北米在研究中发现植物激素ABA和乙烯利共同处理丹参毛状根能显著提高迷迭香酸的含量,且高于ABA单独处理效果[27]。徐立新等人研究表明诱导子MJ与SA对人参皂苷含量的增加具有明显的协同作用,当其浓度均为0.001 mmol·L-1时,对总皂苷和单体皂苷的积累比二者单独作用要大[28]。虽然外源调节物质(如植物激素、诱导子等)的联合使用在一定程度上提高了多种药用植物活性成分的产量,但是由于不同外源调节物质间相互作用太复杂,其诱导调控机制目前并不清晰[26]。关于多种影响因子对木豆不定根生长和次生代谢产物合成的影响,在今后的研究中要进行深入研究。
到目前为止,有关木豆不定根的研究尚未见报道。本研究结果表明木豆不定根的悬浮培养是获得次生代谢产物的一条有效途径,为大规模生产染料木素和芹菜素奠定了理论和实践基础。
1.于海娣,王慧梅,付玉杰.木豆毛状根的诱导及其培养条件的研究[J].植物研究,2012,32(4):481-483.
Yu H D,Wang H M,Fu Y J.Induction and culture condition of hairy roots ofCajanuscajan(L.) Millsp.[J].Bulletin of Botanical Research,2012,32(4):481-483.
2.李敏,曲丹,于海娣,等.木豆毛状根生长特性及相关生理生化指标研究[J].植物研究,2014,34(3):339-342.
Li M,Qu D,Yu H D,et al.Characteristics and biochemical indexes ofCajanuscajanhairy root[J].Bulletin of Botanical Research,2014,34(3):339-342.
3.Akand K E,Abubakar M M,Adegbola T A,et al.Chemical evaluation of the nutritive quality of pigeon pea[Cajanuscajan(L.) Millsp.][J].International Journal of Poultry Science,2010,9(1):63-65.
4.张谡.木豆根中染料木素和芹菜素提取纯化工艺及其抗氧化活性研究[D].哈尔滨:东北林业大学,2010.
Zhang S.Study on extraction and purification of genistein and apigenin from pigeonpea[Cajanuscajan(L.)Millps.] roots and their antioxidant activities[D].Harbin:Northeast Forestry University,2010.
5.Murthy H N,Dandin V S,Paek K Y.Tools for biotechnological production of useful phytochemicals from adventitious root cultures[J].Phytochemistry Reviews,2016,15(1):129-145.
6.Simonetti G,Tocci N,Valletta A,et al.In vitro antifungal activity of extracts obtained fromHypericumperforatumadventitious roots cultured in a mist bioreactor against planktonic cells and biofilm ofMalasseziafurfur[J].Natural Product Research,2016,30(5):544-550.
7.李慧娟,高日,廉美兰,等.IBA、NAA和蔗糖浓度对东北刺人参不定根增殖生长的影响[J].中国农学通报,2011,27(5):281-283.
Li H J,Gao R,Lian M L,et al.Effects of IBA,NAA and sucrose concentration on adventitious root growth ofOplpanaxelatusnakaiinvitro[J].Chinese Agricultural Science Bulletin,2011,27(5):281-283.
8.李美阳.轮叶党参不定根的诱导培养[J].安徽农业科学,2015,43(1):27-28,38.
Li M Y.Induction and culture of adventitious root ofCodonopsislanceolatabenth[J].Journal of Anhui Agricultural Sciences,2015,43(1):27-28,38.
9.李琰,崔蕾,杨钰琪,等.雷公藤不定根培养体系的建立及中试放大研究[J].中国中药杂志,2015,40(1):53-58.
Li Y,Cui L,Yang Y Q,et al.Establishment of adventitious root culture system and scale-up fermentation ofTripterygiumwilfordii[J].China Journal of Chinese Materia Medica,2015,40(1):53-58.
10.张坚,高文远,王娟,等.甘草不定根培养的研究[J].天津中医药,2011,28(1):75-77.
Zhang J,Gao W Y,Wang J,et al.Studies on culture of adventitious roots of liquorice[J].Tianjin Journal of Traditional Chinese Medicine,2011,28(1):75-77.
11.黄淑燕,郑郁善.蔗糖、碳粉对雷公藤不定根生长和次生代谢产物含量的影响[J].武夷学院学报,2016,35(9):25-28.
Huang S Y,Zheng Y S.An effect on the adventitious root growth and secondary metabolite content ofTripterygiumwilfordiifor the sucrose toner[J].Journal of Wuyi University,2016,35(9):25-28.
12.别振宇,李兴林,汪珊英.诱导子对蜀葵悬浮细胞、不定根培养的影响[J].天津科技大学学报,2017,32(3):23-28.
Bie Z Y,Li X L,Wang S Y.Effects of elicitors on uronic acid and the total flavonoid content inAlcearoseasuspension cells and adventitious root[J].Journal of Tianjin University of Science & Technology,2017,32(3):23-28.
13.尹双双,高文远,王娟,等.药用植物不定根培养的影响因素[J].中国中药杂志,2012,37(24):3691-3694.
Yin S S,Gao W Y,Wang J,et al.Influencing factors on culture of medicinal plants adventitious roots[J].China Journal of Chinese Materia Medica,2012,37(24):3691-3694.
14.吴春华,王淼,宋杭霖,等.无机盐和蔗糖浓度对白色紫锥菊不定根生长及次生代谢产物积累影响[J].天然产物研究与开发,2013,25(9):1167-1171.
Wu C H,Wang M,Song H L,et al.Medium salt strength and sucrose concentration affect root growth and secondary metabolite contents in adventitious root cultures ofEchinaceapallida[J].Natural Product Research and Development,2013,25(9):1167-1171.
15.Ahmad N,Fatima N,Ahmad I,et al.Effect of PGRs in adventitious root culture in vitro:present scenario and future prospects[J].Rendiconti Lincei,2015,26(3):307-321.
16.Shilpha J,Satish L,Kavikkuil M,et al.Methyl jasmonate elicits the solasodine production and anti-oxidant activity in hairy root cultures ofSolanumtrilobatumL.[J].Industrial Crops and Products,2015,71:54-64.
17.刘丽,李姿,马雪莲,等.外源水杨酸处理对活血丹中次生代谢产物积累的影响[J].南京农业大学学报,2016,39(3):379-385.
Liu L,Li Z,Ma X L,et al.Effect of salicylic acid on the accumulation of bioactive compounds inGlechomalongituba[J].Journal of Nanjing Agricultural University,2016,39(3):379-385.
18.丁世萍,严菊强,季道藩.糖类在植物组织培养中的效应[J].植物学通报,1998,15(6):42-46.
Ding S P,Yan J Q,Ji D F.Effect of sugar sources on plant tissue culture[J].Chinese Bulletin of Botany,1998,15(6):42-46.
19.郭肖红.丹参不定根组织培养的研究[D].天津:天津大学,2006.
Guo X H.Studies on the adventitious root culture ofSalviamiltiorrhizabge[D].Tianjin:Tianjin University,2006.
20.朱葵荣,马琳,冯杉.不同诱导子对黄芩不定根生长及黄芩苷累积的影响[J].中南药学,2014,12(11):1076-1079.
Zhu K R,Ma L,Feng S.Effect of elicitors on baicalin production and adventitious roots growth in suspension culture ofScutellariabaicalensis[J].Central South Pharmacy,2014,12(11):1076-1079.
21.周波,陈美楠,刘腾飞.激素在茶树组织培养中的作用研究进展[J].福建茶叶,2014,36(6):14-15.
Zhou B,Chen M N,Liu T F.The research progress of hormone in tea tree tissue culture[J].Tea in Fujian,2014,36(6):14-15.
22.Kim Y S,Hahn E J,Yeung E C,et al.Lateral root development and saponin accumulation as affected by IBA or NAA in adventitious root cultures ofPanaxginsengC.A.meyer[J].In Vitro Cellular & Developmental Biology-Plant,2003,39(2):245-249.
23.Wang Y D,Yuan Y J,Wu J C.Induction studies of methyl jasmonate and salicylic acid on taxane production in suspension cultures ofTaxuschinensisvar.mairei[J].Biochemical Engineering Journal,2004,19(3):259-265.
24.Kang S M,Jung H Y,Kang Y M,et al.Effects of methyl jasmonate and salicylic acid on the production of tropane alkaloids and the expression of PMT and H6H in adventitious root cultures ofScopoliaparviflora[J].Plant Science,2004,166(3):745-751.
25.Wang C H,Zheng L P,Tian H,et al.Synergistic effects of ultraviolet-B and methyl jasmonate on tanshinone biosynthesis inSalviamiltiorrhizahairy roots[J].Journal of Photochemistry and Photobiology B:Biology,2016,159:93-100.
26.叶龙飞,王金海,张景红.联合诱导子提高药用植物代谢产物产量的研究进展[J].广东化工,2014,41(10):207-208.
Ye L F,Wang J H,Zhang J H.The research development of the synergistic elicitors on the increase of production in the medical plants[J].Guangdong Chemical Industry,2014,41(10):207-208.
27.崔北米.ABA、GA3和乙烯利诱导丹参毛状根酚酸类物质的积累研究[D].咸阳:西北农林科技大学,2012.
Cui B M.Effects of ABA,Ethephon and GA3 on the accmulation of phenolic acids in the hairy roots ofSalviamiltiorrhizabunge[D].Xianyang:Northwest A&F University,2012.
28.徐立新,赵寿经,梁彦龙,等.外源调节物质对人参毛状根生长及皂苷合成的影响[J].吉林大学学报:工学版,2010,40(6):1619-1623.
Xu L X,Zhao S J,Liang Y L,et al.Effect of extrinsic regulators on growth and ginsenoside content of hairy roots ofPanaxginseng[J].Journal of Jilin University:Engineering and Technology Edition,2010,40(6):1619-1623.
