油松幼苗非结构性碳水化合物对干旱胁迫的阶段性响应
2018-06-23王宗琰王道涵
王宗琰 王 凯* 姜 涛 曹 鹏 孙 菊 王道涵
(1.辽宁工程技术大学环境科学与工程学院,阜新 123000; 2.辽宁省风沙地改良利用研究所,阜新 123000; 3.中国科学院沈阳应用生态研究所,沈阳 110016)
IPCC预测未来大部分干旱半干旱地区降雨将减少[1],由此引发的降水格局的变化导致干旱半干旱地区干旱现象越发严重[2]。因此,水分限制被认为是森林生产力下降的主要因素。非结构性碳水化合物(non-structure carbohydrate,NSC)是植物适应环境的一种信号物质[3~4],其含量及分配取决于碳吸收(光合同化)与碳消耗(呼吸及生长)的动态差值[5],影响着树木生长和对环境的适应策略[6]。NSC含量可以表征植物生长情况及对环境胁迫的抵御能力[7~8],而干旱胁迫是影响植物NSC含量变化的主要因素之一[9]。干旱对植物的影响往往是逐渐发生,植物各组织器官对干旱胁迫也会做出阶段性响应[5],然而由于树种、年龄及立地等方面的差异引起阶段性响应规律不同[4]。
油松(Pinustabulaeformis)是中国的特有种,从中国北部到中部分布广泛,是用材林、水土保持林和荒山绿化的主要造林树种[10]。以往关于油松对干旱胁迫的响应与适应性研究主要集中于生物量分配[11]、根系分布[12]、植物耗水规律及植物的伸长生长[13]、多酚与单宁含量[14]、光合特性[15]、可溶性蛋白[16]等方面;而对不同器官NSC的储存和分配的研究报道较少。基于此,本文通过盆栽控水试验研究不同干旱胁迫阶段油松幼苗各个器官NSC含量的响应规律,阐明油松幼苗对干旱胁迫的响应机制,为油松造林抚育管理提供理论依据。
1 材料与方法
1.1 试验材料与设计
研究区位于辽宁省风沙地利用改良研究所章古台试验基地(122°32′E,42°42′N)。该区在科尔沁沙地东南部,海拔高度345.1 m,年平均气温6.82℃;年均降水量450 mm,年均蒸发量1 590 mm,降水主要集中在6~8月。土壤主要为风沙土,植被以抗旱性较强的沙生植物为主,为防风固沙保护农牧业生产,该区营建了大面积防护林,主要有樟子松(Pinussylvestrisvar.mongolica)、油松、杨树(Populusspp.)、榆树(Ulmuspumila)等。
幼苗来源于章古台试验站苗圃,选择生长一致的2 a生幼苗,基径约0.55 cm、苗高15 cm左右。于2016年5月初将幼苗移植到盆中,每盆栽植1棵幼苗,盆高26 cm,上径25 cm,下径18.5 cm,每盆装干土7 kg。供试土壤为当地荒草地风沙土,土壤pH6.7,有机质7.79 g·kg-1,全N、P、K分别为0.31、0.11和87.19 g·kg-1,速效N、P、K分别为6.01、3.58和59.33 mg·kg-1。待幼苗正常存活生长后,于6月30日进行干旱胁迫处理。根据以往研究[17],设置4个水分梯度:即适宜水分(CK)及轻度(LS),中度(MS)和重度干旱胁迫(SS);分别为最大田间持水量(17.89%)的80%、60%、40%和20%,即土壤含水量为14.02%、10.51%、7.00%和3.50%。每个处理20盆幼苗,共计80盆。所有花盆放置在可移动遮雨棚下,晴天打开防雨棚,处于自然光照水平;雨天时遮上,防止自然降水影响。每天18:00对花盆称重,通过人工补水使各处理水分梯度达到要求。
干旱胁迫处理后的第15、30、45、60 d进行取样,共取样4次。每个处理每次取样4盆,即4个重复。取样时将幼苗完整地从花盆中取出,用清水冲洗干净,保鲜膜包裹后迅速带回实验室。将幼苗分成当年生叶、1年生叶、茎、粗根(直径>2 mm)和细根(直径<2 mm)5部分,分别装入牛皮纸袋中,在烘干箱中120℃杀青30 min后,80℃烘干至恒重。之后将样品研磨粉碎过0.25 mm的筛子储存用于NSC含量分析。NSC分为可溶性糖和淀粉,可溶性糖和淀粉含量采用苯酚—浓硫酸法[18]测定,两者之和即为总NSC含量。
1.2 数据处理
采用Microsoft Excel 2003和SPSS 13.0软件进行数据统计分析,运用3因素方差分析(three-way ANOVA)检验不同胁迫程度、胁迫时间、器官及其耦合效应对油松幼苗可溶性糖、淀粉和总NSC含量的影响。用单因素方差法(one-way ANOVA)分析不同胁迫程度、不同胁迫时间及不同器官间可溶性糖、淀粉和总NSC含量的差异,运用Duncan检验法进行多重比较(α=0.05)。
2 结果与分析
2.1 干旱胁迫对油松幼苗可溶性糖含量的影响
干旱胁迫程度与时间对油松幼苗当年生叶、1年生叶、茎、粗根和细根可溶性糖含量均具有显著的交互作用(P<0.01,表1)。由图1可知,当年生叶可溶性糖含量在胁迫15 d时,CK处理显著高于其他处理;胁迫30~45 d,随着胁迫程度增加可溶性糖含量呈下降趋势;胁迫60 d时,可溶性糖含量在SS处理显著高于其他处理。1年生叶可溶性糖含量在胁迫30 d时,MS和SS处理显著低于LS和CK处理;胁迫45~60 d时,随着胁迫程度增加呈可溶性糖含量增加趋势。茎可溶性糖含量在胁迫30 d时,不同处理间差异不显著;胁迫45 d时,可溶性糖含量在LS和MS处理显著高于CK处理;胁迫60 d时,随着胁迫程度增加可溶性糖含量呈增加趋势。粗根可溶性糖含量在胁迫0~30 d,不同处理间差异不显著(胁迫30 d时MS处理除外);胁迫60 d时,随着胁迫程度增加可溶性糖含量呈增加趋势。细根可溶性糖含量在胁迫15 d时,LS和SS处理显著高于CK处理;胁迫30~60 d时,可溶性糖含量在CK处理高于其他处理。
表1干旱胁迫程度、胁迫时间和器官对油松幼苗非结构性碳水化合物含量的3因素方差分析(F值)
Table1Three-wayANOVAeffectsondroughtstressandtimeonNSCcontentsofP.tabulaeformisseedlings(Fvalue)
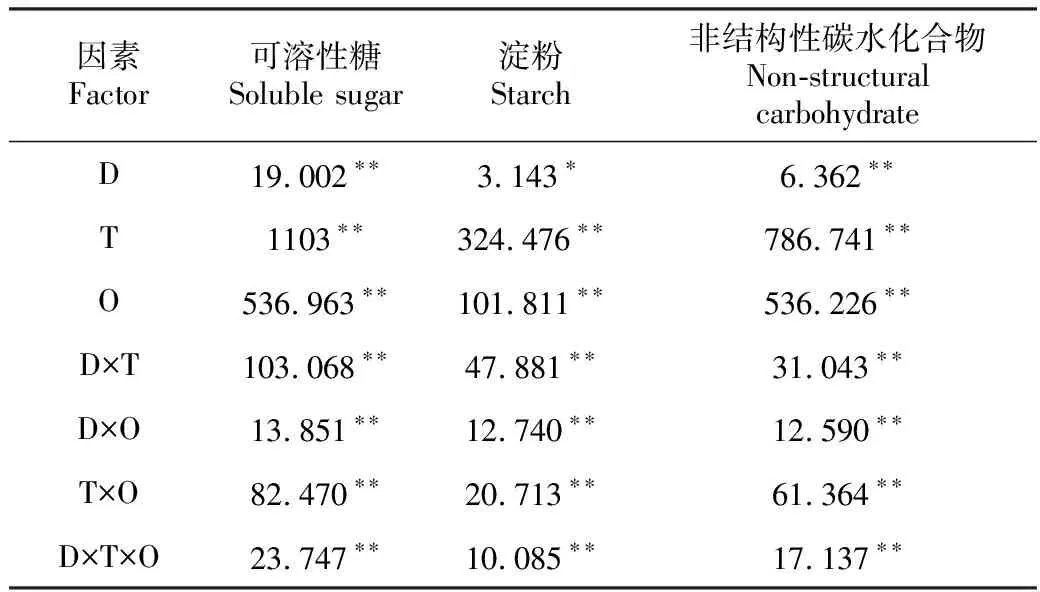
因素Factor可溶性糖Soluble sugar淀粉Starch非结构性碳水化合物Non-structural carbohydrateD19.002∗∗3.143∗6.362∗∗T1103∗∗324.476∗∗786.741∗∗O536.963∗∗101.811∗∗536.226∗∗D×T103.068∗∗47.881∗∗31.043∗∗D×O13.851∗∗12.740∗∗12.590∗∗T×O82.470∗∗20.713∗∗61.364∗∗D×T×O23.747∗∗10.085∗∗17.137∗∗
注:*P<0.05;**P<0.01;D.胁迫程度;T.胁迫时间;O.器官
Note:*P<0.05;**P<0.01;D.Drought stress degree; T.Tstress time; O.Organ.

图1 不同干旱胁迫处理下油松幼苗可溶性糖含量 CK.适宜水分;LS.轻度胁迫;MS.中度胁迫;SS.重度胁迫;A.当年生叶;B. 1年生叶;C.茎;D.粗根;E.细根 下同Fig.1 Soluble sugar contents of P.tabulaeformis seedlings in different drought treatments CK. Suitable water; LS. Light stress; MS. Moderate stress; SS. Serious stress; A. Current-year-old needles; B. One-year-old needles; C. Stems; D. Coarse roots; E. Fine roots The same as below.
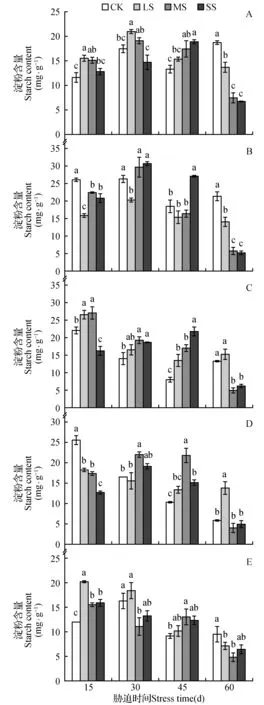
图2 不同干旱胁迫处理下油松幼苗淀粉含量Fig.2 Starch contents of P.tabulaeformis seedlings in different drought treatments

图3 不同干旱胁迫处理下油松幼苗NSC含量Fig.3 NSC contents of P.tabulaeformis seedlings in different drought treatments
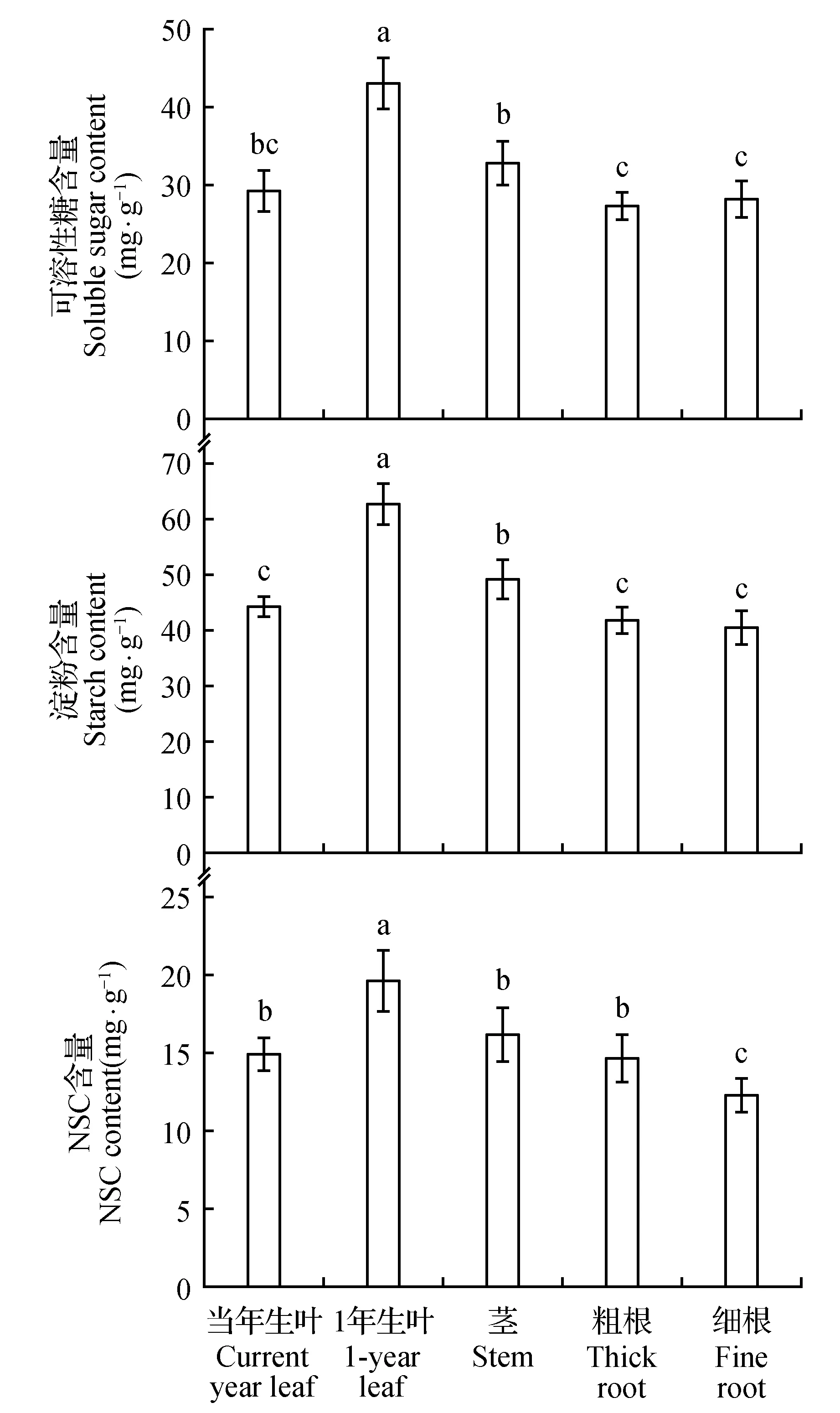
图4 油松幼苗不同器官中NSC含量Fig.4 NSC contents in different organs of P.tabulaeformis seedlings
2.2 干旱胁迫对油松幼苗淀粉含量的影响
干旱胁迫程度与胁迫时间对油松幼苗当年生叶、1年生叶、茎、粗根和细根淀粉含量均具有显著的交互作用(P<0.01,表1)。由图2可知,当年生叶淀粉含量在胁迫45 d时,随着胁迫程度增加呈增加趋势;胁迫60 d时,淀粉含量呈下降趋势。1年生叶淀粉含量在胁迫45 d时,SS处理显著高于其他处理;胁迫60 d时,随着胁迫程度增加,淀粉含量呈下降趋势。茎淀粉含量在胁迫30~45 d,随着胁迫程度增加呈增加趋势;胁迫60 d时,淀粉含量在MS和SS处理显著低于LS和CK处理。粗根淀粉含量在胁迫15 d时,随着胁迫程度增加呈下降趋势;胁迫45 d时,淀粉含量在MS和SS处理显著高于CK处理。细根淀粉含量在胁迫15 d时,CK处理显著低于其他处理;胁迫45 d时,随着胁迫程度增加,淀粉含量呈现增加趋势;胁迫60 d时,淀粉含量呈现下降趋势。
2.3 干旱胁迫对油松幼苗NSC含量的影响
干旱胁迫程度与时间对油松幼苗当年生叶、1年生叶、茎、粗根和细根NSC含量均具有显著的交互作用(P<0.01,表1)。由图3可知,当年生叶NSC含量在胁迫15 d时,CK处理显著高于其他处理;NSC含量在胁迫30~45 d,随着胁迫程度增加呈现下降趋势;胁迫60 d时,NSC含量在LS和MS处理显著低于SS和CK处理。1年生叶NSC含量在胁迫15 d时,随着胁迫程度增加呈现下降趋势;胁迫45 d时,NSC含量在SS处理显著高于其他处理;胁迫60 d时,NSC含量在MS和SS处理显著高于其他处理。茎NSC含量在胁迫15 d时,MS和SS处理显著低于LS和CK处理;胁迫45 d时,NSC含量在CK处理显著低于其他处理;胁迫60 d时,NSC含量在LS和SS处理显著高于CK处理。粗根NSC含量在胁迫15 d时,随着胁迫程度增加呈现下降趋势;NSC含量在胁迫60 d时,随着胁迫程度增加呈现增加趋势。细根NSC含量在胁迫15 d时,LS和SS处理显著高于CK处理;胁迫60 d时,NSC含量在CK处理显著高于其他处理。
2.4 油松幼苗NSC及其组分的分配规律
油松幼苗可溶性糖、淀粉和总NSC含量在不同器官中分布差异显著(P<0.01,表1)。由图4可知,可溶性糖含量在1年生叶中最高,茎显著高于粗根和细根,而当年生叶与茎、粗根和细根无明显差异;淀粉含量在不同器官中大小顺序为1年生叶>当年生叶、茎和粗根>细根;NSC含量大小顺序为1年生叶>茎>当年生叶、粗根和细根。整个胁迫处理期间,地上部分(当年生叶、1年生叶和茎)可溶性糖、淀粉和总NSC含量均高于地下部分(粗根和细根)。
3 讨论
干旱胁迫影响植物生长是一个复杂而漫长的生理过程[19],植物体在这个过程中经历了不同的胁迫阶段;各阶段的响应方式与适应策略不同,可分为应激响应、主动适应和被动适应[5]。胁迫初期植物体内维持水分稳定,调整源—库关系;到胁迫中期进行资源和能源储备,为复水后恢复做准备;再到胁迫末期对资源和能量合理利用及分配,以尽可能延长存活时间[5]。在这一生理过程中,植物通过调节NSC在不同器官中的组分及含量,以降低、缓解及适应干旱环境[20]。这种阶段性适应规律随着树种、年龄及立地条件的差异而不同[4]。张婷等[21]研究发现刺槐(Robiniapseudoacacia)在干旱胁迫34 d时,淀粉含量增加;胁迫70 d时,根NSC含量下降。杜尧等[22]研究发现兴安落叶松(Larixgmelinii)在干旱胁迫初期影响较小,而随着干旱时间延长,淀粉转化为可溶性糖,NSC总量不变。本研究发现2 a生油松幼苗在干旱胁迫15 d时,随着胁迫程度增加,当年生叶可溶性糖含量及1年生叶淀粉含量降低(图1~2),当年生叶、1年生叶、茎和粗根总NSC含量降低(图3),而细根可溶性糖(中度胁迫除外)和淀粉含量升高(图1~2)。这可能由于干旱胁迫导致幼苗光合能力下降,叶片中可溶性糖和淀粉的合成减少;幼苗将NSC向细根中运输,以促进其吸收水分,防止低水势发生而做出的应激响应[23]。这与刺槐的研究结果[20]相似,干旱胁迫导致其光合能力下降,将更多的同化物分配给地下器官以促进根系生长。
干旱胁迫45 d时,随着胁迫程度增加,油松幼苗当年生叶可溶性糖含量下降,淀粉含量呈升高趋势(图2),而总NSC含量呈下降趋势(图3);1年生叶在重度胁迫下可溶性糖、淀粉及总NSC含量明显升高(图2~3)。这说明干旱胁迫导致当年生叶合成可溶性糖能力下降,而1年生叶仍然继续可溶性糖的合成,表明逆境下1年生叶是合成可溶性糖的主要器官。同时干旱胁迫导致幼苗对于可溶性糖的利用减缓,造成了淀粉在各器官中累积(图2),这种累积表征了糖类向其他物质转化受阻[24]。总的来说,在胁迫45 d时,幼苗NSC主要以淀粉的累积为主。为了抵御长期干旱环境进行的能量储备,这是植物为将来环境适宜时能快速恢复组织器官形态建成的主动适应[8]。
干旱胁迫60 d时,油松幼苗当年生叶、1年生叶、茎和粗根可溶性糖含量会随着胁迫程度的增加而升高(图1),以提高细胞渗透调节能力;而细根可溶性糖和总NSC含量会随着胁迫程度的增加而降低(图1,图3)。油松幼苗在生长过程中NSC分配给地下部分明显小于地上部分(图4),这与周永学等[25]研究结果相似,油松幼苗在生长过程中以地上高生长为主,而根系生长细弱、生物量较低。然而,这与以往干旱胁迫导致根系增加生长的研究结果相反[11]。这可能由于一方面油松幼苗各器官会首先满足自身生长需要后才会继续运输NSC,NSC运输服从自上而下且就近的原则[26],致使有限的NSC无法供给到细根;另一方面可能运往细根中的NSC通道被阻塞,造成细根只能依靠调控自身储存的NSC应对干旱胁迫。此时干旱胁迫可能已经对幼苗细胞产生破坏作用,使其被迫做出被动适应,有限的NSC在幼苗体内被分配来调控各组织器官中的水分以尽可能的延长幼苗存活时间。
综上所述,油松幼苗在干旱胁迫初期(0~15 d),NSC向细根转移以促进水分吸收。胁迫中期(15~45 d),淀粉在幼苗各器官中累积以备环境适宜时供给形态建成所需。胁迫末期(45~60 d),NSC向根系运输受阻,引起根系NSC含量下降,导致根系生长及吸收功能受限,幼苗无法获得维持生命活动的水分,甚至造成幼苗干旱致死。建议油松幼苗在重度干旱胁迫下(土壤含水量3.50%)不要超过60 d。同时东北地区春季干旱往往造成林木生长衰退,植株死亡[27],建议油松造林时土壤含水量应高于3.50%。
致谢本文英文摘要经过中国科学院沈阳应用生态研究所宋立宁副研究员修改,在此表示感谢。
1.Church J,Clark P,Cazenave A,et al.Climate change 2013:The physical science basis.contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change[J].Computational Geometry,2013,18(2):95-123.
2.Dai A G.Increasing drought under global warming in observations and models[J].Nature Climate Change,2013,3(1):52-58.
3.Sheen J,Zhou L,Jang J C.Sugars as signaling molecules[J].Current Opinion in Plant Biology,1999,2(5):410-418.
4.Gibson S I.Plant sugar-response pathways.Part of a complex regulatory web[J].Plant Physiology,2000,124(4):1532-1539.
5.安玉艳,梁宗锁.植物应对干旱胁迫的阶段性策略[J].应用生态学报,2012,23(10):2907-2915.
An Y Y,Liang Z S.Staged strategy of plants in response to drought stress[J].Chinese Journal of Applied Ecology,2012,23(10):2907-2915.
6.Anderegg W R L,Anderegg L D L.Hydraulic and carbohydrate changes in experimental drought-induced mortality of saplings in two conifer species[J].Tree Physiology,2013,33(3):252-260.
7.Würth M K,Peláez-Riedl S,Wright S J,et al.Non-structural carbohydrate pools in a tropical forest[J].Oecologia,2005,143(1):11-24.
8.Myers J A,Kitajima K.Carbohydrate storage enhances seedling shade and stress tolerance in a neotropical forest[J].Journal of Ecology,2007,95(2):383-395.
9.刚群,闫巧玲,刘焕彬,等.种子更新与萌蘖更新蒙古栎一年生幼苗生长特性的比较[J].生态学杂志,2014,33(5):1183-1189.
Gang Q,Yan Q L,Liu H B,et al.Comparison of growth characteristics between 1-year-old seedlings ofQuercusmongolicathrough seed germination and sprout regeneration[J].Chinese Journal of Ecology,2014,33(5):1183-1189.
10.中科院中国植物志编辑委员会.中国植物志—第七卷:裸子植物门[M].北京:科学出版社,1978.
Chinese Academy of Sciences Editorial Board of Chinese Ethnography.Flora of China-volume 7:gymnospermae[M].Beijing:Science Press,1978.
11.Wang Q,Liu X M,Wang H T,et al.Effects of drought and waterlogging on growth and photosynthesis of potted youngPinustabulaeformisCarr.[J].Science of Soil and Water Conservation,2015,13(6):40-47.
12.王磊.干旱山区油松人工幼林根系分布特征与抗旱措施研究[D].太原:山西农业大学,2015.
Wang L.Research on root distribution and drought resistance of young Chinese pine forests in the dry mountain area[D].Taiyuan:Shanxi Agricultural University,2015.
13.黄华,梁宗锁,韩蕊莲,等.干旱胁迫条件下油松幼苗生长及抗旱性的研究[J].西北林学院学报,2004,19(2):1-4.
Huang H,Liang Z S,Han X L,et al.Growth and drought tolerance ofPinustabulaeformisunder water deficit[J].Journal of Northwest Forestry University,2004,19(2):1-4.
14.谢久祥,林恭华,都玉蓉,等.油松不同部位多酚与单宁的含量比较研究[J].植物研究,2012,32(2):243-247.
Xie J X,Lin G H,Du Y R,et al.Comparison of the contents of total polyphenols and tannins in different parts ofPinussinensis[J].Bulletin of Botanical Research,2012,32(2):243-247.
15.狄晓艳,池喜梅,陈建文,等.5个油松种源光合特性的比较研究[J].植物研究,2012,32(2):165-170.
Di X Y,Chi X M,Chen J W,et al.Comparison of photosynthesis characteristics in five provenances of Chinese pine(PinustabulaeformisCarr.)[J].Bulletin of Botanical Research,2012,32(2):165-170.
16.王琰,陈建文,狄晓艳.水分胁迫下不同油松种源SOD、POD、MDA及可溶性蛋白比较研究[J].生态环境学报,2011,20(10):1449-1453.
Wang Y,Chen J W,Di X Y.A comparative study on the SOD,POD,MDA and dissoluble protein of six provenances of Chinese pine(PinustabulaeformisCarr.) under water stress[J].Ecology and Environmental Sciences,2011,20(10):1449-1453.
17.马飞,姬明飞,陈立同,等.油松幼苗对干旱胁迫的生理生态响应[J].西北植物学报,2009,29(3):548-554.
Ma F,Ji M F,Chen L T,et al.Responses ofPinustabulaeformis seedlings to different soil water moistures in ecophysiological characteristics[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(3):548-554.
18.Buysse J,Merckx R.An improved colorimetric method to quantify sugar content of plant tissue[J].Journal of Experimental Botany,1993,44(267):1627-1629.
19.Lemoine R,La Camer S,Atanassova R,et al.Source-to-sink transport of sugar and regulation by environmental factors[J].Frontiers in Plant Science,2013,4:272.
20.王昕,孙永林,刘西平.土壤含水量对刺槐光合能力和碳水化合物分配的影响[J].西北林学院学报,2015,30(1):20-25,45.
Wang X,Sun Y L,Liu X P.Effects of soil water contents on leaf photosynthesis and carbohydrate partitioning inRobiniapseudoacacia[J].Journal of Northwest Forestry University,2015,30(1):20-25,45.
21.Zhang T,Cao Y,Chen Y M,et al.Non-structural carbohydrate dynamics inRobiniapseudoacaciasaplings under three levels of continuous drought stress[J].Trees,2015,29(6):1837-1849.
22.杜尧,韩轶,王传宽.干旱对兴安落叶松枝叶非结构性碳水化合物的影响[J].生态学报,2014,34(21):6090-6100.
Du Y,Han Y,Wang C K.The influence of drought on non-structural carbohydrates in the needles and twigs ofLarixgmelinii[J].Acta Ecologica Sinica,2014,34(21):6090-6100.
23.Verslues P E,Agarwal M,Katiyar-Agarwal S,et al.Methods and concepts in quantifying resistance to drought,salt and freezing,abiotic stresses that affect plant water status[J].The Plant Journal,2006,45(4):523-539.
24.郑云普,王贺新,娄鑫,等.木本植物非结构性碳水化合物变化及其影响因子研究进展[J].应用生态学报,2014,25(4):1188-1196.
Zheng Y P,Wang H X,Lou X,et al.Changes of non-structural carbohydrates and its impact factors in trees:a review[J].Chinese Journal of Applied Ecology,2014,25(4):1188-1196.
25.周永学,樊军锋,杨培华,等.奥地利黑松与油松1年生苗生长和生物量对比分析[J].浙江林学院学报,2003,20(4):438-441.
Zhou Y X,Fan J F,Yang P H,et al.Comparative studies on growth and biomass of one-year-old seedlings ofPinusnigravar.austriacaandPinustabuleaformis[J].Journal of Zhejiang Forestry College,2003,20(4):438-441.
26.Dietze M C,Sala A,Carbone M S,et al.Nonstructural carbon in woody plants[J].Annual Review of Plant Biology,2014,65:667-687.
27.王凯,赵成姣,邓杰,等.成年侧柏和刺槐对春季干旱的适应策略[J].生态学杂志,2017,36(11):3176-3181.
Wang K,Zhao C J,Deng J,et al.Adaptive strategies of adultPlatycladusorientalisandRobiniapseudoacaciato spring drought[J].Chinese Journal of Ecology,2017,36(11):3176-3181.
