仿生酶菌协同体系预处理木质素机理及特性
2021-11-03唐亮廖强夏奡黄云朱贤青朱恂
唐亮,廖强,夏奡,黄云,朱贤青,朱恂
(1 重庆大学低品位能源利用技术及系统教育部重点实验室,重庆 400044;2 重庆大学工程热物理研究所,重庆 400044)
化石能源的过量使用导致日趋过量的温室气体排放,严重影响全球气候。为此,我国已宣布将于2030 年前实现“碳达峰”,2060 年前实现“碳中和”[1]。我国是农业大国,生物质储量大,生物质可通过酶解糖化及发酵制备生物燃料,对实现“碳中和”目标具有重要意义。生物质中木质纤维素类废弃物年产量达9.8 亿吨[2],折合标准煤约为4.9 亿吨,相当于2020年我国能源消费总量的9.8%[3],因此,开发和利用木质纤维素类生物质资源尤为重要[4]。木质纤维素中纤维素含量为35%~50%(质量分数)[5-6],纤维素是由β-D-葡萄糖连接的高分子化合物[7],纤维素经过酶解糖化及发酵可转化为生物燃料[8],但木质素的致密结构和对酶的无效吸附限制了纤维素酶对纤维素的可及性,降低酶解效率[9-10],因此需要预处理打破木质素结构[11]。
生物质预处理技术主要包括机械破碎、蒸汽爆破、酸碱处理等方式,但通常存在能耗高、成本高等缺点,导致生物燃料商业化生产难以实现[12]。自然界中高等培菌白蚁降解木质纤维素类生物质效率高,在一些干旱的热带地区,高等培菌白蚁能降解90%以上植物残体[13-15],该过程由肠道的酶和蚁巢内真菌协同作用实现[16]。基于此,本研究提出利用漆酶和真菌分步降解木质素新体系。以蚁巢内提取的蚁巢伞菌和典型的木质纤维素降解菌黄孢原毛平革菌为研究对象,研究酶菌体系对木质素模型化合物碱木素的预处理效果,分析碱木素理化特性的改变,以及经酶菌体系处理后的碱木素对后续酶解的影响特性,为实现木质纤维素高效转化提供思路。
1 材料和方法
1.1 实验材料
本研究采用来源于云芝的漆酶(Laccase fromTrametes versicolor)、总滤纸酶活为70FPU/g 的混合纤维素酶(Cellic CTec2)、碱木素(Alkali lignin)来自于美国Sigma-Aldrich 试剂公司,蚁巢伞菌(Termitomycessp.)来自于德国微生物菌种保藏中心(DSMZ),黄孢原毛平革菌(Phanerochaete chrysosporium)来自于广东微生物菌种保藏中心。保种以冻干粉形式,置于4℃环境保存。将冻干粉加入无菌水摇匀,使用灭菌后的移液枪将稀释后的黄孢原毛平革菌冻干粉溶液接种到PDA培养基中,将稀释后蚁巢伞菌冻干粉溶液接种到麦芽提取物蛋白胨琼脂培养基。直至两个培养基表面长满白色丝状真菌,之后用无菌水洗刷培养基表面,并用接种环刮下表面的菌丝。待大部分菌丝脱落后,用移液枪吸取固体培养基表面的液体滴入漏斗中,滤纸过滤掉固体,收集液体于离心管中,完成真菌孢子液制备,以OD600表示菌液的浓度,初始浓度为OD600=0.13左右。
1.2 实验方法
1.2.1 漆酶对木质素降解实验
称取0.1g 漆酶和1g 碱木素,加入装有20mL、pH为4.8的柠檬酸钠缓冲液的锥形瓶中,在温度为25℃、转速为170r/min 摇床中反应24h[17]。随后离心、弃置上清液,用去离子水冲洗3次,将碱木素残渣放入烘箱烘干,过100目筛网备用。
1.2.2 真菌对木质素降解实验
将0.2g碱木素和经漆酶处理后的碱木素分别加入装有40mL降解培养基的250mL锥形瓶中[18],之后将真菌的孢子液100µL加入到锥形瓶中,用橡胶塞密封,在温度为28℃、转速为160r/min的摇床中反应15 天。降解培养基配置方法如下:精确称取2g葡萄糖、0.1g MgSO4·7H2O、0.1g CaCl2、0.4g酒石酸铵、0.5mL 吐温80、1g KH2PO4和0.57mL 藜芦醇于500mL去离子水中,充分溶解后,添加1mL微量元素溶液并定容至1L,放入高压灭菌锅在121℃灭菌20min。微量元素溶液配制如下:0.01g H3BO3、0.01g CuSO4·5H2O、 0.02g Al(K(SO4)2) ·12H2O、0.1g CoCl2·6H2O、0.1g FeSO4·7H2O、0.1g ZnSO4·7H2O和0.5g MnSO4充分溶解于1L去离子水中。
1.2.3 木质素对真菌生物量影响实验
将碱木素和经漆酶处理后的碱木素各0.1g分别加入装有20mL 降解培养基的锥形瓶中,之后加入200µL 的真菌孢子液,在温度为28℃、转速为160r/min 的摇床中培养,每种真菌各做14 个平行样。每隔一段时间取2个样,将锥形瓶中的菌液全部倒入烘干后的离心管(烘干后的离心管质量已测)中,之后用去离子水冲刷锥形瓶以保证锥形瓶内没有残留,再将冲刷后的去离子水倒入烘干后的离心管,将装有菌液的离心管用离心机在7500r/min条件下离心10min,倒掉上清液,放入温度为80℃的烘箱中烘干,测量离心管和固体的总质量,减去之前烘干后离心管的质量,即得生物量干重。
1.2.4 木质素降解酶活测定实验
使用灭菌的移液枪头移取降解过程中的上清液,用去离子水适当稀释摇匀后用离心机在7500r/min 条件下离心10min,离心后的上清液即为粗酶液。
漆酶的酶活测定方法:在1mL 待测的粗酶液中先后加入1mL 的0.1mol/L 乙酸钠缓冲液(pH=4.5)及1mL 的0.5mmol/L ABTS 溶液,混合后于25℃恒温培养箱中反应5min,用紫外光分光光度计测定420nm处反应前后的吸光度变化[19]。
木质素过氧化物酶的酶活测定方法:将1mL粗酶液加入1.9mL 0.24mmol/L藜芦醇溶液中,加入6mmol/L过氧化氢溶液启动反应,反应3min,用紫外光分光光度计测定310nm 处反应前后的吸光度变化[20]。
锰过氧化物酶的酶活测定方法:反应体系取为2.4mL 50mmol/L 乙酸钠缓冲液、0.1mL 1.6mmol/L硫酸锰溶液、0.1mL 1.6mmol/L 2,6-DMP 溶液和0.4mL 粗酶液,加入1.6mmol/L 过氧化氢溶液启动反应,反应3min,用紫外光分光光度计测定468nm处反应前后的吸光度变化[20]。
酶活单位(U)定义为在上述条件下,每分钟氧化1µmol ABTS、藜芦醇和2,6-DMP 所需要的酶量,计算公式如式(1)。
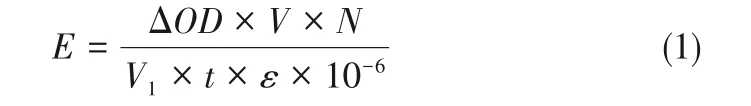
式(1)中,E为样品酶活,U/L;ΔOD为反应前后吸光度的变化值;V为反应总体积,mL;N为粗酶液稀释倍数;V1为粗酶液体积,mL;t为反应时间,min;ε为消光系数,L/(mol·cm),ε420=36000L/(mol·cm),ε310=9300L/(mol·cm),ε468=49600L/(mol·cm)。
1.2.5 木质素对微晶纤维素水解影响实验
使用Cellic CTec2 复合纤维素酶进行微晶纤维素的酶促糖化反应。糖化过程使用的酶量为30FPU/g。将装有20mL柠檬酸钠缓冲液(0.1mol/L,pH=4.8)的100mL 锥形瓶置于温度为50℃、转速为160r/min 的摇床中反应72h,碱木素的负载率为1%(质量分数),碱木素与微晶纤维素的质量比为2∶1。实验通过DNS法确定水解过程中还原糖的产量[21]。为了明晰酶菌处理后碱木素对酶的非生产吸附作用的影响[22],研究酶菌处理后碱木素上酶的吸附等温曲线,不同酶蛋白的浓度为0.1~2mg/mL[23]。将碱木素和酶装有10mL柠檬酸钠缓冲液(0.1mol/L,pH=4.8)的100mL 锥形瓶中于50℃(160r/min)反应3h 以达到平衡[24]。使用Bio-Rad 蛋白测定法(Bradford 的比色法)测定游离蛋白浓度,并将牛血清蛋白(Sigma-Aldrich)用作标准品[25]。碱木素对纤维素酶的吸附通过以下朗缪尔方程描述,如式(2)[23]。
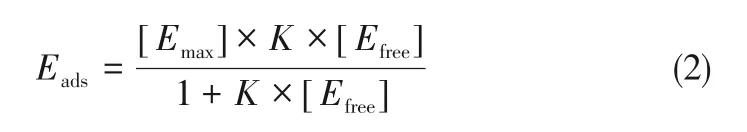
式中,Eads是木质素吸附的酶量,mg/g木质素;Efree是悬浮液中游离酶的浓度,mg/mL;Emax是木质素的最大酶吸附量,mg/g木质素;K为Langmuir吸附常数,mL/mg酶。
1.3 分析测试方法
将酶菌处理前后的碱木素放入60℃烘箱中干燥24h 后,使用配备有DTGS 检测器的Thermo Scientific Nicolet iN10 FTIR 显微镜(Thermo Nicolet Corporation) 进行FTIR 光谱分析,扫描在400~4000cm-1进行。将碱木素放在60℃烘箱中干燥24h后,然后涂上金-钯层,然后使用扫描电子显微镜(VEGA 3 LMH,捷克TESCAN)在电压为10kV 的条件下拍摄样品的显微照片。用压汞法对酶菌处理碱木素前后的孔径信息进行测试,实验通过Micromertics Instruments Corporation AutoPore IV 9500 进 行, 测 量 压 力 为33000psia (1psia=6.890kPa)。用德国布鲁克公司生产的Bruker AVANCE III 600M核磁共振仪测试酶菌预处理前后碱木素的二维碳氢核磁,将碱木素样品溶于二甲基亚砜-d6进行测试。
2 结果与讨论
2.1 酶菌预处理木质素特性
2.1.1 漆酶预处理前后的木质素对真菌干重的影响以漆酶预处理前后的碱木素为底物,黄孢原毛平革菌、蚁巢伞菌降解碱木素过程中真菌干重的变化规律如图1所示。以漆酶(La)处理后的碱木素为底物,两种真菌初期的生长速率均高于未处理的样品,这是由于经漆酶预处理后,碱木素被部分降解,表面形成突起,碱木素的比表面积增加,与菌的接触面积增大,有利于真菌初期的生长。以未处理的碱木素为底物的蚁巢伞菌生物量在第7天要高于以漆酶处理后的碱木素为底物的蚁巢伞菌生物量,原因在于两种真菌会分泌La、锰过氧化物酶(Mnp)和木质素过氧化物酶(LiP)来协同降解碱木素,有部分碱木素只能被漆酶所降解,La+Te体系前期漆酶的酶活要高于单一Te,造成以未处理碱木素为底物的蚁巢伞菌前期对这部分碱木素降解很少,随着单一Te 分泌的漆酶的酶活不断升高,在生长后期达到最高值,使得这部分碱木素被降解,进而生物量高于以漆酶处理后的碱木素为底物的蚁巢伞菌。以漆酶处理后的碱木素为底物的真菌衰亡速率明显降低,可能在于接触面积增大,菌更多的附着在碱木素上,菌丝会沿着孔隙生长,使得碱木素的紧密结构解聚,相比于未处理过的碱木素更易被菌利用,从而降低了真菌的衰亡速率。而未经漆酶处理的碱木素大孔径少,导致了真菌较难利用碱木素碳源,同时后期营养物质消耗殆尽,造成真菌大量死亡,真菌残体溶解于溶液中,导致衰亡期生物量显著下降。
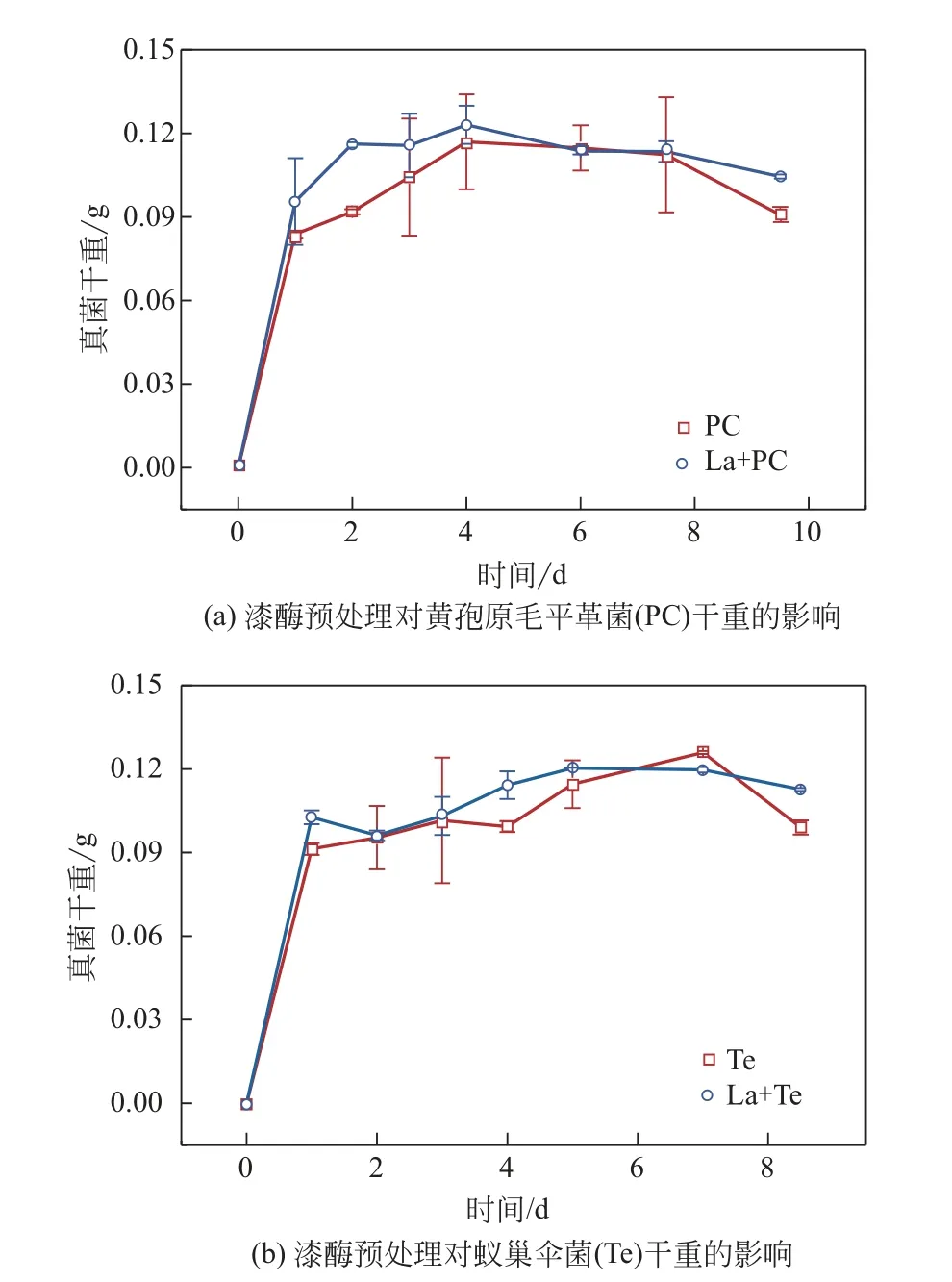
图1 漆酶预处理对真菌干重的影响
2.1.2 漆酶预处理对降解过程中木质素浓度的影响
图2为真菌降解碱木素过程中碱木素浓度变化的趋势。在第一天,La+PC体系的碱木素降解速率最快,24h内碱木素浓度下降了7.6%,这主要是因为锰过氧化物酶会产生Mn3+,通过脂质过氧化反应分解木质素的酚类和非酚类单元,将碱木素结构破坏,进而将其降解为小分子化合物[26]。四组实验碱木素的浓度变化基本不大,原因是前期分泌的漆酶作用有限,只能作用于碱木素酚类单体,能够将酚羟基氧化成活性基团苯羟自由基,从而使芳香基裂解。但是,酚类单体仅仅占木质素总结构单元的10%~15%[27],并且漆酶除了能够催化解聚木质素,亦可导致木质素聚合,所以对木质素的去除效果有限[28]。从第7 天开始,由于锰过氧化物酶和木质素过氧化物酶的酶活升高,碱木素的降解速率变快。直到实验结束时,单一Te对碱木素的降解率最大,为25.3%,而这一过程中锰过氧化物酶的活性是四组实验中最高的,最低的为La+Te 体系,为12.7%,同时La+Te 体系中锰过氧化物酶活性是最低的,锰过氧化物酶由于其对酚类和非酚类单元的降解作用,与漆酶和木质素过氧化物酶相比对碱木素的降解效果更好,从而在碱木素降解过程中占主导作用。
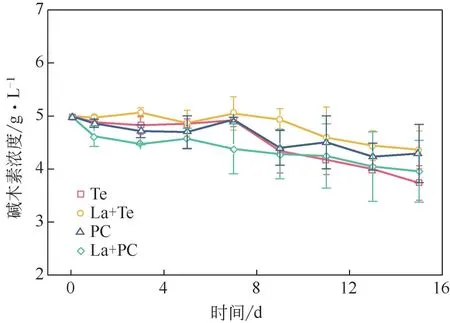
图2 漆酶预处理对降解过程中木质素浓度的影响
2.1.3 漆酶预处理对真菌木质素降解酶活性的影响图3反映的是La的活性,可知以漆酶处理后的碱木素为底物的两种真菌漆酶的酶活都比以未处理的碱木素高,其中La+Te 体系La 活性最高,是单一Te最高漆酶活性的1.43倍,并且在第5天就达到最高值,之后略微下降,到第13 天酶活仍保持6.3U/L。而单一Te 的La 活性虽一直上升,直到第13 天达到最高,但在时间上酶活的最高点具有滞后性,并且La 处理后的碱木素较未处理的碱木素对蚁巢伞菌分泌的La 活性有明显的提升效果。对于PC,以漆酶处理后的碱木素为底物对其分泌的La 活性也有提升作用,但改善效果没有Te 那么明显,并且对活性变化趋势没有影响。

图3 漆酶预处理对漆酶活性的影响
碱木素降解过程中MnP 的活性变化如图4 所示。单一Te 的MnP 活性要比La+Te 体系的酶活高21.0%,原因在于La与MnP对碱木素的降解效果相似,都能降解酚类单元,并且La 氧化过程不需要H2O2和Mn2+的参与,但MnP 降解碱木素需要H2O2和Mn2+参与[29],因此MnP降解碱木素需要消耗真菌更多能量,真菌在La 活性过高时可能会减少MnP分泌来减少能量消耗。La+PC体系在前3天MnP酶活增长最快,碱木素降解率在前3天也最高,表明锰过氧化物酶对碱木素的降解至关重要。La+PC体系的MnP 活性比单一PC 提升了31.6%,表明经La处理后的碱木素更利于被MnP所降解。
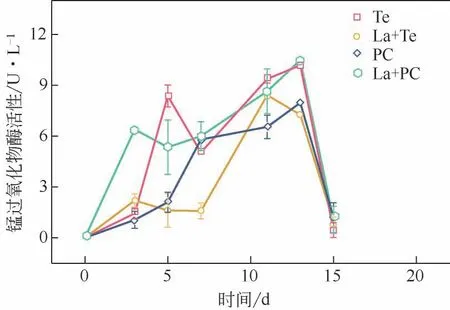
图4 漆酶预处理对锰过氧化物酶活性的影响
真菌降解碱木素过程中LiP 活性变化如图5 所示。实验进行5 天后,PC 分泌的LiP 活性高于Te,表明PC 降解非酚类单元的能力强于Te。同时因为La 预处理,PC 分泌LiP 活性出现最高峰的时间比单一PC 的最高峰提前2 天。La+Te 体系的LiP 活性的最大值高于单一Te 最大值,并且在第13 天时,单一Te 分泌的LiP 的活性已经开始下降,而La+Te体系的LiP活性达到最高值,表明漆酶的预处理提高了Te分泌的LiP活性。值得注意的是,两种真菌的LiP活性的最大值都出现在降解过程后期,表明这两种真菌降解碱木素非酚类单元主要是在后期完成的。
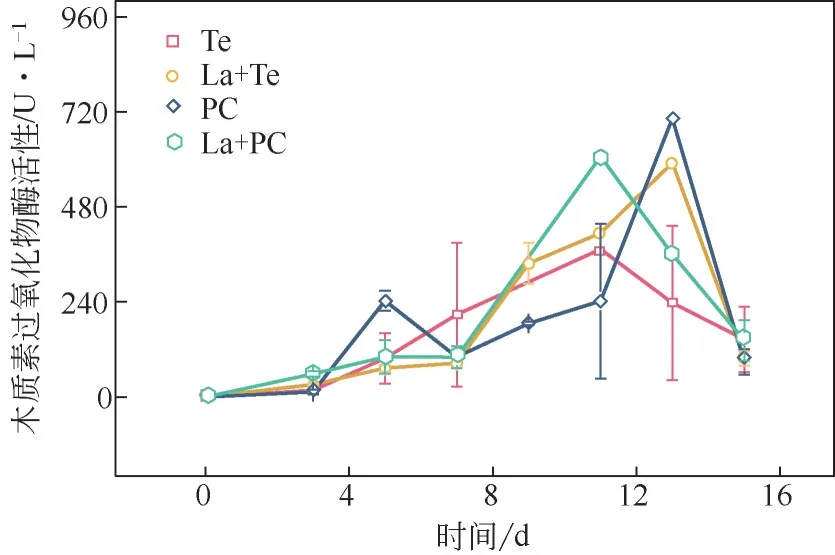
图5 漆酶预处理对木质素过氧化物酶活性的影响
2.2 酶菌预处理对木质素物化结构的影响
2.2.1 傅里叶转换红外光谱分析
酶菌处理碱木素前后的FTIR 如图6 所示,谱带分布如表1 所示。La、Te、La+Te 体系以及La+PC 体系处理后的碱木素在指纹区域(1300~1000cm-1)发生了显著的变化,但PC 处理后的碱木素变化不大,仅在1125cm-1[30]处吸收峰强度显著下降,该吸收峰代表紫丁香基木素C—H 面内变形,PC 降解碱木素过程中木质素三大基本单元之一紫丁香基木素减少,PC 处理后的碱木素羟基吸收峰(3222cm-1),CH2、CH3、CH3O 基团的C—H 拉伸振动的吸收峰(2935cm-1)[31],苯酚的C—O 拉伸振动的吸收峰(1213cm-1)略微升高,醇类(1081cm-1)[32]吸收峰下降,表明醇类被破坏,新的酚羟基生成,造成羟基吸收峰升高,新的甲基、亚甲基、甲氧基生成,木质素发生解聚。由此可见,PC 对碱木素作用有限,主要降解紫丁香基木素,断裂与苯环连接的醚键生成酚羟基和降解醇类。但La+PC 体系处理后的碱木素在4000~1000cm-1范围内的吸收峰较未处理的碱木素样品的吸收峰有显著的降低,表明La预处理对PC 降解碱木素效果有显著的提升。同时将La+PC 体系处理后的碱木素与只经La 处理过的碱木素相比较,La+PC 体系处理后的碱木素在指纹区域吸收峰强度比La 处理过的碱木素低,但在吸收峰为3222cm-1的位置却是前者比后者高,这个位置是羟基吸收峰,进一步表明PC 对酚类单元的降解能力较弱,而La 可以降解酚类单元,提升PC 对碱木素的降解效果。单一Te、La+Te 体系处理后的碱木素在4000~1000cm-1范围内的吸收峰是最低的两组。这两组的吸收峰差别不大,吸收峰的值几乎重合,但其中La+Te 体系处理后的碱木素在波数为3222cm-1、2935cm-1处比经单一Te 处理的略低,表明酚类单元减少,碱木素化学键被破坏。
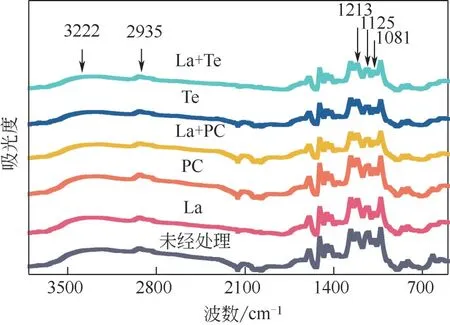
图6 酶菌预处理碱木素的FTIR光谱

表1 碱木素FTIR谱带分布
2.2.2 扫描电镜分析
扫描电镜结果显示(图7),未处理的碱木素样品表面平整棱角分明且没有孔隙。经La处理后,表面趋于光滑,且表面形成许多小的突起,增加了后续菌处理的表面积。经Te 处理后,样品表面变得光滑,有裂缝生成。La+Te 体系处理后的碱木素,表面更加光滑,凹凸不平,有微米级孔形成。PC 处理后的碱木素表面粗糙,有不规则的、大小不一孔隙形成,La+PC体系处理后的碱木素表面粗糙,凹凸不平,表面结构破坏严重,形成大量3µm以下大小的碱木素颗粒。

图7 碱木素的SEM图像
2.2.3 孔径分析
酶菌处理后的碱木素的孔径分布如表2 所示,未经处理的碱木素样品平均孔径最小,仅有841.41nm,而平均孔径最大的是La+PC处理后的碱木素,是未经处理碱木素样品的2.13倍,是单一PC处理后碱木素的1.81倍,是La处理后碱木素的1.44倍。La+Te体系处理后碱木素样品的平均孔径较单一酶和单一菌都有显著的扩大,说明漆酶对真菌扩大碱木素孔径有促进作用。但总孔容却是未经处理的碱木素样品最大,其原因可能是酶菌处理时碱木素发生了解聚,结构稳定性变差,出现了小孔坍塌,造成处理后的总孔容较未处理的碱木素样品小。经漆酶和真菌分步处理后碱木素的总孔容要大于单一真菌处理后碱木素的总孔容,说明酶菌协同体系处理较单一真菌处理对碱木素结构的破坏作用更大。
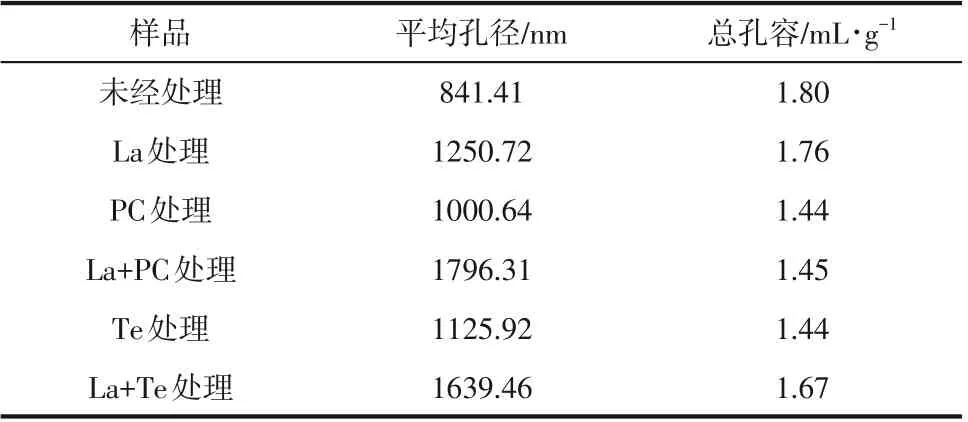
表2 酶菌预处理碱木素的孔径信息
2.2.4 二维碳氢核磁谱图分析
酶菌预处理前后的碱木素二维碳氢核磁谱图如图8 所示,13C—1H 相关信号分布表如表3 所示。由图可知,经漆酶、单一PC 和La+PC 体系预处理后的碱木素样品在苯环上和侧链区的的碳氢化学键的峰强度相较于未处理的碱木素样品均有所下降,其中漆酶预处理后的苯环上和侧链区的碳氢化学键峰强度低于单一PC,表明漆酶对碱木素的化学键破坏效果要强于单一PC,与FTIR 结果相吻合。La+PC 体系预处理后的碱木素树脂醇结构中β—β 键的Cβ—Hβ峰强度没有检测到,表明碱木素中大量的β—β 键发生了断裂,β—β 键一般也由紫丁香基木素所组成,进一步说明La+PC体系可以破坏紫丁香基木素。在苯环区域,对羟基苯基木素上的C2—H2和C6—H6键的峰强度也未检测到,表明在漆酶强化了PC 对对羟基苯基木素的破坏。
2.3 酶菌预处理对木质素吸附纤维素酶与酶解特性的影响
2.3.1 酶菌预处理对木质素的纤维素酶吸附特性的影响
图8是碱木素对纤维素酶的吸附曲线。随着游离酶浓度的增加,吸附量趋于饱和。随着纤维素酶的浓度升高,未处理碱木素样品和经单一La 处理的碱木素样品对酶的吸附量自低浓度(0.2mg/mL)就开始趋于饱和,而经菌和酶菌分步预处理的碱木素样品对酶的吸附量达到饱和状态时所对应的纤维素酶量浓度大约为1mg/mL,表明真菌预处理对减少碱木素对酶的吸附所起的作用比漆酶的作用要大,真菌预处理可以显著减少碱木素对纤维素酶的吸附。
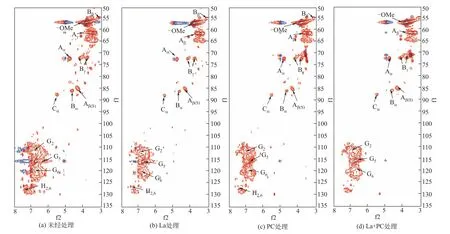
图8 酶菌预处理前后碱木素的二维碳氢核磁谱图
表3是碱木素对纤维素酶吸附曲线的参数。由表可知,未处理的碱木素样品最大酶吸附量最高,La 处理后碱木素最大酶吸附量较未处理的碱木素样品下降了15.9%,经真菌处理后的碱木素样品的最大吸附量较未处理的碱木素样品显著下降,其中La+Te 体系处理后的碱木素的最大酶吸附量最少,为9.94mg/g,比未经处理的碱木素样品的最大酶吸附量降低了51.5%。PC处理后的碱木素对纤维素酶的吸附强于Te处理,原因在于PC处理后的碱木素酚羟基数量比Te处理的多[33]。
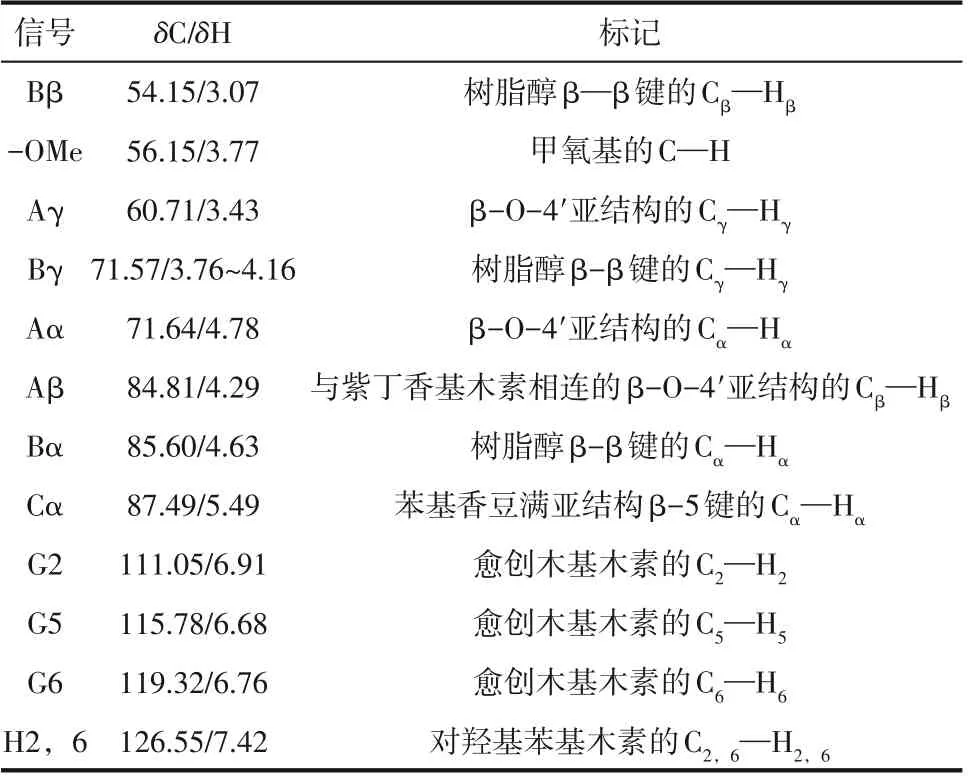
表3 13C—1H相关信号分布表
2.3.2 酶菌预处理木质素对纤维素酶酶解特性的影响
酶菌预处理碱木素前后,碱木素对微晶纤维素的酶促水解实验结果如图9所示。经酶菌处理后的碱木素对纤维素酶的非生产吸附减少,使得溶液中酶活跟对照组比起来更高,水解微晶纤维素所得到的还原糖增多。其中,从图10 及Langmuir 吸附等温曲线(表4)可知,La+Te 体系处理后的碱木素对纤维素酶的非生产吸附最少,使得游离的酶浓度更高,水解微晶纤维素所产生的还原糖浓度最高,在72h后浓度为3.11g/L,剩下的实验组还原糖浓度从高到低依次为:2.63g/L(单一Te处理)、2.58g/L(La+PC 体系处理)、2.08g/L(单一PC 处理)以及1.81g/L(未经处理的碱木素样品),La+Te 体系降解后的碱木素较未经处理的碱木素样品的还原糖浓度提升了71.5%。

图9 酶菌预处理碱木素对纤维素酶吸附特性的影响
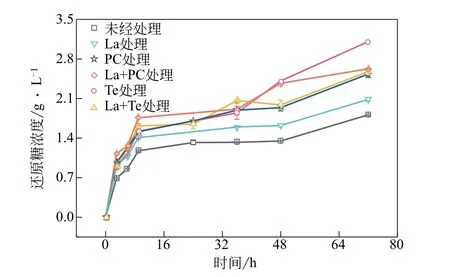
图10 酶菌预处理碱木素对纤维素酶酶解特性的影响
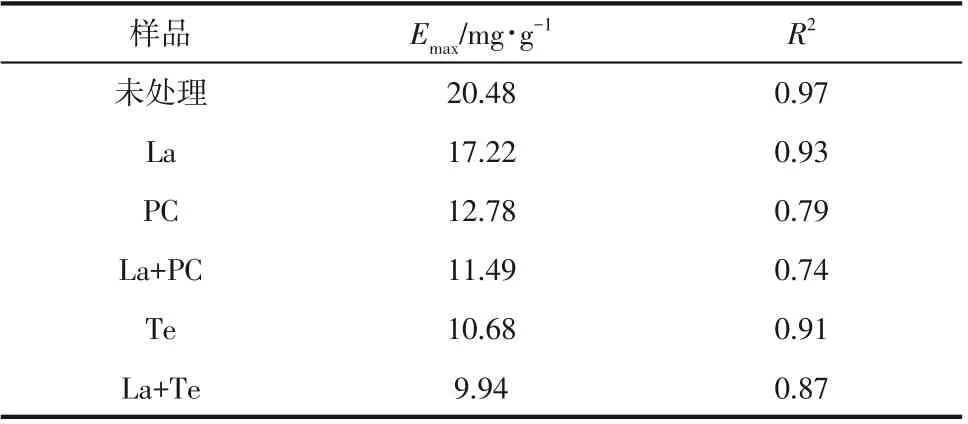
表4 Langmuir吸附等温线参数
3 结论
(1)受高等培菌白蚁降解生物质的酶菌体系启发,构建酶菌降解碱木素的新体系。漆酶预处理后的碱木素对真菌生长代谢的影响研究表明,经漆酶预处理后的碱木素提升了真菌生长初期的生长速率,使真菌提前进入静止期,并且减缓了真菌的衰亡速率。同时漆酶预处理后的碱木素也改变了真菌木质素降解酶系的活性,使Te 分泌的漆酶和LiP 活性分别显著提升43.3%和58.5%,将PC 分泌的漆酶和MnP 活性分别提升35.9% 和31.6%。
(2)通过测试酶菌预处理过程中碱木素降解率的变化以及对酶菌预处理后碱木素物化性质的表征,发现La+PC 体系对碱木素的降解率较单一PC提升6.7%。FTIR 分析结果表明,经酶菌协同体系预处理后的碱木素在指纹区域官能团吸收峰显著减少,其中La+Te体系处理后的碱木素各官能团吸收峰最低,但与单一Te 官能团吸收峰相差不大,表明漆酶对Te 在碱木素官能团改性作用方面的提升有限。但漆酶的预处理使PC 对碱木素官能团的改性效果显著提升。SEM 和孔径分析表明,酶菌协同体系预处理后的碱木素表面结构破坏严重,表面孔隙增多,碱木素平均孔径显著增大。
(3)通过酶菌协同作用的方式强化碱木素的降解,同时削弱碱木素对后续酶吸附的影响。其中La+Te体系处理后的碱木素对纤维素酶的最大吸附量较对照组降低了51.5%,对酶的非生产性吸附量最少,从而使还原糖的产量较对照组提高了71.5%。
