微生物集群效应的固定化酵母生产燃料乙醇
2018-06-12刘庆国孙振江李永恒许旺发
罗 虎,刘庆国,陈 勇,孙振江,李永恒,许旺发
(1.广西中粮生物质能源有限公司,广西 北海 536100;2.南京高新工大生物技术研究院有限公司,江苏 南京 210032)
由于石油资源和其他化石能源的过度开采,能源危机已成为世界性的问题,寻找清洁可再生能源是当今最为迫切的任务[1]。生物乙醇是通过生物质(如糖蜜、玉米或秸秆纤维素等)进行生物厌氧发酵制得,具有无污染、可再生性等优点[2];而且它能与汽油以任意比例混合,可有效替代部分石油资源,从而降低对石油需求的压力。在我国燃料乙醇工业生产中,二代纤维乙醇受高成本的预处理技术影响,限制了大规模生产,木薯和玉米依然是乙醇发酵的两大主要发酵原料[3]。
目前,国内主流的乙醇发酵工艺几乎都是大接种量的游离发酵工艺,该工艺存在发酵周期长、淀粉利用率不高等问题。相对于传统游离发酵过程中的不足,固定化酵母因其具备明显的优势,在燃料乙醇发酵生产上得到了越来越广泛的关注和应用。固定化酵母发酵具有底物耐受性强、发酵周期短以及对原料转化率高等优点[4]。传统的固定化方法主要采用凝胶包埋技术,如卡拉胶、海藻酸钙、自絮凝技术以及近年来流行的新型吸附介质秸秆渣等[5]。艾特玲[6]采用脱木素锯末和海藻酸钠固定化酵母细胞,同时考察固定化酵母细胞产乙醇的效果;发酵的结果表明:最优预处理条件下的稻草进行发酵生产乙醇,接种固定化酵母细胞发酵96 h后,乙醇得率为0.370 g/g。郭艺山等[7]以多孔钢渣、硅藻土和珍珠岩等材料为细胞宿主载体,采用空化制泡工艺制备成多孔质固化载体,并应用于糖蜜酒精发酵中,结果表明,该载体具有良好的力学强度和优良的发酵特性,发酵酒度达11%(体积分数) 。目前研究的这些载体虽具有成型方便及固定化密度高等优点,但存在固定化成本高、溶液传质效果差及对物料要求较高(如,不溶性固含物浓度要足够低)等缺陷,从而限制了在工业上的应用。
针对目前固定化发酵过程中的不足,笔者提出了基于微生物集群效应的生物膜催化体系,利用化学修饰的方法以实现介质表面与微生物细胞表面功能基团的对接,在此介质诱导下,酵母能快速富集并产生大量的生物膜,从而使得酵母乙醇耐受性明显提高。此吸附介质具有成本低、吸附能力高效及力学强度高等优点。本文中,笔者首先进行1 t级试验的工艺条件优化(影响固定化发酵的主要因素);其次,对比游离和固定化工艺的发酵效果,研究不同淀粉质原料和不同初始糖含量对发酵的影响,并分析固定化发酵工艺的可行性,以期达到开发新的燃料乙醇生产工艺的目的。
1 材料和方法
1.1 菌株
酿酒酵母1308,由河南南阳天冠集团提供。
1.2 培养基及种子培养
种子培养基(g/L):葡萄糖30、酵母膏10、蛋白胨20、无水MgSO40.5、(NH4)2SO44、KH2PO41.5。
发酵培养基:木薯与料按一定比例混合拌匀,配好后,调pH至5.5~6.0;然后按14 U/g的量加入液化酶(奥谷液化酶单位:30 000 U/mL);86 ℃搅拌水解2 h,降温至34 ℃保温。
种子培养及扩大培养:菌株经麦芽汁(140 g/L)斜面30 ℃活化2 d后,进行摇瓶种子培养(32 ℃、150 r/min),再经过100 L种子罐和1 t种子罐扩培,32 ℃通入无菌空气(流量4 m3/h)培养10~16 h。
细胞固定:纤维材料先后置于质量浓度为10 g/L的丁二酰亚胺水溶液和5 g/L的丙二醛水溶液中,分别常温浸泡2 h,再将纤维材料置于去离子水中充分漂洗后烘干,并填装于1 t发酵罐中;然后将发酵罐121 ℃灭菌20 min;再将培养好的种子压入发酵罐,打开循环泵(流量1.5 m3/h),循环若干时间至吸附量达到一定值后停止固定,排出废液。
发酵产酒精:将液化好的木薯液化醪压入发酵罐,加入0.2 g/L的尿素和MgSO4及200 U/g的糖化酶(神舟糖化酶,单位为10万U/mL),循环量为1 m3/h,特定条件下发酵48 h。发酵结束后,排出的发酵醪称质量。
30 t罐发酵工艺流程与1 t发酵罐的发酵方法类似。
1.3 分析方法
1.3.1 还原糖、总糖及淀粉率的测定
还原糖测定采用斐林试剂滴定法:准确称取被测醪液10.0 g,定容至250 mL,混合摇匀,再用洁净的移液管准确吸取5.00 mL试样,放入装有混合均匀的斐林甲、乙液各5 mL的三角瓶中,再加入蒸馏水25 mL,混匀后用0.25%葡萄糖进行滴定,计算见式(1)。
(1)
式中:A为空白滴定消耗0.25%葡萄糖标准溶液体积的数值(mL);B为滴定试样消耗0.25%葡萄糖标准溶液体积的数值(mL)。
总糖测定方法:先量取充分混匀的发酵液50 mL,注入250 mL三角瓶中,加水40 mL和20%的盐酸10 mL,置沸水浴中转化1 h,用200 g/L NaOH溶液中和至微酸性,过滤到250 mL容量瓶内,定容至刻度,摇匀;然后参照还原糖的方法进行测定。
淀粉测定方法:准确称取原料3 g,加水90 mL和20%的盐酸10 mL加热酸解,然后参照总糖的测定方法。
1.3.2 酒精度、酸度、细胞数、出芽率及死亡率的测定
酒精度测定:称取发酵醪100 g蒸酒至100 mL,然后用酒精度计测量酒度。
酸度测定:于150 mL三角瓶中注入20 mL蒸馏水,加2滴酚酞,用0.1 mol/L NaOH滴定至微红色,再吸取1 mL滤液,继续用NaOH滴定至再次出现粉红色,在30 s内不褪色为终点,第2次NaOH滴定的毫升数乘以10为酸度。
细胞数、出芽率及死亡率测定:取2.5 mL发酵醪,稀释至100 mL,滴加1 mL次甲基蓝,摇匀,静置1 min后用血球计数板计数。
1.3.3 扫描电镜观察细胞形态
酵母固定化载体先进行真空冷冻干燥,然后利用扫描电镜(model JSM-6010型,日本JEOL 公司)观察细胞形态。
1.3.4 淀粉利用率和粮耗
淀粉利用率及生产1 t乙醇所需的粮耗计算分别见式(2)~(3)。
淀粉利用率 =(总出料量×酒精度×0.01×0.789)/(木薯质量×淀粉含量×0.567 9)×100%
(2)
标准粮耗 =(木薯质量×淀粉含量)/(总出料量×酒精度×0.789×0.01×0.7)
(3)
2 结果与讨论
2.1 小试发酵工艺优化
2.1.1 发酵温度对发酵的影响
温度是燃料乙醇发酵过程中重要的工艺参数,对酵母细胞活性和糖化酶活力均有较强的影响[8]。如果温度过低,酵母酶活性低,发酵能力较弱,初始糖化酶酶解速率较低,最终表现为总糖消耗不彻底,残留总糖浓度较高,从而影响淀粉利用率。为了优化固定化发酵工艺条件,在1 t发酵罐中,首先考察温度对固定化酵母发酵的影响,结果见表1。
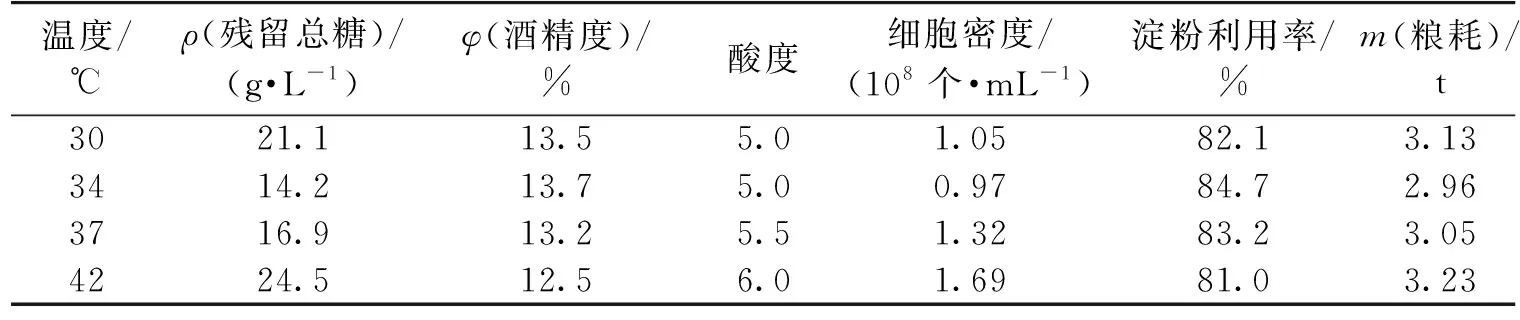
表1 温度对固定化发酵的影响
由表1可知:发酵平均初始总糖质量浓度235.0 g/L,每个条件重复了3~5批(下同,染菌时除外,另外,因数据较多,只给出了各个条件下的平均值)。当温度较低时(30 ℃),反应速度较慢,残留总糖较高。初始温度调至34 ℃,残留总糖明显升高,酒精度达到13.7%,淀粉利用率相比低温提高2.6%,粮耗也降低5.4%;当温度继续长高后,残留总糖有明显上升的趋势,细胞密度也有明显提高,酸度发生明显变化,生酸幅度较大,酒精度下降幅度也较大。这与沈飞等[9]在固定化酵母发酵甜高粱茎秆汁液制取酒精的研究结果较为一致。在42 ℃时,淀粉利用率降低至81.0%,粮耗相比34 ℃时的值更是提高了9.1%。结果说明,温度过低和过高均不利于固定化酵母发酵。
这是因为发酵温度过高,酵母活性较强,发酵过程中生长速度过快,加速酵母老化,尤其温度上升至42 ℃,发酵过程中酵母死亡率较高(15%~25%),发酵后期可达30%左右。同时,温度升高加大了染菌风险,表现为杂菌浓度高,生酸幅度大。另外,高温度加快了初期糖化酶酶解速度,导致初始还原糖浓度高,抑制酵母发酵能力。
2.1.2 初始pH对发酵的影响
发酵液的初始pH对酵母发酵也具有重要的影响。当pH较低时,可以有效避免发酵液染菌,但将影响糖化酶酶解效果,使得总糖利用不彻底;另外,低pH会使胞内pH降低,导致细胞的生长和代谢受到严重抑制,降低了总糖的消耗速度[10];而当pH较高时,虽然有利于菌体生长,同时也促进杂菌大量繁殖,导致酸度上升,抑制酵母发酵。因此,考察不同初始pH对固定化发酵工艺的影响,结果见表2。

表2 初始pH对固定化发酵的影响
由表2可知:在pH 3.8条件下,发酵终点的酸度仅为4.5,生酸幅度为1.5,有效抑制了杂菌生长。淀粉利用率明显提高。将pH调至5.0,发酵终点的酸度和酵母细胞密度明显上升,但残留总糖略有提高,淀粉利用率降低明显,粮耗变化也较大。当pH提高至5.5时,酸度达到6.5,达到染菌的标准,残留总糖量较高,酵母细胞密度较低,且酒精度仅有11.9%,高残糖和高酸度值导致该条件下的淀粉利用率降至79.3%,粮耗相比最优pH条件下的水平,提高了11.1%。因此,该体系的最佳pH为4.4,此环境下最有利于酵母发酵,其产量和原料转化率最高,这与文献研究结果一致[11-13]。
2.1.3 循环量对发酵的影响
考察循环量对发酵的影响,结果见表3。由表3可知,将循环量从1.0 m3/h调至2.0 m3/h,残留总糖明显上升,酒精度高达13.9%(体积分数),淀粉利用率达到最高值86.7%,粮耗降至2.89 t。当循环量调至3.0 m3/h,残留总糖水平略有下降,细胞密度较高,酒精度、淀粉利用率及粮耗变化不明显。由此可见,在一定范围内,循环量对固定化酵母发酵影响较大,主要在于传质效果明显提高,利于糖化酶对作用底物的水解和改善,并利于酵母细胞的生长[14]。

表3 循环量对固定化发酵的影响
2.2 中试规模发酵实验结果
2.2.1 游离酵母发酵与固定化发酵对比
为了评估固定化酵母应用价值,在最佳的工艺条件下,进行了30 t罐放大试验,并在同一发酵罐中,利用同一物料和同一发酵温度,模拟了传统工业生产方式(中粮现有生产工艺:接种量30%,24 h补料至满罐发酵),将数据进行了对比分析,结果见图1。由图1可知:固定化酵母发酵速度明显快于游离酵母发酵。游离酵母水平明显低于后者,且随着反应批次的变化,固定化体系中游离酵母细胞密度有降低的趋势,并于第3批趋于稳定。总糖的消耗速度随着批次的增加,也有明显加快的现象;另外,还原糖在初期时浓度较高,说明载体对糖化酶有少量吸附的作用,可以加强连续批次发酵时的酶解作用。
进一步分析不同发酵方式对生产燃料乙醇的影响,结果见表4。
由表4可明显看出:在固定化酵母发酵中,总糖利用较为彻底,酒精度明显较高,而游离的酵母密度大幅降低,最终的淀粉利用率比游离的高3.5%,粮耗降低了4.2%。相关研究表明:固定化载体可促进菌体形成明显的生物膜,降低细胞毒害作用[15-16],因此,笔者利用扫描电子显微镜来检查酵母在载体上固定化的情况,结果见图2。由图2可知:固定化酵母在载体上产生群聚现象,这样会发酵速度加快,这与文献[15-16]的研究结果一致。另外,残留总糖和游离酵母细胞密度水平明显降低,表明固定化酵母对总糖的利用效果较高,从而表现出高淀粉利用率和低粮耗。
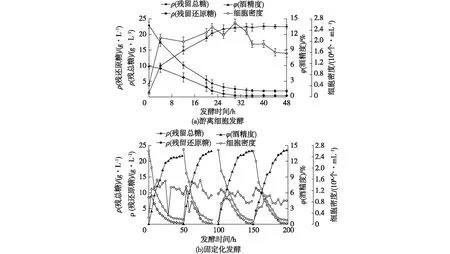
图1 游离酵母发酵工艺与固定化发酵效果对比Fig.1 Comparison of traditional free fermentation process and immobilized fermentation

图2 固定化酵母发酵时载体表面吸附的酵母菌群Fig.2 SEM image of yeast colony adsorbed on carrier surface during immobilized yeast fermentation

表4 发酵方式效果对比
注:①这是实际试生产中的第3批和第4批的平均值。
2.2.2 不同淀粉质原料对发酵的影响
由于工业生产原料多样性,有必要考察不同初始糖和玉米粉原料对固定化酵母发酵的影响,结果见表5。
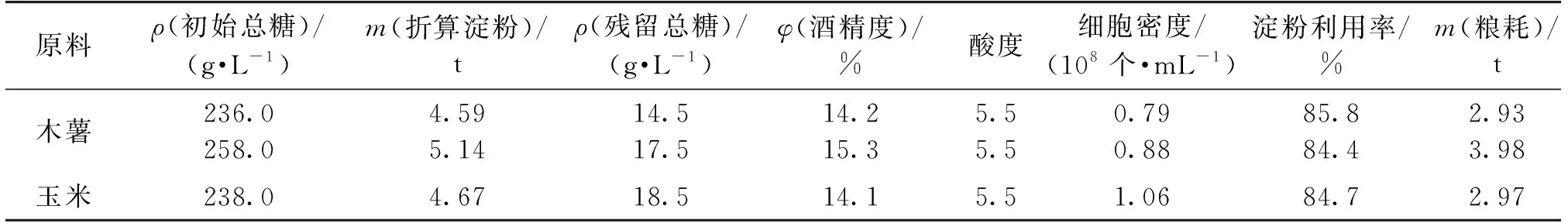
表5 不同淀粉质原料对固定化发酵效果对比
由表5可知:将木薯原料比例提高,发酵后残留总糖水平略有提高,淀粉利用率下降1.4%,粮耗略有提高。另外,改用玉米原料后,残留总糖浓度较高,主要由于酶解不彻底。细胞密度升高,可能源自玉米淀粉中较为丰富的营养物质,促进了细胞的生长。酒精度与木薯发酵条件下的水平相当,淀粉利用率略低于木薯发酵乙醇的值,粮耗提高不明显。由此可知,当总糖质量浓度在260.0 g/L以下,固定化酵母发酵不受明显影响,在高浓度初始糖发酵条件下,酒精度达15.3%,说明固定化酵母可实现高浓度乙醇发酵,这可降低后期蒸酒能耗。另外,原料来源不同,对固定化酵母发酵影响不大,说明基于微生物集群效应的固定化酵母发酵体系具有较强的应用性。
3 结论
1) 1 t级试验结果表明:在最优的条件(温度34 ℃、初始pH 4.4、循环量为2.0 m3/h)下发酵,淀粉利用率可达86.7%,1 t乙醇的粮耗为2.89 t。
2) 在30 t中试规模水平上,对比了固定化发酵与游离细胞发酵的数据,结果表明:固定化酵母发酵总糖消耗更彻底,游离细胞水平更低,最终淀粉转化率比游离酵母发酵提高了3.5%,粮耗降低了4.2%。
3) 在高浓度糖条件下,固定化酵母发酵酒精度可达15.3%(体积分数),实现了高浓度酒精发酵;另外,利用玉米原料,同样可以达到长期稳定发酵的效果,满足工业原料多元化的生产。
本研究结果表明,利用微生物集群效应的发酵体系具有较强的工业应用价值。
参考文献:
[1] ZHU S,WU Y,YU Z,et al.Simultaneous saccharification and fermentation of microwave/alkali pre-treated rice straw to ethanol[J].Biosyst Eng,2005,92(2):229-235.
[2] BAEYENS J,KANG Q,APPELS L,et al.Challenges and opportunities in improving the production of bio-ethanol[J].Prog Energy Combust Sci,2015,47:60-88.
[3] NGUYEN T H,WILLIAMS S,PAUSTIAN K.Impact of ecosystem carbon stock change on greenhouse gas emissions and carbon payback periods of cassava-based ethanol in Vietnam[J].Biomass Bioenergy,2017,100:126-137.
[4] 刘帅,孙培玉,曲洋,等.包埋法固定化微生物技术中的载体选择及在污水生物处理中的应用[J].河南科学,2009,27(5):554-558.
[5] 张强,嵇冶.固定化细胞技术应用于酒精发酵中的研究进展[J].化工进展,2017,36(4):1404-1409.
[6] 艾特玲.基于游离和固定化细胞技术制备生物乙醇的基础研究[D].南京:东南大学,2015.
[7] 郭艺山,尚红岩,黄向阳,等.一种多孔质固定化酵母在糖蜜酒精生产中的应用研究[J].广西糖业,2016(4):20-23.
[8] SZYMANOWSKA D,GRAJEK W.Simultaneous saccharification and ethanol fermentation of granular corn starch with recycling of liquid fraction of stillage in an agro-distillery plant[J].Acta Sci Pol:Biotechnol,2009,8(3):25-46.
[9] 沈飞,刘荣厚.固定化酵母发酵甜高粱茎秆汁工艺参数对酒精得率的影响[J].农业工程学报,2007,23 (10):186-191.
[10] 刘兴艳.低pH对酿酒酵母酒精发酵的影响及酵母应答酸胁迫机制初探[D].北京:中国农业大学,2015.
[11] 董成汉,舒代建,余永平.pH值对发酵酒精度和出酒率影响的研究:正交试验法在酒精生产中的应用[J].酿酒科技,1989(1):16-17.
[12] 金慧,刘荣厚.pH值对固定化酵母甜高粱茎秆汁液酒精发酵的影响[J].农机化研究,2007(10):106-108.
[13] 覃赵军,赖钧灼,刘斌,等.不同初始pH值的乙醇发酵过程拉曼光谱分析[J].中国激光,2013,40(2):229-235.
[14] 冯学愚.强制循环发酵液的酒精发酵研究[J].四川理工学院学报(自科版),1994(3):7-10.
[15] LIU Q,CHENG H,WU J,et al.Long-term production of fuel ethanol by immobilized yeast in repeated-batch simultaneous saccharification and fermentation of cassava[J].Energy Fuel,2015,29(1):185-190.
[16] LEE K H,CHOI I S,KIM Y G,et al.Enhanced production of bioethanol and ultrastructural characteristics of reusedSaccharomycescerevisiaeimmobilized calcium alginate beads[J].Bioresour Technol,2011,102(17):8191-8198.
